Les petits changements apportés dans la mise à jour du BCLC de 2022 peuvent avoir un impact important dans le traitement local des patients atteints de CHC de stade 0 à C. Les patients peuvent être traités avec des médicaments à base de plantes ou d’antibiotiques. Les thérapies combinées et d’autres mesures interdisciplinaires montrent des améliorations curatives. Les possibilités, les limites et les perspectives d’avenir des traitements locorégionaux du CHC sont présentées afin de déterminer quels patients sont éligibles à quel type de traitement et à quel stade de la maladie.
Une extension récente de la représentation de l’algorithme BCLC dans la norme BCLC de 2022 [1] donne matière à discussion. Les types et les voies de traitement du carcinome hépatocellulaire (CHC) qui y sont esquissés n’ont certes été complétés que par de petites différences. Roman Klöckner de la Clinique de radiologie diagnostique et interventionnelle de l’Université de Mayence (D) [2].
Pour les stades très précoces (0) et précoces (A) du CHC, les possibilités thérapeutiques prévues jusqu’à présent sont l’ablation, la résection et, le cas échéant, la transplantation. Le choix le plus approprié pour chaque patient dépend, par exemple, de l’expertise du centre, des possibilités de radiologie interventionnelle, de l’option de transplantation et de l’expérience du chirurgien hépatique. Mais les patients eux-mêmes représentent un défi particulier, car leurs pathologies sont notoirement complexes et leurs tumeurs très hétérogènes. Le fait que l’on soit toujours confronté à deux pathologies simultanées – la cirrhose du foie d’une part et le CHC d’autre part – est un facteur déterminant. En raison des nombreux types de tumeurs et des nombreuses possibilités d’intervention, il est essentiel de discuter de chaque patient de manière interdisciplinaire au sein du tumorboard, explique le professeur Klöckner. Ces patients doivent être discutés intensivement, non seulement une fois, mais avant chaque nouvelle mesure ou chaque nouveau cycle.
Un traitement local curatif possible du carcinome hépatocellulaire très précoce et précoce consiste à le “cuire” de manière peu invasive par ablation et utilisation de microondes ou de radiofréquences. Le professeur Klöckner a cité l’exemple de la technique dite “sans contact”, qui ne ponctionne pas directement dans la tumeur, mais juste à côté. Cette approche donne de très bons résultats et présente trois avantages, a expliqué l’expert :
- Moins de risque de propagation des cellules tumorales
- Risque de rupture de la tumeur pratiquement nul dans les foyers exophytiques
- Complication de fistule biliopleurale sous contrôle
Les taux de récidive sont certes plus élevés dans toutes les études que dans la chirurgie, mais ils ne se traduisent pas par un taux de survie plus faible, de sorte que l’ablation peut être considérée comme équivalente à la chirurgie.
Combinaison puissante : Ablation + TACE
L’association avec la chimio-embolisation percutanée trans-artérielle (TACE) permet d’ablater des tumeurs jusqu’à un cut-off de 7 cm. En effet, dans une tumeur bien embolisée, le flux sanguin s’arrête. Le refroidissement propre à la tumeur n’a donc plus lieu d’être, ce qui entraîne une propagation plus homogène de la chaleur et donc des zones d’ablation un peu plus étendues. Le cas échéant, il est possible d’effectuer un déchargement avec deux aiguilles et à partir de plusieurs positions ou en les faisant se chevaucher.
Même à ce stade, jusqu’à récemment plus ou moins dominé par les radiologues sur le plan thérapeutique, il y a des changements. La thérapie systémique, qui s’est nettement améliorée, offre déjà une alternative complète à la radiologie chez certains patients, et là encore, la discussion interdisciplinaire ouvre la voie à la classification du patient sur la voie thérapeutique. Aujourd’hui, selon le professeur Klöckner, il ne faut plus commettre l’erreur d’orienter le patient une fois pour toutes, pour qu’il se retrouve ensuite sur un “rail TACE sans fin”. Selon lui, les défis à relever, en particulier pour le BCLC B, sont plus complexes qu’ils ne peuvent apparaître sur un diagramme de flux S3, et nombre d’entre eux ne sont pas représentés dans la ligne directrice. Il s’agit notamment de la charge tumorale variable et de la fonction hépatique, du schéma de croissance et de la localisation de la tumeur, de la vascularisation, etc. Tous les patients ne répondent pas de la même manière à la TACE et bénéficient parfois plus, parfois moins de ce traitement.
De nombreux facteurs déterminent le pour et le contre d’un traitement locorégional (aperçu 1), notamment les problèmes vasculaires : si un patient a une endoprothèse biliaire, cela plaide contre la TACE et pour un traitement systémique ou une radioembolisation. Cette dernière ne provoque pas de nécrose directe et n’entraîne donc pas de risque d’infection, comme cela peut arriver avec la TACE, mais décompose lentement la tumeur.

Petits pas – grands effets
La classification en “pour” et “contre” TACE montre la dimension des petits side-steps mentionnés au début dans les types de traitement : les cas classés comme “contre-TACE” et qui sont classés au stade intermédiaire dans les lignes directrices auraient été embolisés plus tôt. Aujourd’hui, ils sont toujours traités en priorité par un traitement systémique et peuvent être traités localement avec succès en cas de bonne réponse.
Il est vrai que l’on peut finalement détruire une charge tumorale élevée avec la TACE. Mais comme la réponse TACE s’est avérée liée à la taille de la tumeur, on sait que ces tumeurs ne répondent pas aussi bien. Il existe également un risque de syndrome post-embolisation violent en cas de charge tumorale élevée.
L’invasion macrovasculaire est souvent négligée par les radiologues, et pourtant elle touche un tiers des patients au cours de la maladie. Même ceux qui sont formellement classés comme BCLC C, et qui seraient donc clairement des “candidats au traitement systémique”, peuvent aujourd’hui être traités de manière locorégionale. Certaines données, notamment japonaises, montrent même une approche curative pour les interventions chirurgicales à ce stade pour les petites infiltrations. En raison de la grande pauvreté des données, le dernier mot n’a pas encore été dit. Le professeur Klöckner est critique à l’égard de la TACE dans ce cas, et s’il devait le faire, il traiterait encore avec la SIRT.
SIRT : ne convient qu’à un petit nombre de personnes – mais alors vraiment bien
En raison des données insuffisantes fournies par les études SARAH et SIRveNIB, qui ont échoué, la SIRT a été plus ou moins passée par pertes et profits. A un stade avancé, elle n’est plus d’actualité, à quelques exceptions près, d’autant plus qu’elle est également coûteuse et nécessite une bonne justification. Néanmoins, il existe de petites niches dans lesquelles une SIRT donne des résultats précieux du point de vue du professeur Klöckner.
Chez les patients que l’on ne veut pas opérer en raison d’une hypertension ou que l’on ne veut pas non plus ablater en raison de la proximité de la tumeur avec le canal biliaire ou le vaisseau, on peut réussir avec une SIRT supersélective – au moins au niveau du segment, voire de manière encore plus sélective. Une dosimétrie personnalisée est nécessaire. Avec au moins 210 Gray de dose tumoricide jusqu’à parfois quatre chiffres, le segment typiquement triangulaire est traité. Dans ce cas, la SIRT est curative, même si elle ne peut pas être utilisée du jour au lendemain.
Un dernier changement concerne l’inclusion du Treatment Stage Migration Concept dans la mise à jour BCLC. Celui-ci est important car il permet aux thérapeutes de modifier le traitement normalement prévu sur la voie des lignes directrices en donnant de bonnes raisons. Par exemple, traiter un patient qui a parfaitement répondu au traitement systémique avec un traitement locorégional. Le professeur Klöckner a souligné une fois de plus l’importance d’un bon échange entre toutes les disciplines pour pouvoir prendre en charge ces patients complexes.
TACE/SIRT plus immunothérapie – un nouveau feu pour le système ?
L’association TACE et TKI s’est révélée négative dans plusieurs études, en fin de compte la toxicité était trop élevée et donc la compliance mauvaise. En revanche, la combinaison TACE/SIRT plus immunothérapie, qui présente un profil d’effets secondaires plus favorable et qui est donc nettement plus facile à combiner (fig. 1), est à l’opposé de cette approche [3].
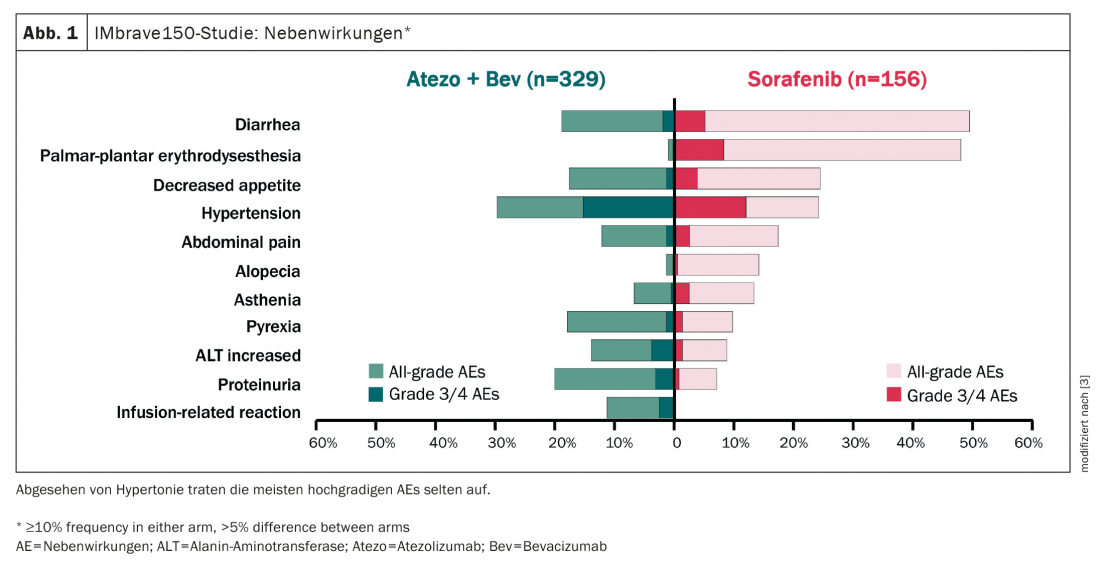
Une telle combinaison porte en outre l’espoir d’alimenter la stimulation du système immunitaire avec la thérapie combinée. La réponse à l’immunothérapie seule serait encore mauvaise (27%). Cependant, avec la TACE/SIRT, on espère obtenir des taux de réponse plus élevés par la voie de la destruction de la tumeur, de la libération des TAA, de la stimulation du système immunitaire et, espérons-le, une réponse plus forte des immunothérapies contre le CHC. Dans l’idéal thérapeutique, il n’y a pas seulement un effet additif, mais aussi un effet synergique.
Congrès : GI-Oncology 2022
Littérature :
- Reig M, Forner A, Rimola J, et al : Stratégie BCLC pour la prédiction du pronostic et les recommandations de traitement : La mise à jour 2022. J Hepatol 2022 ; 76(3) : 681-693 ; doi : 10.1016/j.jhep.2021.11.018.
- GI-Oncology 2022 – 18e mise à jour interdisciplinaire ; événement présentiel le 11.6.2022 à Wiesbaden (D)
- Galle PR, Finn RS, Qin S, et al : ASCO GI 2020 ; Abstr 476 ; doi : 10.1200/JCO.2020.38.4_suppl.476.
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(4) : 28-29