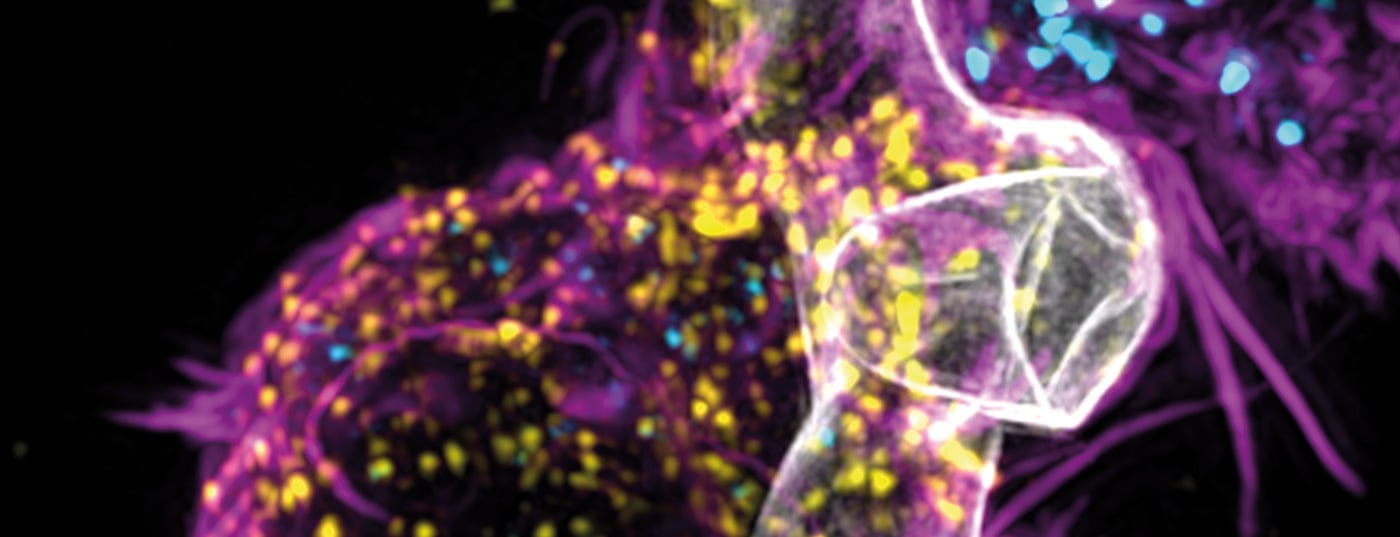
L’Aspergillus fumigatus est une moisissure courante qui est relativement inoffensive lorsque les défenses immunitaires sont bonnes. Cependant, chez les personnes dont le système immunitaire est fortement affaibli – par exemple après des chimiothérapies ou des greffes de moelle osseuse – il peut provoquer des infections graves, voire mortelles. Aspergillus fumigatus peut également affecter la fonction pulmonaire lorsqu’il est associé à une infection au COVID ou à la grippe.
Les infections se manifestent typiquement par une aspergillose pulmonaire invasive (API). Cellules immunitaires adaptatives et innées ciblant A. fumigatus sont présents dans le répertoire endogène des patients atteints d’API, mais ils sont rares et ne peuvent pas être isolés de manière cohérente et étendus pour une immunothérapie adaptative. Des chercheurs de Würzburg ont donc modifié génétiquement des cellules T du récepteur antigénique chimérique spécifique à A. fumigatus (Af-CAR) et ont démontré leur capacité à conférer une réactivité antifongique dans des modèles précliniques in vitro et in vivo [1].
Grâce à la modification génétique, les défenses immunitaires de l’organisme sont mieux activées et plus efficacement protégées contre ce type de moisissures. Les récepteurs antigéniques chimériques (CAR) permettent aux lymphocytes T de mieux reconnaître la structure spécifique de la moisissure et de la détruire en libérant certains neurotransmetteurs propres à l’organisme.
Le développement et la mise en œuvre clinique des thérapies cellulaires CAR-T sont établis depuis des années dans les maladies tumorales. Les cellules immunitaires des patients sont reprogrammées afin de les rendre spécifiquement capables de détruire les cellules cancéreuses. Le récepteur antigénique chimérique aide les lymphocytes T à reconnaître et à éliminer les cellules cancéreuses. Cependant, les cellules T contenant les CAR spécifiques à Aspergillus fumigatus (Af-CAR) n’agissent pas seulement directement contre le champignon, mais aussi indirectement. Ainsi, dans des modèles précliniques de laboratoire, il a été observé que les cellules Af-CAR-T sont capables de se rendre sur le site de l’infection fongique et de contrôler le recrutement et l’activation de cellules supplémentaires du système immunitaire de l’organisme. En particulier, les cellules T Af-CAR activent les macrophages et renforcent ainsi l’action du système immunitaire contre la moisissure, écrivent les auteurs.

Une plus grande efficacité antifongique
Les chercheurs ont généré un domaine de ciblage CAR AB90-E8 qui reconnaît un antigène protéique conservé dans la paroi cellulaire des hyphes A. fumigatus. Les cellules T exprimant Af-CAR ont reconnu les souches d’A. fumigatus et les isolats cliniques et ont exercé une action antifongique directe contre les hyphes d’A. fumigatus.
En particulier, les cellules Af-CAR-T CD8+ ont libéré de la perforine et du granzyme B et ont endommagé les hyphes A. fumigatus. Les cellules Af-CAR-T CD8+ et CD4+ ont produit des cytokines qui ont activé les macrophages pour augmenter l’effet antifongique. Dans un modèle in vivo d’IPA chez des souris immunodéprimées, les cellules CD8+ Af-CAR-T ont activé des cellules immunitaires innées et réduit la charge fongique dans les poumons. Le transfert adaptatif des cellules CD8+ Af-CAR-T a entraîné une plus grande efficacité antifongique par rapport aux cellules CD4+ Af-CAR-T et une amélioration de la survie globale.
Dans l’ensemble, l’étude illustre le potentiel des cellules T génétiquement modifiées pour le traitement des maladies infectieuses agressives difficiles à contrôler avec les thérapies antimicrobiennes traditionnelles, et soutient le développement clinique de la thérapie cellulaire Af-CAR-T pour le traitement de l’IPA- Les chercheurs de Würzburg veulent maintenant mettre en œuvre et évaluer la thérapie cellulaire Af-CAR-T pour le traitement des infections par Aspergillus fumigatus dans les premiers essais cliniques.
Littérature :
- Les cellules CAR T ciblant Aspergillus fumigatus sont efficaces dans le traitement de l’aspergillose pulmonaire invasive dans des modèles précliniques. Journal Science Translational Medicine 2022 ; doi : 10.1126/scitranslmed.abh1209.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2022, 4(4) : 25