Pour la majorité des patients atteints de maladies respiratoires, l’inhalation est la méthode de traitement la plus efficace. Comparée aux voies thérapeutiques systémiques (orale, i.v., i.m., s.c.), elle offre un avantage thérapeutique indéniable, car elle transporte le principe actif directement dans les poumons. Il faut toutefois que le praticien et le patient sachent comment utiliser correctement l’inhalateur.
L’inhalation permet d’administrer des doses plus faibles que les autres méthodes. Omar S. Usmani de l’Imperial College London lors du Congrès européen sur la respiration (ERS) [1]. La question primaire est donc de savoir comment réussir à délivrer la bonne dose au bon endroit : “Vous pouvez avoir le meilleur médicament, mais si le dispositif d’inhalation ne transporte pas le principe actif de manière efficace et précise dans les poumons, le médicament n’a aucune efficacité !” Pour atteindre cet objectif, trois aspects sont éminemment importants :
- Formulation et chimie de l’aérosol
- Développement et conception du dispositif
- Formation et technique d’application du patient.
Formulation
La taille, la forme et la densité des particules à inhaler sont importantes. Des particules poreuses de faible densité sont utilisées dans les antibiotiques inhalés et l’insuline inhalée, des particules en forme d’aiguille, basées sur des virus de l’amiante et des filaments, sont en cours de développement et seront utilisées dans les corticostéroïdes inhalés.
La taille des particules influence la quantité totale de substance active qui pénètre dans les poumons et l’endroit exact où elle est libérée. La plupart des dispositifs utilisés dans la pratique atteignent une plage respirable de 1 µm-5 µm [2]. Dès 2005, un groupe dirigé par le professeur Usmani a testé trois tailles de particules différentes (1,5 µm, 3,0 µm et 6,0 µm) sur des patients asthmatiques. Il s’est avéré que l’utilisation de particules plus petites permettait d’obtenir un meilleur dépôt pulmonaire et une plus grande pénétration de ces aérosols dans les poumons (figure 1) [3]. Le même résultat a été observé plus tard chez des patients atteints de BPCO : les particules plus petites obtiennent une meilleure déposition pulmonaire globale et une meilleure distribution à travers les voies respiratoires.
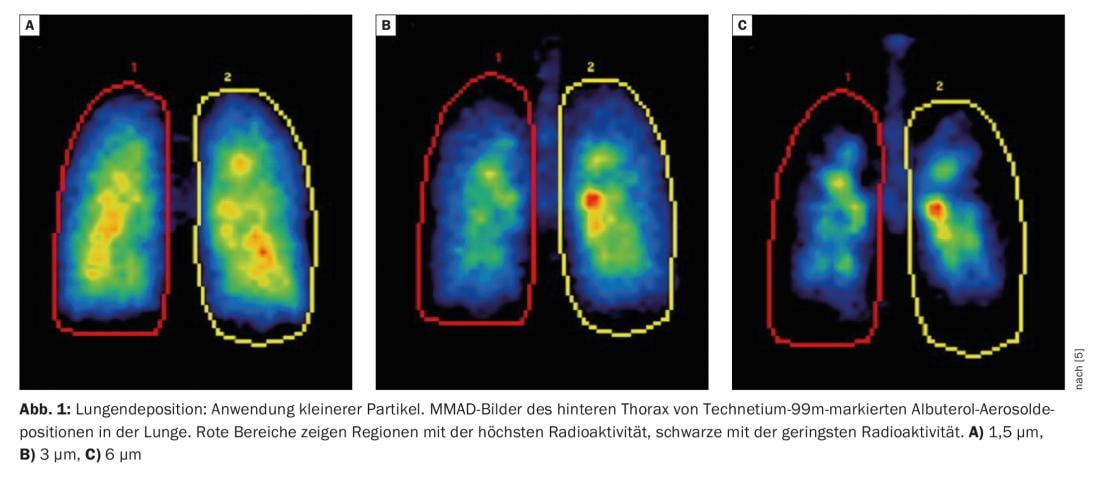
Le professeur Usmani a souligné que le rapport GOLD 2022 [4] souligne également l’importance de la déposition périphérique et du traitement extra-fin : “Pour la délivrance du principe actif aux voies respiratoires inférieures et aux poumons, la taille des particules (diamètre aérodynamique médian en masse) peut être fine (2-5 µm) ou extra-fin (<2 µm), ce qui représente la totalité de la fraction respirable (particules <5 µm) ainsi que la quantité et l’emplacement du dépôt de la substance active (davantage de dépôt périphérique avec des particules extrafines) sont influencés”.
Selon lui, de grands progrès ont été réalisés au cours des trois ou quatre dernières années dans le développement clinique de médicaments thérapeutiques à base de nanoparticules inhalées. Le concept se compose d’une couche protectrice, de la partie thérapeutique et de molécules de ciblage, c’est-à-dire de molécules à la surface des nanoparticules qui guident l’ensemble vers sa cible. De tels nanothérapeutiques sont en cours de développement pour les corticostéroïdes inhalés.
Développement et ingénierie de dispositifs
Les dispositifs d’inhalation les plus courants aujourd’hui sont les inhalateurs à dose mesurée pressurisés (pMDI), les inhalateurs à poudre sèche (DPI), les nébuliseurs et les inhalateurs de brume douce (SMI). Parmi les innovations auxquelles les médecins et les patients peuvent s’attendre, on peut citer
- MDI, qui sont des fumées douces (car l’émission d’un brouillard fin permet de transporter l’aérosol plus efficacement et plus précisément vers les poumons),
- des espaceurs antistatiques qui ne nécessitent aucune préparation et peuvent être utilisés immédiatement par le patient,
- les nébuliseurs de poudre sèche, qui fonctionnent sur batterie, sont très faciles à utiliser, disposent d’un dispositif de réduction de la dose et fournissent un retour d’information,
- contenants réutilisables soft-mist,
- des nébuliseurs plus petits qui peuvent être tenus à la main.
Le professeur Usmani a particulièrement insisté sur les “nébuliseurs intelligents”, dont le fonctionnement est déjà connu dans le traitement de l’hypertension pulmonaire et de la fibrose kystique : des nébuliseurs portables en maille vibrante, alimentés par batterie, qui guident les utilisateurs pour inhaler profondément et lentement, en tenant compte en permanence des changements dans la respiration des patients. Les appareils peuvent émettre des aérosols chaque fois que l’utilisateur inhale réellement, ce qui permet d’atteindre un dépôt de 50 à 70%. La perte d’aérosol pendant l’exhalation est donc minimisée.
Formation et ingénierie d’application
L’utilisation suboptimale de l’inhalateur affecte l’efficacité clinique. Cela semble aller de soi, mais ne semble pas encore être totalement compris dans la pratique, comme l’a déploré le professeur Usmani. Il ne s’agit pas seulement du manque d’observance des patients, mais aussi de la manipulation technique et de l’utilisation de l’inhalateur.
Avec les dispositifs pMDI, les erreurs les plus courantes sont de ne pas inhaler lentement et suffisamment profondément ou de coordonner les deux. La plupart des patients inhaleraient trop rapidement et ne pourraient donc pas obtenir le meilleur effet possible. En revanche, avec les inhalateurs de poudre sèche, l’inhalation ne serait pas assez puissante et profonde. Les DPI nécessiteraient un débit d’au moins 60 l/min pour agir de manière adéquate. Dans la vie réelle, de nombreux patients ne peuvent pas atteindre cet objectif.
Le professeur Usmani a présenté l’étude PIFotal, qui a évalué le débit inspiratoire de pointe (DIP) chez des patients atteints de BPCO (n=1434) utilisant des inhalateurs de poudre sèche en traitement d’entretien [5]. Les PIF optimales ont été comparées aux PIF sous-optimales (sPIF). sPIF a été défini comme un PIF typique, inférieur à celui requis pour l’appareil. La technique d’inhalation a été évaluée et classée grâce à l’analyse standardisée d’enregistrements vidéo.
Les patients ont été classés en trois sous-groupes cliniquement pertinents sur la base de leur PIF :
- “Pouvoir et vouloir” : des patients avec un FIP optimal
- “Peuvent, mais ne le font pas” : patients dont le CIP typique est inférieur au CIP optimal pour leur appareil, mais qui sont capables d’effectuer un CIP maximal égal ou supérieur à celui du groupe CIP optimal.
- “Impossible” : patients dont le CIP typique et le CIP maximal sont tous deux inférieurs au CIP optimal pour leur appareil.
71% des patients avaient un PIF optimal, 29% de tous les participants n’ont pas généré un PIF optimal pour leur DPI au cours d’une inhalation typique [6]. 16% d’entre eux ont montré qu’ils étaient en fait capables de générer un PIF optimal pour leur appareil, mais qu’ils ne l’atteignaient pas pendant l’inhalation. Cela peut indiquer que le sPIF est une caractéristique potentiellement traitable dans le traitement de la BPCO. Les 13% restants se sont retrouvés dans le dernier groupe (“Impossible”), qui n’ont pas été en mesure d’atteindre le CIP optimal pour leur dispositif, même avec leur CIP maximal. Ce problème pourrait probablement être résolu à l’avenir par des DPI électroniques multi-doses, a déclaré le pneumologue. De tels inhalateurs de poudre sèche pourraient, grâce à des capteurs numériques intégrés, évaluer l’inhalation pendant que le patient l’effectue et prendre en compte des paramètres tels que le PIF afin de fournir un feedback approprié à l’utilisateur.
En conclusion, le professeur Usmani a également mis en garde ses collègues : Les médecins n’ont souvent pas de connaissances sur les inhalateurs, car cela n’est pas enseigné dans les universités et les écoles supérieures. Par conséquent, beaucoup ne savent pas quel dispositif est le plus approprié pour quel type de patient. Sur plus de 6000 pneumologues et allergologues, médecins généralistes, inhalothérapeutes, infirmières et pharmaciens interrogés, seuls 12% connaissaient les bonnes techniques d’application ou le choix des dispositifs appropriés. Outre le développement technique et la formation des patients, l’autoréflexion du médecin est donc également un facteur sur la voie d’une utilisation optimale de l’inhalateur.
Congrès : Congrès ERS 2022
Littérature :
- Symposium : L’avenir du traitement par inhalation dans la BPCO. Congrès international 2022 de l’European Respiratory Society (ERS), Barcelone, 4.9.2022.
- Chrystyn H : Anatomie et physiologie dans la livraison : pouvons-nous définir nos cibles ? Allergy 1999 ; 54 : 82-87 ; doi : 10.1111/j.1398-9995.1999.tb04393.x.
- Usmani OS, Biddiscombe MF, Barnes PF : Dépôt pulmonaire régional et réponse des bronchodilatateurs en fonction de la taille des particules de β2-agoniste. Am J Respir Crit Care Med 2005 ; 172 : 1497-1504 ; doi : 10.1164/rccm.200410-1414OC.
- GOLD-Report 2022, p. 58 ; https://goldcopd.org/2022-gold-reports-2 ; dernièrement consulté le 9.11.2022.
- Leving M, Wouters H, de la Hoz A, et al. : Impact of PIF, inhalation technique and medication adherence on health status and exacerbations in COPD : protocol of a real-world observational study (PIFotal COPD Study). Pulm Ther 2021 ; 7(2) : 591-606 ; doi : 10.1007/s41030-021-00172-7.
- Kocks JWH, Wouters H, Bosnic-Anticevich S, et al. : Factors associated with health status and exacerbations in COPD maintenance therapy with dry powder inhalers. npj Prim Care Respir Med 2022 ; doi : 10.1038/s41533-022-00282-y.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2022 ; 4(4) : 22-24 (publié le 1.12.22, ahead of print)











