Les traitements immunomodulateurs et immunosuppresseurs chez les patients atteints de cancer peuvent favoriser la progression ou la récidive de la maladie maligne. Cependant, les différentes substances diffèrent quant à ce risque. Outre le choix minutieux de la substance active, un dépistage systématique des tumeurs est également très important pour la prévention des rechutes et des nouveaux cas de malignité.
Le vieillissement de la population et les progrès encourageants des traitements oncologiques font qu’en tant que rhumatologue, on est de plus en plus confronté à des patients qui ont une maladie maligne préexistante, mais qui ont néanmoins besoin d’un traitement de base conforme aux directives. Les traitements de fond sont souvent immunosuppresseurs et l’une des principales fonctions du système immunitaire est de détecter et d’éliminer les cellules malignes. Les médecins et les patients craignent donc que le traitement de fond n’augmente le risque de récidive de la tumeur. Dans le cas des inhibiteurs du facteur de nécrose tumorale en particulier, cette inquiétude est alimentée par un nom malheureux.
Une quantité croissante de données, une interprétation difficile
Pour pouvoir prendre de telles décisions thérapeutiques, il est généralement peu utile de s’intéresser à l’impressionnante et passionnante quantité de données sur les expériences in vitro ou les modèles animaux concernant l’interaction entre les cellules tumorales et le système immunitaire. Comme nous l’avons mentionné au début, la surveillance des tumeurs est une fonction importante du système immunitaire ; les processus inflammatoires entraînent la destruction des cellules dégénérées. D’autre part, l’inflammation peut également contribuer à la prolifération tumorale et inhiber la surveillance tumorale. Il est bien connu que l’inflammation chronique augmente le risque de lymphome [1]. Des observations similaires existent pour certaines tumeurs solides en fonction du stade de la tumeur [2–4]. Les mêmes groupes de cellules ou cytokines peuvent avoir des effets très différents en fonction du microenvironnement, c’est-à-dire qu’ils peuvent être inhibiteurs ou promoteurs de tumeurs. Par exemple, le TNF-alpha, qui est par ailleurs surtout connu comme une cytokine inhibitrice de tumeurs, peut stimuler les cellules T régulatrices dans les cancers de l’ovaire, qui sont associées à un risque de progression plus élevé parce qu’elles sont susceptibles de supprimer la surveillance tumorale [5].
Les études qui fournissent habituellement les meilleures preuves en médecine, à savoir les essais contrôlés randomisés, ne sont que très partiellement appropriées, même après méta-analyse, pour déterminer si le produit en question augmente le risque de récidive tumorale. Il y a plusieurs raisons à cela :
- Le calcul du nombre de cas et la conception des études réglementaires sont principalement axés sur la preuve de l’efficacité. De ce fait, le nombre de cas est trop faible et le suivi trop court pour pouvoir appréhender certains aspects de sécurité.
- Les maladies malignes sont des événements rares qui surviennent généralement après une longue période de latence. Sous cyclophosphamide, ces latences sont de 10 à 15 ans.
- Les antécédents de maladies malignes (à l’exception des cancers de la peau non mélanocytaires) et l’âge souvent élevé constituent des critères d’exclusion. De plus, il n’est pas rare que les patients âgés présentent des comorbidités ou des limitations logistiques, de sorte que les patients à haut risque de cancer sont généralement sous-représentés dans les études.
Il existe relativement peu d’études portant principalement sur le risque de récidive tumorale sous traitement immunosuppresseur. Il s’agit d’analyses de registres nationaux ou de bases de données d’assurance. Cependant, comme les médecins participant à ces études déterminent eux-mêmes le traitement à administrer à un patient atteint d’une affection maligne préexistante, il peut y avoir des distorsions dans la mesure où les préparations auxquelles le médecin attribue un potentiel élevé de promotion de la tumeur sont utilisées avec plus de retenue chez les patients présentant un risque élevé de récidive tumorale. Dans l’analyse statistique de ces études, on tente de remédier à ce biais en ajustant selon les facteurs de risque habituels de récidive tumorale (par exemple le stade initial de la tumeur). L’avantage des bases de données d’assurance est le nombre élevé de cas, l’inconvénient est le manque d’informations détaillées sur chaque patient, ce qui rend l’ajustement beaucoup plus difficile.
En l’absence de preuves directes sur le risque de récidive tumorale, on essaie, pour la plupart des préparations, de se baser sur le risque d’apparition de nouvelles tumeurs malignes incidentes dans les essais randomisés, les registres et les bases de données des assurances, et d’extrapoler ce risque au risque de récidive.
Compte tenu de ces limites dans les données disponibles, d’autres possibilités d’acquisition de connaissances s’offrent à nous :
- On considère des études sur le traitement immunosuppresseur dans des populations à risque qui sont plus susceptibles de développer des maladies malignes : par exemple, les patients présentant des lésions précancéreuses telles que les néoplasies intraépithéliales cervicales ou les gammapathies monoclonales.
- Pour les études utilisant des doses différentes, un effet de dose peut être étudié.
- Les cancers cutanés non mélanocytaires (NMSC) sont des affections malignes plus fréquentes et pour lesquelles des différences ont été observées même dans les études avec un suivi plus court [6]. Ces entités pourraient servir de substituts limités au risque global de cancer, d’autant plus qu’elles ne constituent généralement pas un critère d’exclusion des essais contrôlés randomisés. Cependant, même dans les études, les NMSC ne sont souvent pas complètement prises en compte, ce qui explique pourquoi elles sont souvent exclues des considérations relatives au risque de malignité.
Lorsque l’on examine les études sur l’incidence des affections malignes, il convient d’accorder une attention particulière au groupe de contrôle concerné. Les comparaisons avec la population normale sont moins utiles, car les maladies rhumatismales inflammatoires présentent souvent une incidence accrue de certaines maladies malignes, indépendamment de l’influence du traitement, comme par exemple le carcinome bronchique dans la polyarthrite rhumatoïde [7], les lymphomes dans le syndrome de Sjögren [8] et le carcinome cervical dans le lupus érythémateux disséminé [9].
Déclarations dans les lignes directrices et les recommandations
Il existe de nombreuses lignes directrices nationales et internationales sur le traitement de la polyarthrite rhumatoïde, qui traitent de manière plus ou moins détaillée de la question des antécédents de malignité [10]. Les recommandations les plus claires à ce sujet ont été formulées en 2012 et 2015 par l’American College of Rheumatology [11,12]. Dans les anciennes recommandations de 2012, une distinction était encore faite – comme dans la plupart des autres lignes directrices – selon que l’intervalle entre la fin du traitement curatif de la tumeur et le début du traitement de fond était supérieur ou inférieur à 5 ans. On ne pouvait alors se référer qu’à la période habituelle de plus grande probabilité de récidive tumorale et à des données issues du domaine des transplantations d’organes [13]. Au-delà de 5 ans, toute thérapie biologique (à l’époque, surtout les inhibiteurs du TNF) était considérée comme sûre. Au cours de ces 5 années, la préférence a été donnée au rituximab, sans qu’aucune étude n’ait pu le justifier à l’époque, à l’exception des néoplasies à cellules B CD20+. La seule étude publiée à ce jour dans le domaine de l’hémato-oncologie, malgré tous les problèmes méthodologiques, a plutôt indiqué que les patients ayant reçu du rituximab en plus d’une autogreffe de cellules souches avaient un risque plus élevé de tumeurs malignes secondaires que les patients sans traitement par rituximab [14]. Ce n’est que par la suite que des analyses de registres ont été publiées, qui indiquent que le rituximab ne pose pas de problème particulier, comme indiqué ci-dessous.
Dans la dernière version des recommandations ACR de 2015, la distinction entre le traitement des tumeurs et le traitement des rhumatismes selon l’intervalle a toutefois été abandonnée. En cas d’état après une tumeur maligne solide, le traitement de base peut donc être administré sans restriction comme chez les patients atteints de PR sans antécédents de tumeur maligne. Sinon, pour le cancer de la peau et les maladies lymphoprolifératives, des priorités ont été établies pour les DMARD, qui sont si peu fondées sur des preuves ou qui vont à l’encontre des preuves non citées déjà disponibles à l’époque qu’elles ne seront pas reflétées ici. Nous verrons plus loin que ces deux groupes de maladies malignes méritent une attention particulière.
Preuve directe du risque de récidive tumorale sous traitement rhumatologique
Dans les registres nationaux de patients atteints de PR, les patients ayant des antécédents de tumeur maligne ont été comparés, dans le cadre d’études cas-témoins, à des patients ayant reçu des traitements de fond similaires et n’ayant pas d’antécédents de maladie maligne. La plupart du temps, ils ont tenté d’ajuster les facteurs de risque de récidive tumorale, tels que l’activité de la maladie ou l’obésité. Les premières données significatives provenaient du registre allemand RABBIT [15] et du registre britannique des produits biologiques [16]. En outre, il convient de mentionner les analyses du registre américain CORRONA [17], du registre danois DANBIO [18] et – récemment publié – du registre suédois ARTIS [19]. Récemment, une méta-analyse de Xie et ses collègues a été publiée sur 11 études, incluant les registres mentionnés ci-dessus [20]. Les données ne sont utilisables que pour les inhibiteurs du TNF et le rituximab. Heureusement, aucune augmentation du risque de récidive n’a été constatée pour les inhibiteurs du TNF ou le rituximab par rapport aux patients recevant des traitements de fond synthétiques conventionnels (csDMARDs). Il convient de noter que dans la plupart des études, l’intervalle entre le traitement oncologique et le traitement rhumatologique était en moyenne nettement supérieur à 5 ans – à deux exceptions près : Le rituximab a été utilisé plus tôt dans le registre allemand, conformément à l’ancienne recommandation de l’ACR, et le registre danois a permis de comparer les patients dont l’intervalle avant le traitement par inhibiteur du TNF était supérieur ou inférieur à 5 ans. Dans ce cas, le risque de récidive tumorale était même numériquement un peu plus faible avec un intervalle plus court, même après ajustement pour le stade initial de la tumeur. Toutefois, il s’est avéré que les médecins participant au registre avaient tendance à utiliser des médicaments biologiques à des stades initiaux moins avancés de la tumeur. Une méta-analyse de 16 études portant sur différentes maladies auto-immunes (PR, maladies inflammatoires chroniques de l’intestin et psoriasis) n’a pas non plus démontré de différence statistiquement significative dans l’incidence de la récidive tumorale à des intervalles de plus ou moins 6 ans. L’analyse a porté principalement sur les inhibiteurs du TNF, les thiopurines et le méthotrexate [21]. Cependant, étant donné que la plupart des données de registres présentent en moyenne de longs intervalles entre le traitement oncologique et le traitement rhumatologique et que les études de registres peuvent être soumises à un biais considérable, la longueur de l’intervalle devrait néanmoins continuer à être prise en compte dans la décision thérapeutique en rhumatologie.
L’étude la plus probante sur le risque de récidive tumorale à court terme est probablement l’analyse de données d’assurance américaines portant sur un très grand nombre de cas réalisée par Mamtani et ses collègues [22]. Il s’agissait de patientes atteintes de polyarthrite rhumatoïde (>90%) ou de maladies inflammatoires chroniques de l’intestin qui, après une opération curative d’un carcinome mammaire, recevaient du méthotrexate, de la thiopurine, des inhibiteurs du TNF, des combinaisons de ces médicaments ou ne recevaient aucun traitement de fond. Chez plus de 90% des patientes, les inhibiteurs du TNF ont été repris dans l’année qui a suivi l’opération et, même en cas d’administration continue des inhibiteurs du TNF, aucune augmentation du risque de récidive du cancer du sein n’a été constatée. Toutefois, le suivi n’a été que de 3,4 ans. Comme les récidives de cancer du sein peuvent survenir bien plus de 5 ans après l’opération, il était jusqu’à présent conseillé de faire preuve d’une prudence particulière et d’attendre avant d’initier un traitement de fond. Cette étude peut être citée dans une certaine mesure comme un contre-argument à cette évaluation. Le registre britannique n’a pas non plus montré d’augmentation de l’incidence de nouveaux cancers du sein sous TNFI par rapport aux csDMARD, et ce sur un nombre de cas relativement important [23].
Données sur les substances individuelles
Il serait trop long, dans le cadre de cet article de synthèse, de présenter en détail les données disponibles sur toutes les substances couramment utilisées en rhumatologie. C’est pourquoi les données disponibles sont résumées dans le tableau 1 et le risque de tumeur des différentes substances ou groupes de substances est évalué. Seule la littérature récente est citée. Pour une lecture approfondie, nous vous renvoyons à des synthèses pertinentes [24–27].

Il convient de noter d’emblée que seul le cyclophosphamide présente un signal clair d’augmentation du risque de tumeur ou de récidive tumorale, et ce uniquement à des doses cumulées élevées. Les traitements immunomodulateurs ou immunosuppresseurs habituellement utilisés en rhumatologie ne devraient avoir qu’une influence minime – voire favorable dans certaines situations – sur ces risques. Avec l’augmentation des preuves, l’image positive tend à se confirmer.
Dans le tableau 2, nous avons tenté d’évaluer, sur la base de la littérature pertinente, dans quelle mesure les différentes substances utilisées dans le traitement rhumatologique pouvaient avoir un impact sur le risque de survenue de nouvelles tumeurs malignes ou de récidives de tumeurs malignes. Bien que cela représente une simplification considérable du sujet complexe, cela doit servir d’orientation rapide et de point de départ pour une discussion et une recherche plus approfondies. Le jugement global sur une substance doit toujours porter à la fois sur la qualité des données et sur les indications de risque de malignité qui en découlent. Ainsi, en cas de doute sur des substances alternatives présentant probablement un faible risque, on opterait plutôt pour celle dont les données sont les plus solides.
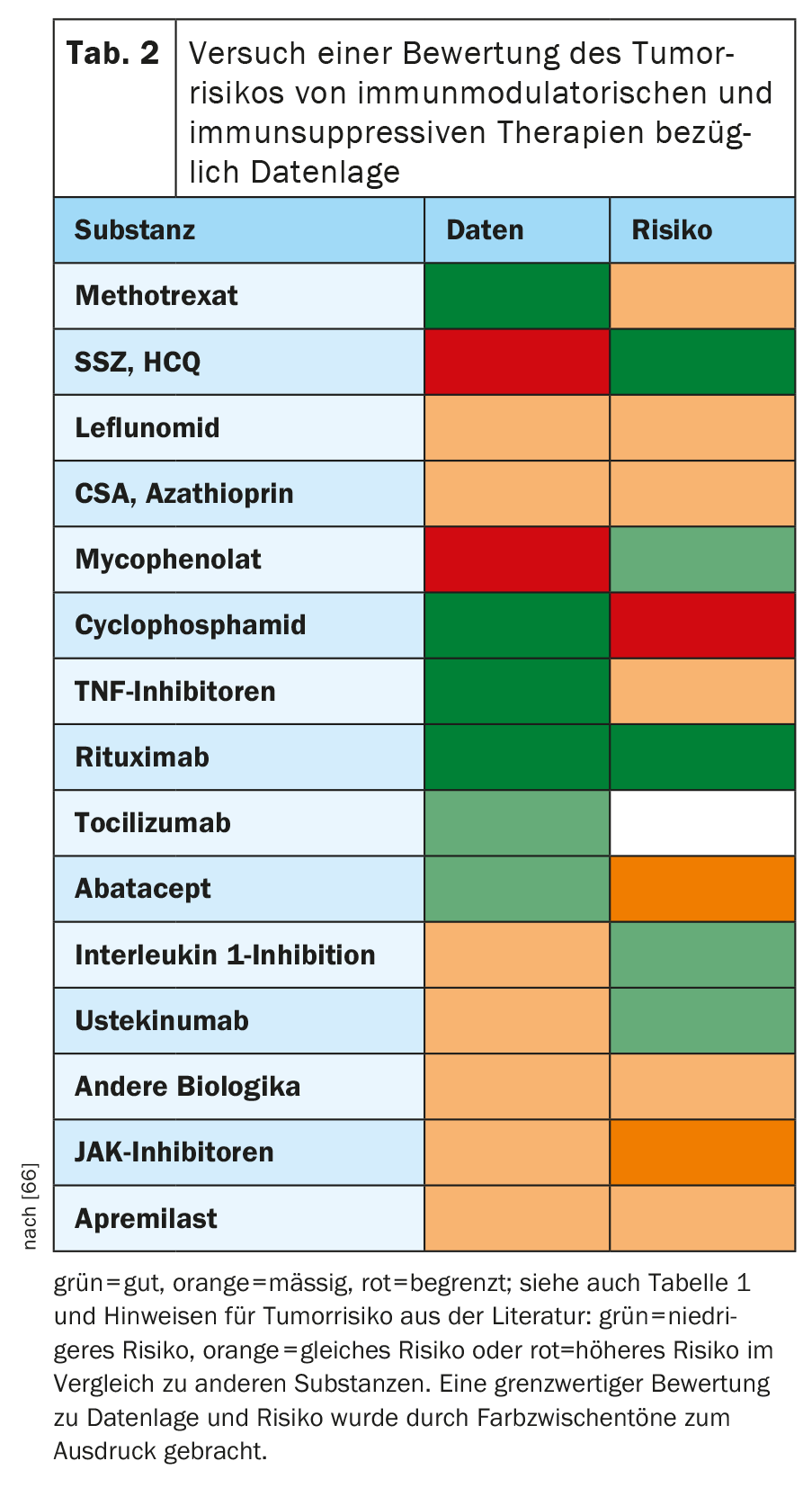
Méthotrexate : Données disponibles : bonnes.
Le méthotrexate est utilisé comme traitement d’entretien dans les leucémies lymphoïdes aiguës. Il faut partir du principe que le risque de cancer cutané non mélanocytaire est légèrement plus élevé en fonction de la dose cumulée, ce qui a été démontré une nouvelle fois dans la grande étude randomisée sur l’utilisation du méthotrexate chez les patients à risque cardiovasculaire [28,29]. La fréquence des maladies lymphoprolifératives, parfois spontanément rémittentes à l’arrêt du méthotrexate, décrite notamment par des auteurs japonais [30], n’est pas confirmée par la compilation d’autres données détaillées du registre [31].
Léflunomide, hydroxychloroquine, sulfasalazine : Données : modérées pour le léflunomide, mauvaises pour l’hydroxychloroquine et la sulfasalazine.
Le léflunomide a des effets inhibiteurs sur les tumeurs, du moins in vitro. L’accumulation numérique de cancers du pancréas dans le registre RABBIT sous léflunomide n’a pas été retrouvée dans d’autres registres [32].
Pour l’hydroxychloroquine, une étude dans le LED et avec un faible nombre de cas d’événements malins suggère un effet protecteur contre les maladies malignes [33]. Une étude récente sur les collagénoses suggère seulement un effet bénéfique sur l’incidence des tumeurs métastatiques [34]. Les thérapies oncologiques combinées à l’hydroxychloroquine sont discutées en raison de leur effet sur l’autophagocytose.
La sulfasalazine pourrait, comme la mésalazine, réduire le risque de cancer du côlon dans la colite ulcéreuse [35].
l’apremilast : Données disponibles : modérées.
Les rapports d’effets indésirables de la FDA suggèrent que l’aprémilast présente un risque de tumeur encore plus faible que l’ustékinumab [36]. Comme pour l’hydroxychloroquine et la sulfasalazine, un effet défavorable sur le développement de tumeurs semble peu probable, ne serait-ce qu’en raison du mécanisme d’action.
Azathioprine, ciclosporine A, mycophénolate : Données disponibles : modérées.
Il existe des indications selon lesquelles le traitement combiné d’azathioprine et d’infliximab chez les hommes atteints d’une maladie inflammatoire chronique de l’intestin pourrait entraîner une augmentation de l’incidence des lymphomes hépatospléniques à cellules T, très rares [37]. L’accumulation de néoplasies myéloïdes par l’azathioprine dans différentes maladies auto-immunes, postulée dans une étude récemment publiée, n’a pas été retrouvée dans d’autres études et est probablement due au fait que des populations très hétérogènes ont été comparées [38]. Tant pour l’azathioprine que pour la ciclosporine A, le risque de NMSC semble augmenté [39], pour l’ASC, surtout en relation avec la photothérapie pour le psoriasis [40]. Les données sur l’azathioprine provenant de différents registres sur l’incidence du cancer en général, du cancer urothélial et du lymphome sont contradictoires, même si aucun signal fort ne se dégage. Pour le MMF, il existe surtout des études dans le domaine de la transplantation d’organes. Ici, le risque de cancer dans son ensemble semble être légèrement inférieur pour les tumeurs cutanées et les maladies lymphoprolifératives post-transplantation par rapport à d’autres régimes immunosuppresseurs post-transplantation [41].
Cyclophosphamide : Données disponibles : bonnes.
En fonction de la dose cumulée de cyclophosphamide, le risque d’apparition de nouvelles tumeurs malignes ou de récidives tumorales est accru. La plupart des études indiquent des valeurs comprises entre 20 et 30 g comme limite à partir de laquelle ce risque est calculé comme significativement accru [42]. Une étude sur des patientes atteintes de LED en Corée du Sud a même déjà trouvé un risque accru de tumeurs malignes incidentes à une dose cumulée de >6 g [43]. Cependant, même cette valeur n’est pas atteinte par les protocoles modernes à base de cyclophosphamide tels que le protocole Euro-Lupus.
Médicaments biologiques
Inhibiteurs du TNF : Données disponibles : très bonnes.
On peut supposer un risque légèrement plus élevé de NMSC [44]. L’existence d’un risque accru de mélanome malin sous TNFI a longtemps fait l’objet de controverses sans que des signaux clairs ne se dégagent. Une analyse de 11 registres européens de la PR [45] et l’analyse la plus récente du registre australien de l’ARAD [46] pour les patients atteints de PR n’ont pas mis en évidence d’augmentation du risque. Plusieurs études n’ont pas montré d’augmentation significative du risque de progression des dyspalies intraépithéliales cervicales connues en cancer du col sous TNFI [47]. Une analyse récente des données d’assurance américaines suggère un risque accru de lymphome [48], qui n’a pas été trouvé dans les études de plusieurs registres nationaux [49]. Les données importantes et rassurantes concernant les études sur le risque de récidive tumorale sous TNFI ont été présentées plus haut. Dans ce contexte, les données provenant du domaine des thérapies immuno-oncologiques avec ce que l’on appelle les inhibiteurs de points de contrôle (ICPI) sont intéressantes : Des modèles de souris [50,51] et une première série de cas [52] suggèrent que l’association d’ICPI et de TNFI pourrait entraîner non seulement une réduction du taux d’effets secondaires à médiation immunitaire, mais aussi un meilleur contrôle de la tumeur.
Le rituximab : Données : très bonnes.
Bien que le rituximab soit utilisé depuis longtemps en Allemagne, conformément aux anciennes recommandations de l’ACR, relativement peu de temps après le traitement curatif d’une tumeur, la littérature sur les pathologies rhumatologiques (en particulier la PR) ne fait pas état d’un risque accru de récidive tumorale ou de nouvelles tumeurs malignes. Les données favorables du registre sur le risque de récidive tumorale ont été présentées ci-dessus.
Tocilizumab, sarilumab : Données : bonnes pour le tocilizumab, limitées pour le sarilumab.
Le tocilizumab est utilisé à des fins thérapeutiques dans différentes situations en oncologie : Traitement de la maladie de Castleman (autorisation de mise sur le marché au Japon), traitement de la tempête de cytokines après thérapie par cellules CAR-T (autorisation de mise sur le marché), traitement des effets secondaires à médiation immunitaire des inhibiteurs de checkpoints (séries de cas, avis d’experts) [53]. Les considérations sur le mécanisme d’action qui placent le tocilizumab sous un jour favorable dans le contexte des affections malignes ne doivent pas être surinterprétées. Une grande analyse des bases de données d’assurance américaines n’a pas trouvé au moins un risque plus élevé d’événements malins dans la PR sous tocilizumab par rapport au TNFI ou à l’abatacept, les NMSC étant exclus de l’analyse [54].
l’abatacept : Données disponibles : bonnes.
Là encore, les considérations sur le mécanisme d’action, exactement opposé à celui de l’ipilimumab, un inhibiteur de checkpoints, ne doivent pas être surestimées. Cependant, une grande étude de registre [55] et une analyse des données d’assurance américaines [56] plaident en faveur d’un risque accru pour le NMSC lui-même par rapport aux autres médicaments biologiques. Pour l’incidence totale du cancer et l’incidence du mélanome, les données sont contradictoires [57].
sécukinumab, ixekizumab : Données : modérées pour le sécukinumab, limitées pour l’ixekizumab.
Les voies de signalisation de l’IL17 peuvent théoriquement être à la fois pro-tumorales et inhibitrices de tumeurs. L’argumentation de la ligne directrice S3 allemande sur le traitement du psoriasis, qui privilégie le sécukinumab et l’ustékinumab par rapport au TNFI en cas d’antécédents malins, ne semble pas concluante en ce qui concerne le sécukinumab [58]. Les données sur la prétendue augmentation du risque de tumeur sous TNFI sont ici surinterprétées et comparées à des données sur le sécukinumab qui, bien qu’elles n’indiquent pas d’augmentation de l’incidence du cancer, ne se prêtent pas non plus à l’étude de cette question en raison du faible nombre de cas et de la courte durée du suivi.
Ustekinumab (médicament contre le cancer) : Données : bonnes.
Dans une évaluation du registre PSOLAR sur le traitement du psoriasis, l’ustékinumab et le méthotrexate ont montré un risque global de cancer plus faible par rapport au TNFi [59]. Cela appuierait la recommandation susmentionnée dans la ligne directrice allemande sur le psoriasis, mais devrait idéalement être confirmé dans d’autres études et situations thérapeutiques, d’autant plus que les données des rapports d’effets indésirables de la FDA, difficiles à interpréter, mentionnées précédemment, plaident en faveur d’un risque plus élevé par rapport à l’aprémilast.
Anakinra, canakinumab : Données : moyennes à bonnes.
L’anakinra est utilisé pour traiter le syndrome de Schnitzler. Dans cette maladie, il existe une association entre la vascularite urticarienne et la gammapathie monoclonale de signification indéterminée, qui est une maladie précancéreuse. Dans l’étude CANTOS, les patients présentant une CRP élevée après un infarctus du myocarde ont reçu soit le canakinumab, soit un placebo [60]. Bien que le critère d’évaluation principal ait été atteint, cette étude n’a pas permis d’obtenir l’autorisation de mise sur le marché dans cette indication, mais l’incidence des cancers bronchiques a été réduite dans le bras étudié. En effet, l’interleukine-1 peut avoir des effets pro-tumoraux. Cette observation fera l’objet d’un suivi dans le cadre d’un programme d’études oncologiques.
Le bélimumab : Données disponibles : modérées.
Il n’existe pas de données spécifiques sur le risque de maladies malignes.
Inhibiteurs de JAK : Données : bonnes pour le tofacitinib, modérées pour le baricitinib, limitées pour l’upadacitinib.
L’examen du risque tumoral des inhibiteurs JAK doit être particulièrement bien fondé, maintenant et à l’avenir, car il s’agit de médicaments immunosuppresseurs très puissants et certains signaux sont d’ores et déjà observés, mais ne fournissent pas encore d’image claire. Les patients atteints de néoplasie myéloproliférative (NMP) ont des populations de cellules B monoclonales plus fréquentes dans la moelle osseuse, ce qui les expose à un risque plus élevé de néoplasie des cellules B. Les patients atteints de NMP ont des populations de cellules B monoclonales plus fréquentes dans la moelle osseuse. Une équipe d’hémato-oncologie de Vienne a évalué une cohorte de patients atteints de MPN, dont une partie était traitée par différents inhibiteurs de JAK approuvés et expérimentaux [61]. Cette cohorte a montré une augmentation significative du risque de néoplasie agressive des cellules B sous inhibiteurs JAK. Cette observation a été étayée par un modèle de souris du groupe de travail, mais n’a pas été confirmée par une étude analogue sur une plus grande cohorte de MPN du MD Anderson [62]. Dans le programme d’études randomisées sur la PR de l’upadacitinib, on a constaté un risque significativement plus élevé de NMSC sous la dose non autorisée de 30 mg que sous celle de 15 mg [63]. De même, avec le baricitinib, il y a eu relativement plus de NMSCs numériquement avec la dose plus élevée de 4 mg dans la PR qu’avec 2 mg [64]. Seul le tofacitinib dispose déjà de données de registre significatives. Dans le registre américain CORRONA, les taux de NMSC et de cancer sans NMSC sous tofacitinib étaient comparables à ceux des agents biologiques et ne différaient pas significativement [65]. Toutefois, il convient de souligner à nouveau la possibilité de biais dans les registres. De plus, cette étude n’a pas encore été entièrement publiée.
Stratégies thérapeutiques en fonction de la situation
Dans ce contexte, nous allons tenter de formuler des propositions pour le traitement rhumatologique des patients présentant des antécédents de malignité. Ces propositions sont une synthèse des recommandations déjà existantes dans les lignes directrices et des preuves décrites et examinées. Ils n’ont pas fait l’objet d’un processus de consensus et ne reflètent que l’opinion individuelle de l’auteur :
- Dans ce contexte, les décisions thérapeutiques sont très chargées émotionnellement et doivent être discutées en détail avec le patient et son collègue oncologue.
- Dans une situation de traitement palliatif, il convient de distinguer si le pronostic et les options de traitement oncologique sont très limités ou s’il existe une possibilité de contrôle de la maladie à long terme grâce à des concepts de traitement oncologique (moderne). En particulier, l’évaluation des traitements DMARD après des thérapies immuno-oncologiques est difficile, mais peut être étayée par l’expérience oncologique en matière de traitement immunosuppresseur des effets secondaires à médiation immunitaire de ces traitements. Si l’objectif thérapeutique principal est de soulager les symptômes, le traitement rhumatologique peut généralement être suivi sans restriction. Si l’objectif est de contrôler la tumeur à long terme, il convient d’adopter une attitude similaire à celle des approches thérapeutiques curatives.
- Si l’objectif thérapeutique est curatif, il est probablement possible de suivre un traitement rhumatologique sans restriction 5 ans après la fin du traitement oncologique. Les traitements oncologiques d’entretien sur plusieurs années ne devraient pas retarder davantage cet intervalle. Même au-delà d’un intervalle de 5 ans, il est préférable d’éviter l’abatacept, les inhibiteurs JAK et peut-être aussi les inhibiteurs du TNF en cas de mélanome malin, en raison du manque de données claires, surtout s’il existe des options thérapeutiques alternatives.
- Dans les lymphomes traités à titre curatif, il convient d’être plutôt réticent à l’égard des inhibiteurs JAK et peut-être aussi des inhibiteurs du TNF. En revanche, le rituximab et peut-être le tocilizumab ont un effet bénéfique en cas de néoplasie à cellules B ou de dyscrasie plasmocytaire préexistantes.
- Si l’objectif du traitement est curatif, il est recommandé de procéder à un examen de contrôle dans l’intervalle de 5 ans :
- Interruption du traitement de base et relais par des glucocorticostéroïdes (ou des anti-inflammatoires non stéroïdiens) pendant la chimiothérapie
- Prise en compte des interactions dans les traitements oncologiques d’entretien à long terme
- Sinon, un traitement de base conséquent dans le sens d’un concept échelonné, qui s’oriente sur le risque individuel de récidive tumorale et sur les données relatives aux DMARD entrant en ligne de compte. Les données disponibles doivent être évaluées en fonction du nombre et de la qualité des études et de l’existence de preuves d’un risque tumoral plus ou moins élevé par rapport à d’autres substances.
- Il faut cependant absolument éviter une inflammation incontrôlée à long terme ou un traitement par glucocorticoïdes à haute dose à long terme en raison d’une rétention excessive avant le traitement de base.
- En raison de la grande complexité des interactions entre le système immunitaire et la tumeur dans le cadre des thérapies immuno-oncologiques (inhibiteurs de checkpoints), il est recommandé de confier les décisions thérapeutiques en rhumatologie à un centre spécialisé.
Messages Take-Home
- La décision de recourir à des traitements immunomodulateurs ou immunosuppresseurs chez les patients ayant des antécédents de malignité doit généralement être prise de manière interdisciplinaire et toujours en étroite concertation avec le patient.
- Une quantité croissante de données aide à évaluer les substances DMARD individuelles. Les données sont complexes à évaluer en raison des différentes limites des formats d’études, mais elles donnent une image plutôt positive, à de très rares exceptions près.
- Peu de substances (inhibiteurs du TNF, rituximab) ont fait l’objet d’études portant principalement sur le risque de récidive tumorale après une maladie maligne. Pour d’autres substances, on peut être informé par des données sur le risque de tumeurs incidentes et, de manière limitée, par l’observation de modèles précliniques.
- Seul le cyclophophosphamide à dose cumulée élevée présente un signal fort d’augmentation du risque de tumeur. Si des alternatives existent, il est probablement préférable d’éviter l’abatacept, les inhibiteurs JAK et peut-être, dans certaines situations, les inhibiteurs du TNF. Pour les inhibiteurs du TNF, les données sont particulièrement probantes dans certaines situations (par exemple, état après un cancer du sein) où elles semblent plutôt favorables.
- Plusieurs substances augmentent le risque de cancer de la peau non mélanocytaire. Ce risque peut être géré de manière efficace par un dépistage systématique des tumeurs cutanées.
Littérature :
- Baecklund E, Iliadou A, Askling J, et al : Association of chronic inflammation, not its treatment, with increased lymphoma risk in rheumatoid arthritis. Arthritis Rheum 2006 ; 54(3) : 692-701.
- Zhang Y, Sun Y, Zhang Q : Valeur pronostique de l’indice d’inflammation immunitaire systémique chez les patients atteints de cancer du sein : une méta-analyse. Cancer Cell Int 2020 ; 20 : 224.
- Hirano T, Hirayama D, Wagatsuma K, et al : Mécanismes immunologiques dans la carcinogenèse du côlon associée à l’inflammation. Int J Mol Sci 2020 ; 21(9) : 3062.
- Moik F, Zöchbauer-Müller S, Posch F, et al : Systemic Inflammation and Activation of Haemostasis Predict Poor Prognosis and Response to Chemotherapy in Patients with Advanced Lung Cancer. Cancers (Bâle) 2020 ; 12(6) : E1619.
- Kampan NC, Madondo MT, McNally OM, et al : L’interleukine 6 présente dans les ascites inflammatoires de patients atteints de cancer épithélial avancé de l’ovaire favorise les cellules T régulatrices exprimant le récepteur du facteur de nécrose tumorale 2. Front Immunol 2017 ; 8 : 1482.
- Krathen MS, Gottlieb AB, Mease PJ : Pharmacologic immunomodulation and cutaneous malignancy in rheumatoid arthritis, psoriasis, and psoriatic arthritis. J Rheumatol 2010 ; 37(11) : 2205-2215.
- Mercer LK, Davies R, Galloway JB, et al : Risk of cancer in patients receiving non-biologic disease-modifying therapy for rheumatoid arthritis compared with the UK general population. Rheumatology 2013 ; 52 : 9198.
- Nocturne G, Mariette X : Lymphomes associés au syndrome de Sjögren : une mise à jour sur la pathogenèse et la prise en charge. Br J Haematol 2015 ; 168(3) : 317-327.
- Feldman CH, Liu J, Feldman S, et al : Risk of high-grade cervical dysplasia and cervical cancer in women with systemic lupus erythematosus receiving immunosuppressive drugs. Lupus 2017 Jun ; 26(7) : 682-689.
- Lopez-Olivo MA, Colmegna I, Karpes Matusevich AR, et al : Systematic Review of Recommendations on the Use of Disease-Modifying Antirheumatic Drugs in Patients With Rheumatoid Arthritis and Cancer. Arthritis Care Res (Hoboken) 2020 ; 72(3) : 309-318.
- Singh JA, Furst DE, Bharat A, et al : 2012 update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken) 2012 ; 64(5) : 625-639.
- Singh JA, Saag KG, Bridges SL Jr, et al : 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken) 2016 Jan ; 68(1) : 1-25.
- Penn I : Évaluation des candidats à la transplantation avec des malignités préexistantes. Ann Transplant 1997 ; 2(4) : 14-17.
- Tarella C, Passera R, Magni M, et al : Facteurs de risque pour le développement d’une tumeur maligne secondaire après une chimiothérapie à haute dose et une autogreffe, avec ou sans rituximab : une étude de suivi rétrospective de 20 ans chez des patients atteints de lymphome. J Clin Oncol 2011 Mar 1 ; 29(7) : 814-824.
- Strangfeld A, Hierse F, Rau R, et al : Risk of incident or recurrent malignancies among patients with rheumatoid arthritis exposed to biologic therapy in the German biologics register RABBIT. Arthritis Res Ther 2010 ; 12 : R5.
- Dixon WG, Watson KD, Lunt M, et al : Influence of antitumor necrosis factor therapy on cancer incidence in patients with rheumatoid arthritis who have had prior malignancy : results from the British Society for Rheumatology Biologics Register. Arthritis Care Res 2010 ; 62 : 755-763.
- Pappas DA, Rebello S, Liu M, et al. : Traitement par des agents biologiques après le diagnostic de tumeurs malignes solides : résultats du registre Corrona. J Rheumatol 2019 ; 46(11) : 1438-1444.
- Dreyer L, Cordtz RL, Hansen IMJ, et al : Risk of second malignant neoplasm and mortality in patients with rheumatoid arthritis treated with biological DMARDs : a Danish population-based cohort study. Ann Rheum Dis 2018 ; 77(4) : 510-514.
- Raaschou P, Söderling J, Turesson C, et al : Tumor necrosis factor inhibitors and cancer recurrence in Swedish patients with rheumatoid arthritis : a nationwide population-based cohort study. Ann Intern Med 2018 ; 169 : 291-299.
- Xie W, Xiao S, Huang Y, et al : A meta-analysis of biologic therapies on risk of new or recurrent cancer in patients with rheumatoid arthritis and a prior malignancy. Rheumatology (Oxford) 2019 Oct 17 ; [Epub ahead of print].
- Shelton E, Laharie D, Scott FI, et al : Cancer Recurrence Following Immune-Suppressive Therapies in Patients With Immune-Mediated Diseases : A Systematic Review and Meta-analysis. Gastroenterology 2016 ; 151(1) : 97-109.e4.
- Mamtani R, Clark AS, Scott FI, et al : Association entre la récidive du cancer du sein et l’immunosuppression dans l’arthrite rhumatoïde et la maladie inflammatoire du côlon : une étude de cohorte. Arthritis Rheumatol 2016 ; 68 : 2403-2411.
- Mercer LK, Lunt M, Low AL, et al : Risk of solid cancer in patients exposed to anti-tumour necrosis factor therapy : results from the British Society for Rheumatology Biologics Register for Rheumatoid Arthritis. Ann Rheum Dis 2015 ; 74(6) : 1087-1093.
- Schmalzing M, Strangfeld A, Tony HP : Traitement médicamenteux de la polyarthrite rhumatoïde en cas d’antécédents de malignité. Données épidémiologiques [Medication treatment of rheumatoid arthritis with a history of malignancy. Données épidémiologiques]. Z Rheumatol 2016 ; 75(1) : 22-31.
- Regierer AC, Strangfeld A : Traitement de l’arthrite rhumatoïde chez les patients ayant des antécédents de cancer. Curr Opin Rheumatol 2018 ; 30(3) : 288-294.
- Shelton E, Laharie D, Scott FI, et al : Cancer Recurrence Following Immune-Suppressive Therapies in Patients With Immune-Mediated Diseases : A Systematic Review and Meta-analysis. Gastroenterology 2016 ; 151(1) : 97-109.e4.
- De Cock D, Hyrich K : Malignancy and rheumatoid arthritis : Epidemiology, risk factors and management. Best Pract Res Clin Rheumatol 2018 ; 32(6) : 869-886.
- Lange E, Blizzard L, Venn A, et al : Disease-modifying anti-rheumatic drugs and non-melanoma skin cancer in inflammatory arthritis patients : a retrospective cohort study. Rheumatology (Oxford) 2016 ; 55(9) : 1594-1600.
- Solomon DH, Glynn RJ, Karlson EW, et al : Adverse Effects of Low-Dose Methotrexate : A Randomized Trial. Ann Intern Med 2020 Feb 18 ; [Epub ahead of print].
- Rizzi R, Curci P, Delia M, et al : Rémission spontanée des “troubles lymphoprolifératifs associés au méthotrexate” après l’arrêt du traitement immunosuppresseur pour une maladie auto-immune. Revue de la littérature. Med Oncol 2009 ; 26(1) : 1-9.
- Hellgren K, Baecklund E, Backlin C, et al. : Polyarthrite rhumatoïde et risque de lymphome malin : le risque est-il encore accru ? Arthritis Rheumatol 2017 ; 69(4) : 700-708.
- Behrens F, Koehm M, Burkhardt H : Update 2011 : leflunomide in rheumatoid arthritis – strengths and weaknesses. Curr Opin Rheumatol 2011 ; 23(3) : 282-287.
- Ruiz-Irastorza G, Ugarte A, Egurbide MV,et al : Les antipaludéens peuvent influencer le risque de malignité dans le lupus érythémateux disséminé. Ann Rheum Dis 2007 ; 66(6) : 815-817.
- Fardet L, Nazareth I, Petersen I : Effets de l’exposition chronique à l’hydroxychloroquine/chloroquine sur le risque de cancer, de métastases et de décès : une étude de cohorte basée sur la population de patients atteints de maladies des tissus connectifs. Clin Epidemiol 2017 ; 9 : 545-554.
- Lopez A, Pouillon L, Beaugerie L, et al : Prévention du cancer colorectal chez les patients atteints de colite ulcéreuse. Best Pract Res Clin Gastroenterol 2018 ; 32-33 : 103-109.
- Moore TJ : Safety perspectives : cancer risks of biological products for psoriasis, www.ismp.org/quarterwatch/safety-perspectives (accessed : March 29, 2018).
- Thai A, Prindiville T : Lymphome hépatosplénique à cellules T et maladie inflammatoire de l’intestin. J Crohns Colitis 2010 ; 4 : 511-522.
- Ertz-Archambault N, Kosiorek H, Taylor GE, et al : Association of Therapy for Autoimmune Disease With Myelodysplastic Syndromes and Acute Myeloid Leukemia. JAMA Oncol 2017 ; 3(7) : 936-943.
- Scott FI, Mamtani R, Brensinger CM, et al : Risk of Nonmelanoma Skin Cancer Associated With the Use of Immunosuppressant and Biologic Agents in Patients With a History of Autoimmune Disease and Nonmelanoma Skin Cancer. JAMA Dermatol 2016 ; 152(2) : 164-172.
- Muellenhoff MW, Koo JY : Cyclosporine et cancer de la peau : une perspective dermatologique internationale sur 25 ans d’expérience. A comprehensive review and pursuit to define safe use of cyclosporine in dermatology. J Dermatolog Treat 2012 ; 23(4) : 290-304.
- Vos M, Plasmeijer EI, van Bemmel BC, et al : Azathioprine to mycophenolate mofetil transition and risk of squamous cell carcinoma after lung transplantation. J Heart Lung Transplant 2018 ; 37(7) : 853-859.
- Hellbacher E, Hjorton K, Backlin C, et al : Lymphome malin dans la granulomatose avec polyangéite : sous-types, caractéristiques cliniques et pronostic. Acta Oncol 2019 ; 58(11) : 1655-1659.
- Kang KY, Kim HO, Yoon HS, et al : Incidence du cancer chez les patients féminins atteints de lupus érythémateux disséminé en Corée. Clin Rheumatol 2010 ; 29(4) : 381-388.
- Raaschou P, Simard JF, Asker Hagelberg C, et al : Arthrite rhumatoïde, traitement anti-tumoral par le facteur nécrosant, et risque de cancer de la peau à cellules squameuses et à cellules basales : étude de cohorte basée sur des données nationales prospectives recueillies en Suède. BMJ 2016 ; 352 : i262.
- Mercer LK, Askling J, Raaschou P, et al : Risk of invasive melanoma in patients with rheumatoid arthritis treated with biologics : results from a collaborative project of 11 European biologic registers. Ann Rheum Dis 2017 ; 76(2) : 386-391.
- Staples MP, March L, Hill C, Lassere M, Buchbinder R : Malignancy risk in Australian rheumatoid arthritis patients treated with anti-tumour necrosis factor therapy : an update from the Australian Rheumatology Association Database (ARAD)prospective cohort study. BMC Rheumatol 2019 ; 3 : 1.
- Cordtz R, Mellemkjær L, Glintborg B, et al : Progression maligne de lésions précancéreuses du col de l’utérus suite à un traitement biologique DMARD chez des patients atteints d’arthrite. Ann Rheum Dis 2015 ; 74(7) : 1479-1480.
- Calip GS, Patel PR, Adimadhyam S, et al : Inhibiteurs du facteur de nécrose tumorale alpha et risque de lymphome non hodgkinien dans une cohorte d’adultes atteints de maladies rhumatologiques. Int J Cancer 2018 ; 143(5) : 1062-1071.
- Mercer LK, Galloway JB, Lunt M, et al : Risk of lymphoma in patients exposed to antitumour necrosis factor therapy : results from the British Society for Rheumatology Biologics Register for Rheumatoid Arthritis. Ann Rheum Dis 2017 ; 76(3) : 497-503.
- Perez-Ruiz E, Minute L, Otano I, et al : Prophylactic TNF blockade uncouples efficacy and toxicity in dual CTLA-4 and PD-1 immunotherapy. Nature 2019 ; 569(7756) : 428-432.
- Bertrand F, Montfort A, Marcheteau E, et al : TNFα blockade overcomes resistance to anti-PD-1 in experimental melanoma. Nat Commun 2017 ; 8(1) : 2256.
- Badran YR, Cohen JV, Brastianos PK,et al : Traitement concomitant par inhibiteurs de points de contrôle immunitaires et blocage du TNFα chez les patients présentant des événements indésirables liés à l’immunité gastro-intestinale. J Immunother Cancer 2019 ; 7(1) : 226.
- Kim ST, Tayar J, Trinh VA, et al : Successful treatment of arthritis induced by checkpoint inhibitors with tocilizumab : a case series. Ann Rheum Dis 2017 ; 76(12) : 2061-2064.
- Kim SC, Pawar A, Desai RJ, et al : Risk of malignity associated with use of tocilizumab versus other biologics in patients with rheumatoid arthritis : A multi-database cohort study. Semin Arthritis Rheum 2019 ; 49(2) : 222-228.
- Wadström H, Frisell T, Askling J ; Anti-Rheumatic Therapy in Sweden (ARTIS)Study Group : Malignant Neoplasms in Patients With Rheumatoid Arthritis Treated With Tumor Necrosis Factor Inhibitors, Tocilizumab, Abatacept, or Rituximab in Clinical Practice : A Nationwide Cohort Study From Sweden. JAMA Intern Med 2017 ; 177(11) : 1605-1612.
- Montastruc F, Renoux C, Dell’Aniello S, et al : Abatacept initiation in rheumatoid arthritis and the risk of cancer : a population-based comparative cohort study. Rheumatology (Oxford) 2019 ; 58(4) : 683-691.
- de Germay S, Bagheri H, Despas F, et al : Abatacept in rheumatoid arthritis and the risk of cancer : a world observational post-marketing study. Rheumatology (Oxford) 2019 Dec 27 ; [Epub ahead of print].
- Nast A, Amelunxen L, Augustin M, et al. : S3-Leitlinie zur Therapie der Psoriasis vulgaris Update 2017. Registre AWMF n° 013/001.
- Fiorentino D, Ho V, Lebwohl MG, et al : Risk of malignancy with systemic psoriasis treatment in the Psoriasis Longitudinal Assessment Registry. J. Am Acad Dermatol 2017 ; 77(5) : 845-854.e5.
- Ridker PM, MacFadyen JG, Thuren T, et al : Effect of interleukin-1β inhibition with canakinumab on incident lung cancer in patients with atherosclerosis : exploratory results from a randomised, double-blind, placebo-controlled trial. Lancet 2017 ; 390(10105) : 1833-1842.
- Porpaczy E, Tripolt S, Hoelbl-Kovacic A, et al : Lymphomes agressifs à cellules B chez les patients atteints de myélofibrose recevant un traitement par inhibiteur JAK1/2. Blood 2018 ; 132(7) : 694-706.
- Pemmaraju N, Kantarjian H, Nastoupil L, et al. : Caractéristiques des patients atteints de néoplasmes myéloprolifératifs avec lymphome, avec ou sans traitement par inhibiteur JAK. Blood 2019 ; 133(21) : 2348-2351.
- Résumé de sécurité intégré, données Abbvie sur fichier.
- Smolen JS, Genovese MC, Takeuchi T, et al : Safety Profile of Baricitinib in Patients with Active Rheumatoid Arthritis with over 2 Years Median Time in Treatment. J Rheumatol 2019 ; 46(1) : 7-18.
- Kremer J, Bingham C, Cappelli L, et al : Comparaison des taux de malignité et de mortalité entre le tofacitinib et les DMARD biologiques en pratique clinique : Résultats à cinq ans d’un registre américain de la polyarthrite rhumatoïde [abstract]. Arthritis Rheumatol 2019 ; 71 (suppl 10).
- Schmalzing M. : Thérapie médicamenteuse rhumatologique en cas d’antécédents de malignité. Aktuelle Rheumatologie 2020 ; Georg Thieme Verlag KG Stuttgart ; doi : 10.1055/a-1247-4252.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(1) : 10-15