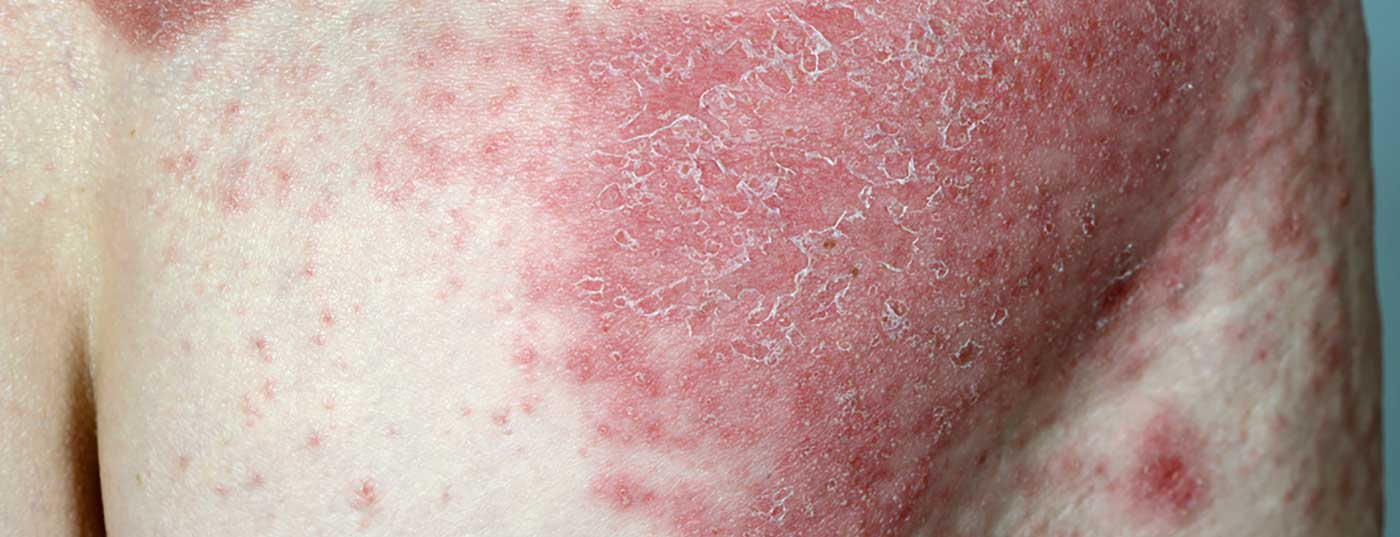
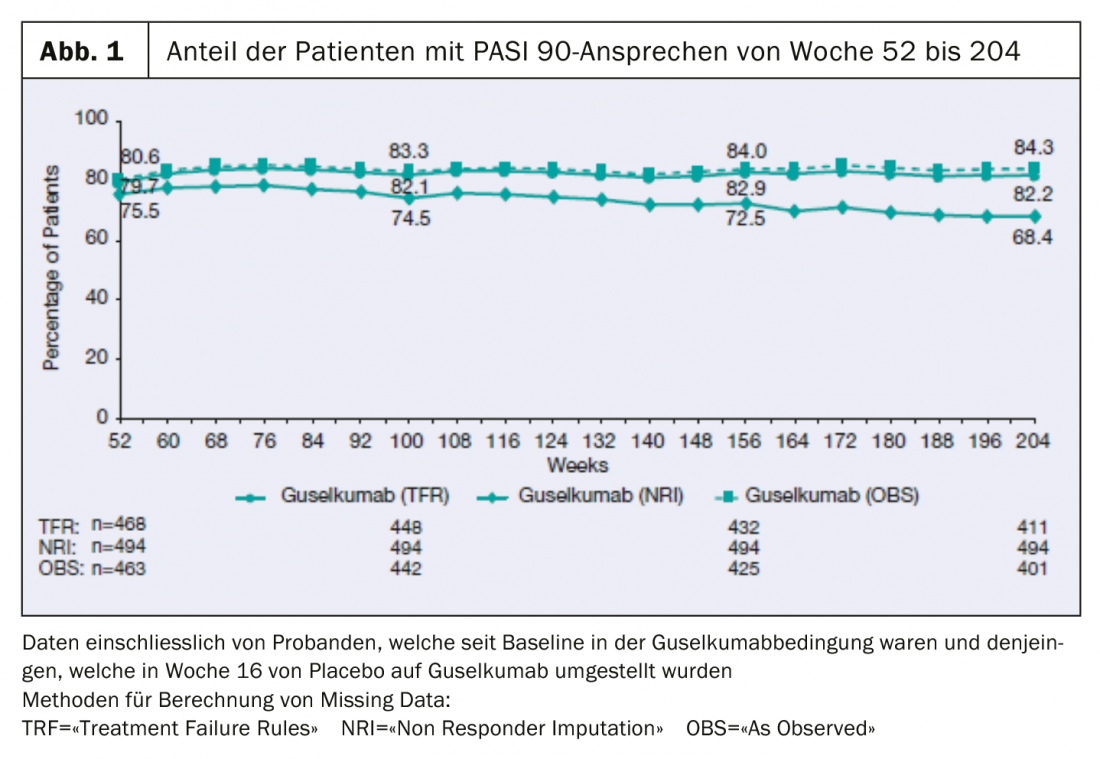
Les données à long terme de l’étude clinique de phase III VOYAGE 1, présentées récemment, montrent que 84% des patients continuent d’atteindre le PASI-90 après 204 semaines.
L’anticorps monoclonal guselkumab (TREMFYA®) est autorisé en Suisse depuis 2018 chez les adultes atteints de psoriasis en plaques modéré à sévère et éligibles à un traitement systémique [1]. Dans l’étude pivot VOYAGE 1 (n=837), le guselkumab s’est avéré significativement supérieur à l’adalimumab et au placebo pour tous les critères d’évaluation primaires (réponse PASI-90) et les principaux critères secondaires (IGA 0/1, réponse PASI-75).
Efficacité et tolérance durablement élevées
Les données à 4 ans de l’étude VOYAGE 1, multicentrique, randomisée et en double aveugle, ont été présentées lors de la 39e Fall Clinical Dermatology Conference à Las Vegas (États-Unis) [2] : La proportion de patients avec un PASI 90 est restée stable jusqu’à la semaine 204 : 8 patients sur 10 ont présenté une réponse PASI 90 sous guselkumab au cours de cette période. (Fig. 1). 82% des patients ayant reçu TREMFYA® (guselkumab) dans le groupe combiné de patients initialement randomisés dans les conditions guselkumab ou placebo avec un passage au guselkumab à la semaine 16 ont obtenu au moins une amélioration de 90% de l’indice de sévérité du psoriasis (PASI 90) à la semaine 204. De plus, un score IGA de 0 (sans lésion) ou 1 (presque sans lésion) était mesurable à ce moment de la mesure.
Le guselkumab (TREMFYA®) est le premier anticorps monoclonal entièrement humain approuvé qui se lie sélectivement à la sous-unité p19 de l’interleukine-23 (IL-23) et inhibe son interaction avec le récepteur IL-23 [1]. Cette substance bloque ainsi la sécrétion de ces cytokines inflammatoires qui sont impliquées dans la formation des plaques de psoriasis. TREMFYA® a été généralement bien toléré par les patients atteints de psoriasis au cours du développement clinique [3–5]. Aucun nouveau signal de sécurité n’a non plus été identifié sur la période de 4 ans de la phase de label ouvert [2].
Étude de suivi VOYAGE 1 phase III
Les sujets ont été randomisés à la ligne de base pour recevoir un placebo, le guselkumab ou l’adalimumab. La phase de traitement contrôlée par placebo a duré de la semaine 0 à la semaine 16. Ensuite, les patients de la condition placebo ont été transférés au guselkumab jusqu’à la semaine 48, et une comparaison a été effectuée avec la substance active adalimumab (semaines 0 à 48). Les participants à l’étude ont été randomisés pour recevoir le guselkumab à la semaine 0 et ceux qui sont passés du placebo au guselkumab à la semaine 16 ont reçu le guselkumab à la semaine 48, avec un intervalle de 8 semaines. À partir de la semaine 52, tous les participants ont reçu du guselkumab. L’efficacité a été évaluée sur la base de l’indice d’étendue et de sévérité du psoriasis (PASI75/90/100) et des scores IGA (0 = sans lésion, 1 = presque sans lésion). Le calcul des données manquantes a été effectué en utilisant les méthodes suivantes : NRI (“Non-Responder Imputation Rules”), TFR (“Treatment Failure”) et OBS (“As Observed”).
Source : Janssen-Cilag AG
Littérature :
- Information professionnelle Tremfya®, 02/2019, www.swissmedicinfo.ch, dernière consultation 24.10.2019
- Griffiths CE, et al. : Maintien de la réponse avec jusqu’à 4 ans de traitement continu au guselkumab : résultats de l’essai VOYAGE 1 phase 3. Falls Clinical Dermatology Conference. Oct, 2019 ; Las Vegas, USA.
- Blauvelt A, et al : Efficacité et sécurité du guselkumab, un anticorps monoclonal anti-interleukine 23, comparé à l’adalimumab pour le traitement continu des patients atteints de psoriasis modéré à sévère : Résultats de la phase III, en double aveugle, contrôlée par placebo et comparateur actif VOYAGE 1 trial. J Am Acad Dermatol 2017 ; 76(3) : 405-417.
- Reich K, et al. : Efficacité et sécurité du guselkumab, un anticorps monoclonal anti-interleukine-23, comparé à l’adalimumab pour le traitement des patients atteints de psoriasis modéré à sévère avec retrait et retraite randomisés : résultats de la phase III, en double aveugle, contrôlée par placebo et comparateur actif, de l’essai VOYAGE 2. J Am Acad Dermatol 2017 ; 76(3) : 418-431.
- Langley R, et al : Efficacité et sécurité du guselkumab chez les patients atteints de psoriasis qui ont une réponse inadéquate à l’ustekinumab : résultats de l’essai randomisé, en double aveugle, phase III NAVIGATE. Br J Dermatol 2018 ; 178(1) : 114-123.
DERMATOLOGIE PRAXIS 2019 ; 29(6) : 31 (publié le 8.12.19, ahead of print)