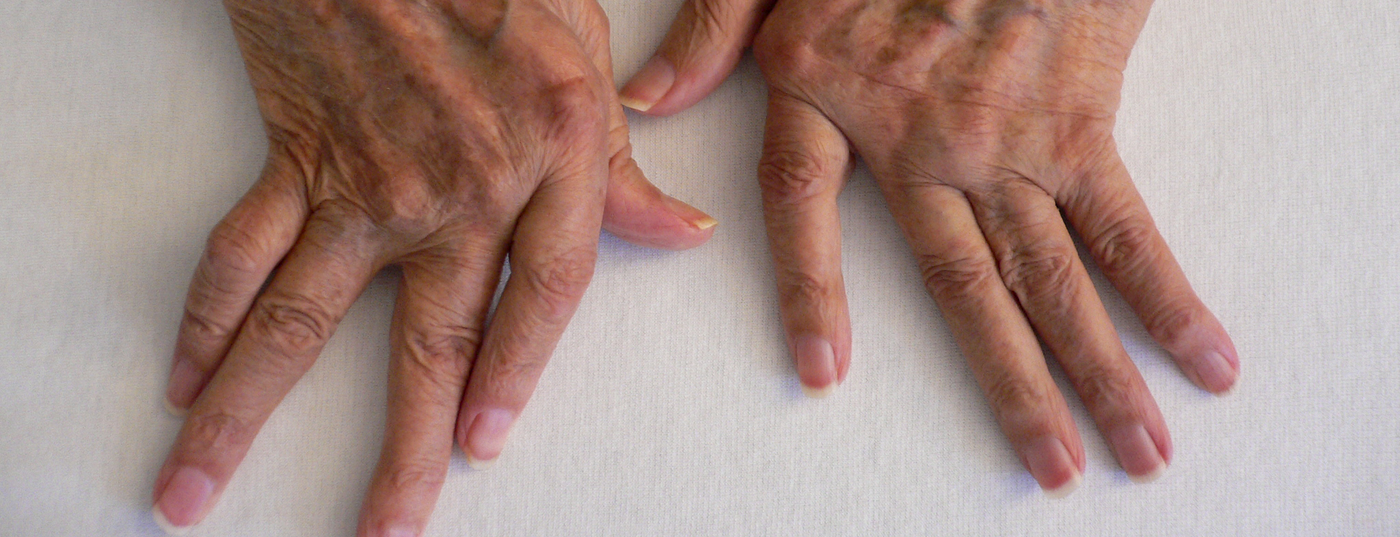
Dans la polyarthrite rhumatoïde, le système immunitaire attaque la membrane synoviale de la synoviale. Si elle n’est pas traitée, l’articulation risque de se dégrader progressivement. Les DMARD sont donc utilisés dans les cas graves. Les analyses omiques des différents types de cellules fournissent un nouvel aperçu de la maladie. L’accent est mis, entre autres, sur l’étude de l’activité des cellules T et des différents types de macrophages tissulaires comme base pour de nouvelles stratégies de traitement. Les connaissances actuelles et les résultats des études ont été présentés à l’occasion du congrès annuel de la Société allemande de rhumatologie (DGRh), qui s’est tenu à l’adresse suivante : .
Pour une compréhension différenciée de la maladie et des possibilités de traitement qui en découlent, l’étude des événements moléculaires complexes qui se déroulent au niveau cellulaire est très instructive. Les progrès réalisés dans les technologies à haut débit (“omics”) ont permis de réaliser des observations au niveau génomique, transcriptomique et de la régulation de différentes molécules biologiques (encadré). Le développement d’approches thérapeutiques contre la polyarthrite rhumatoïde a largement bénéficié des découvertes de la recherche fondamentale au cours des dernières décennies. “Les rhumatologues peuvent désormais bien influencer l’évolution de la maladie en injectant ou en perfusant différents anticorps biologiques, de l’abatacept au rituximab”, explique le porte-parole du groupe de travail Kompetenznetz Rheuma, le professeur Ulf Wagner de l’hôpital universitaire de Leipzig [1]. Plus récemment, des médicaments synthétiques tels que le baricitinib ou le tofacitinib, qui peuvent être pris sous forme de comprimés, ont été ajoutés. “Ces nouveaux moyens rendent le traitement plus supportable pour de nombreux patients”, ajoute-t-il.

Développer le principe thérapeutique de la modulation de l’activité des cellules T
L’activation des lymphocytes T autoréactifs est d’une importance pathogénique capitale dans les maladies auto-immunes telles que la polyarthrite rhumatoïde. Elles sont impliquées dans la cascade inflammatoire en influençant d’autres cellules immunitaires et en produisant une série de cytokines pro-inflammatoires. Sur la base de ces résultats, différents concepts ont été développés pour bloquer les cellules T à des fins thérapeutiques. Celles-ci visent soit à éliminer en grande partie les cellules T de l’évolution de la maladie, soit à influencer leur fonction de manière à freiner leurs effets pathogènes. L’abatacept (Orencia®) est un modulateur de l’activité des cellules T utilisé depuis longtemps en thérapeutique. Le mécanisme d’action consiste à bloquer spécifiquement la voie de signalisation CD28-CD80/CD86 [2,3]. CD28 est l’une des molécules costimulatrices les plus en vue, exprimée par environ la moitié des lymphocytes T. Elle est utilisée dans le traitement de la maladie d’Alzheimer. CD28 a deux ligands, CD80 et CD86, qui sont exprimés à la surface de différentes cellules présentatrices d’antigènes en fonction de leur activation. En outre, l’antigène cytotoxique T-lymphocyte-associated antigen 4 (CTLA-4) est exprimé sur les cellules T de manière dépendante de l’activation et se lie également à CD80 et CD86. Cependant, contrairement à CD28, CTLA-4 freine l’activation des cellules T en inhibant la prolifération et la production de cytokines et peut donc être considéré comme un antagoniste de CD28.
La modulation des cellules T nocives est également au centre d’une nouvelle stratégie de traitement actuellement à l’étude. “Nous pensons actuellement qu’au début de la maladie, il y a une perte de la tolérance au soi qui empêche normalement les cellules T d’attaquer les propres cellules de l’organisme dans la membrane synoviale”, explique le professeur Ulf Wagner [1]. “Les cellules T commencent à attaquer les cellules synoviales et elles incitent les cellules B à produire des anticorps, dont le facteur rhumatoïde est l’exemple le plus connu”. Selon l’expert, les études Omics montrent que le métabolisme des cellules T se modifie complètement au cours de la maladie. Par exemple, l’approvisionnement en énergie passerait de la glycolyse à la voie des pentoses phosphates. “Ces processus métaboliques modifiés fournissent potentiellement de toutes nouvelles possibilités d’influence thérapeutique sur les maladies auto-immunes inflammatoires chroniques”, explique le professeur Wagner. “Notre objectif devrait être de transformer les ‘mauvaises’ cellules T en ‘bonnes’ cellules T et de stopper le processus de la maladie dès le début”. L’avenir nous dira si cette approche thérapeutique s’impose et conduit à la mise sur le marché de substances actives correspondantes.
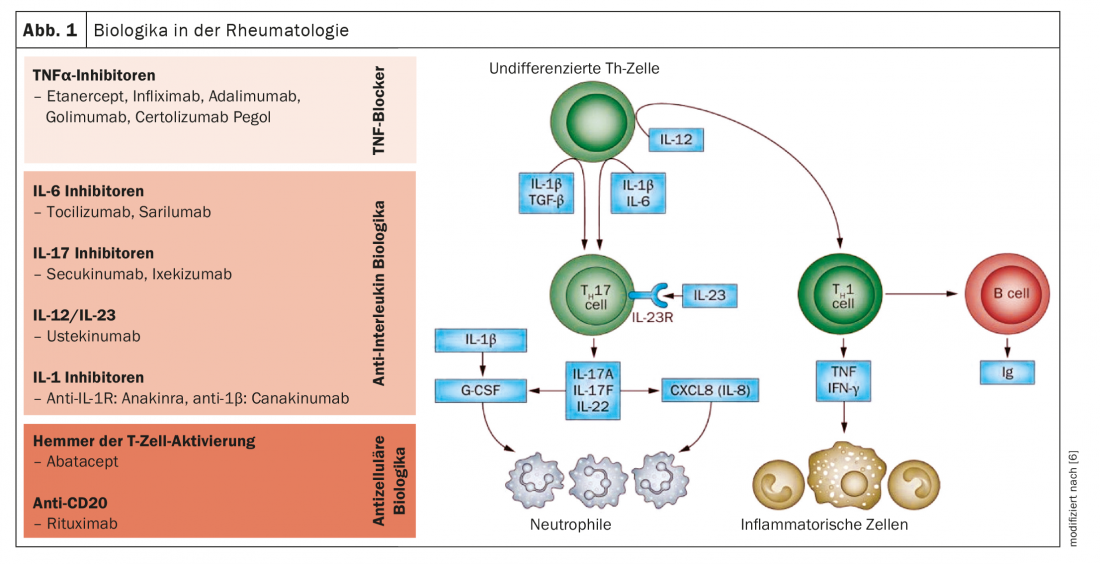
Macrophages tissulaires dans le cadre de la cascade inflammatoire
Les anticorps biologiques et les médicaments synthétiques autorisés jusqu’à présent bloquent les cytokines ou leurs récepteurs, qui sont libérés par les cellules du système immunitaire dans le cadre des processus inflammatoires (fig. 1 et 2). La recherche fondamentale s’est entre-temps tournée vers les différentes cellules inflammatoires qui produisent ces cytokines. Les méthodes omiques récentes, telles que le séquençage de l’ARN d’une cellule unique, le profilage des ribosomes, ou la spectrométrie de masse, permettent pour la première fois d’avoir un aperçu des cellules individuelles. “Les études montrent quels groupes de cellules se comportent différemment chez les patients atteints de rhumatisme que chez les personnes en bonne santé et qui sont donc probablement impliqués dans le processus de la maladie”, explique le professeur Wagner [1]. En combinant différentes technologies omiques, il est possible d’obtenir une image plus complète de l’expression des gènes, de la quantité de protéines ou de différents processus intracellulaires. L’un des acteurs centraux de la polyarthrite rhumatoïde est constitué par les macrophages tissulaires, qui sont également présents dans la membrane synoviale des personnes en bonne santé. “La recherche vise à clarifier ce qui pousse ces cellules à libérer les cytokines inflammatoires et comment cela pourrait être évité”, a-t-il ajouté.
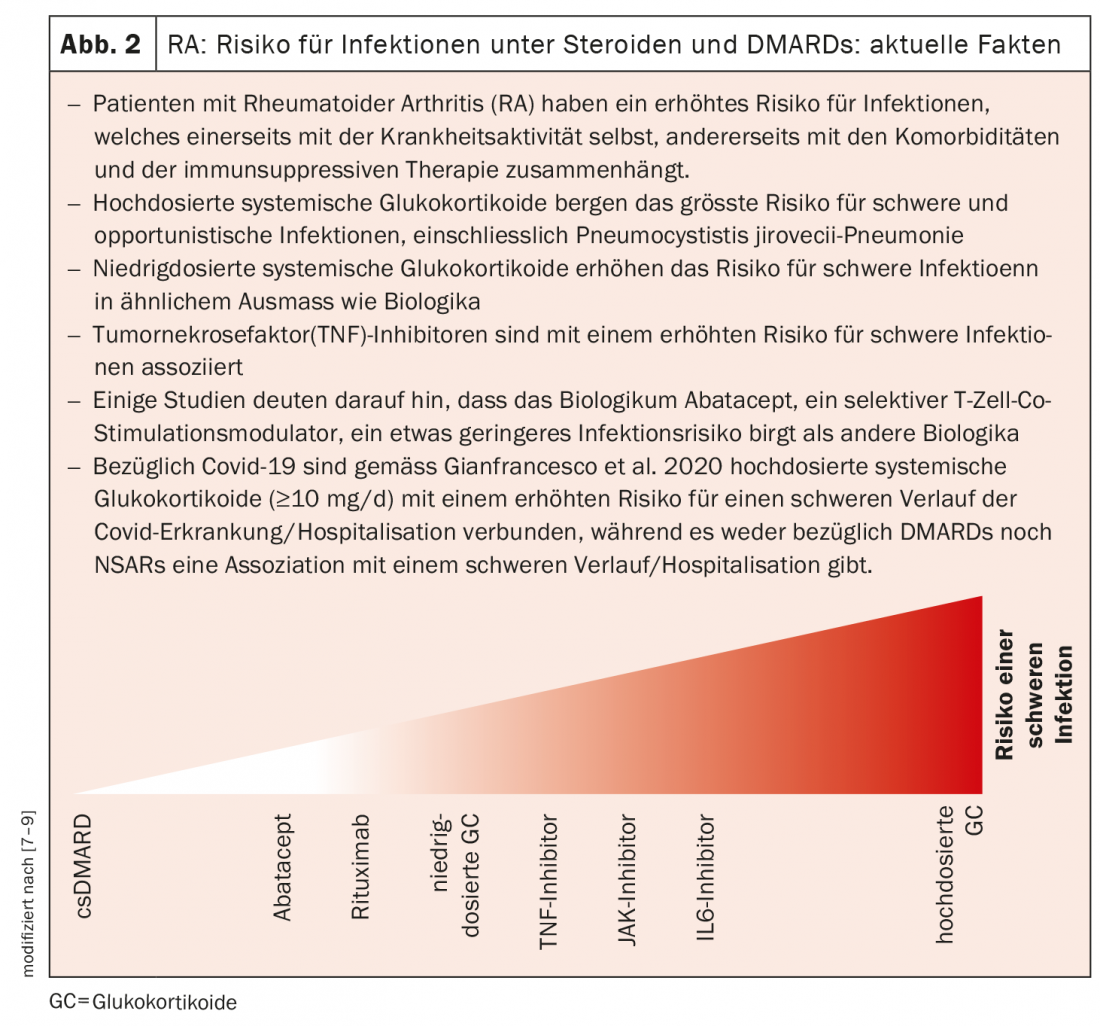
Les macrophages tissulaires MerTK-négatifs et CD206-négatifs comme cible
Les chercheurs fondamentaux ont par exemple découvert qu’il existe deux groupes de macrophages tissulaires qui se distinguent par les marqueurs de surface MerTK et CD206. Une étude récente publiée dans Nature Medicine a révélé que les macrophages tissulaires MerTK-négatifs et CD206-négatifs produisent une série de cytokines et d’alarmines pro-inflammatoires, favorisant ainsi les réactions inflammatoires dans la membrane synoviale [4]. En revanche, les macrophages tissulaires MerTK-positifs et CD206-positifs semblent inhiber les réactions inflammatoires. Ces cellules sont principalement trouvées chez les patients dont l’inflammation a complètement disparu. Le professeur Wagner explique : “L’idée d’une approche thérapeutique serait de mettre les macrophages tissulaires en état de repos permanent à l’aide de médicaments et de stopper ainsi la maladie à long terme”.
Congrès : Réunion annuelle de la DGRh
Littérature :
- “Polyarthrite rhumatoïde : l’analyse de cellules individuelles permet d’avoir un nouvel aperçu de l’évolution de la maladie – de nouvelles approches thérapeutiques sont attendues”, Congrès allemand de rhumatologie, 16.09.2021
- Swissmedicinfo : Orencia®, www.swissmedicinfo.ch (dernière consultation 18.11.2021)
- Graninger W, Emminger W, Scheinecker C : J Med Drug Rev 2013 ; 3 : 44-60.
- Alivernini S, et al : Nat Med 2020 ; 26(8) : 1295-1306.
- Rosenstiel P, Franke A, Schreiber S : Prévoir l’inflammation chronique et la traiter individuellement. www.systembiologie.de (dernier appel 18.11.2021)
- Mihai C : Rheuma Workshop, Dr. med. Carmen-Marina Mihai, 23.09.2021 ; www.usz.ch/app/uploads/2021/09/CMihai_NW-Biologika_RheumaWorkshop_Sept21.pdf (dernière consultation 18.11.2021)
- Tamborrini G : Risque d’infection sous DMARD et stéroïdes, Weekly 2021, www.rheuma-schweiz.ch (dernière consultation 18.11.2021)
- Riley TR, et al : Risk for infections with glucocorticoids and DMARDs in patients with rheumatoid arthritis, RMD Open 2021 : online.
- Gianfrancesco M, et al : Ann Rheum Dis 2020 ; 79 : 859-866.
InFo DOULEUR & GERIATRIE 2021 ; 3(2) : 30-31
PRATIQUE DU MÉDECIN DE FAMILLE 2021 ; 16(12) : 20-22