Une lymphadénopathie persistante est une indication claire pour un diagnostic histopathologique plus poussé. Une anamnèse détaillée ainsi que la connaissance des maladies antérieures, des manipulations et des traitements médicamenteux sont indispensables pour établir un diagnostic définitif de lymphome. Il existe des cas qui se situent dans des zones grises du point de vue de la classification. La présence de réarrangements MYC est un biomarqueur pronostique indiscutable dans le DLBCL, ainsi qu’une co-expression phénotypique des protéines myc et bcl2. La réponse au traitement par rituximab est liée à l’expression de CD20. Les études moléculaires mettent en évidence de nouveaux paramètres génétiques prédictifs de la réponse spécifique aux thérapies ciblées dans le lymphome.
Les lymphomes représentent le cinquième groupe d’affections malignes le plus fréquent chez les deux sexes, avec une part relative de 5%. Les lymphomes B à cellules matures en particulier (anciennement “lymphomes non hodgkiniens”) présentent l’incidence de malignité la plus forte croissance dans le monde industrialisé après le mélanome.
Les causes de ce phénomène sont inconnues, mais elles pourraient être liées à l’augmentation de l’espérance de vie, à l’incidence croissante des maladies auto-immunes et à l’utilisation généralisée des (nouveaux) immunosuppresseurs qui en découle, ou à l’exposition croissante à certains pesticides et herbicides. L’incidence du lymphome est actuellement d’environ 25 cas/100 000 habitants/an.
Les progrès du traitement oncologique sont évidents dans le cas des lymphomes. Les taux de survie à 5 ans spécifiques à la maladie sont d’environ 60% (DLBCL) et d’environ 80% (les autres entités) pour les lymphomes nodulaires les plus fréquents, tels que le lymphome diffus à grandes cellules B (DLBCL), le lymphome folliculaire (FL), le lymphome hodgkinien classique (HL) et le lymphome lymphoblastique à cellules B (B-LBL, équivalent nodulaire de la leucémie lymphoïde aiguë à cellules B). Cela explique la forte prévalence des lymphomes.
Définition
Les lymphomes sont définis comme des affections malignes et néoplasiques des lymphocytes B, T ou NK à cellules immatures ou matures dans les organes du système lymphatique (nodal) ou en dehors de ces organes (extranodal). Ils peuvent être leucémiques ou sans effusion (lymphomes au sens strict).
Clinique
Les lymphomes ganglionnaires se présentent sous la forme d’une lymphadénopathie localisée ou généralisée, persistante (plus de trois semaines), souvent progressive, avec ou sans symptômes généraux (B) (fièvre, sueurs nocturnes, perte de poids), atteinte d’organes, modifications cutanées (prurit, érythème) ou signes d’insuffisance médullaire (anémie, pétéchies, tendance aux infections).
Une lymphadénopathie persistante, en particulier accompagnée des symptômes mentionnés, est donc une indication claire pour un diagnostic plus approfondi.
Diagnostic
Le diagnostic basé sur les tissus est indispensable pour les lymphomes, car les modifications histopathologiques des tissus sont les pierres angulaires de la détermination de la valeur intrinsèque et de l’entité. Ces modifications permettent de distinguer, par microscopie optique conventionnelle, la bénignité de la malignité et le degré de maturation des lymphocytes concernés. Des méthodes microscopiques in situ plus poussées, telles que l’immunohistochimie (expression des protéines) ou l’hybridation in situ par fluorescence (aberrations chromosomiques récurrentes), permettent de déterminer l’appartenance à une lignée (B, T ou NK), le stade exact de développement (par exemple, cellule B du centre germinal), l’expression de marqueurs pathologiques (par exemple, l’expression de marqueurs de cellules T sur les cellules B, comme dans la leucémie lymphocytaire chronique à cellules B [B-CLL]) ou translocation chromosomique existante (par exemple, t[14;18] chez le FL) et d’établir un diagnostic précis. Il s’agit d’une condition préalable à un traitement oncologique spécifique. Dans les cas difficiles à diagnostiquer, il est possible d’obtenir de l’ADN à partir du matériel (fixé au formol et inclus dans de la paraffine) et de l’analyser plus avant en termes de clonalité des cellules B et T, de translocations et de mutations ponctuelles.
Classification
Les lymphomes sont classés selon la classification actuelle de l’OMS. Le principe suprême est le diagnostic intégratif, qui considère que la morphologie histopathologique du lymphome, les phénotypes (profils d’expression des protéines), les génotypes (aberrations chromosomiques récurrentes) et la clinique ont la même importance dans la classification des entités.
La séparation primaire des lymphomes en lymphomes hodgkiniens et non hodgkiniens a été abandonnée. En raison de sa morphologie caractéristique, de sa présentation clinique et de son excellente réponse aux traitements spécifiques, le HL continue d’être considéré comme une entité à part entière.
Nouvelles catégories : En raison de la complexité biologique de certaines maladies, l’OMS a introduit deux catégories dites de “zones grises” :
- lymphomes à cellules B inclassables avec des caractéristiques intermédiaires entre un DLBCL et un HL
- les lymphomes à cellules B inclassables présentant des caractéristiques intermédiaires entre un DLBCL et un lymphome de Burkitt (BL).
Outre les chevauchements cliniques et morphologiques entre les différentes entités des deux catégories, les études moléculaires montrent un chevauchement significatif des gènes exprimés entre les lymphomes médiastinaux primaires à grandes cellules B et le LH d’une part, et entre les DLBCL individuels et les BL d’autre part.
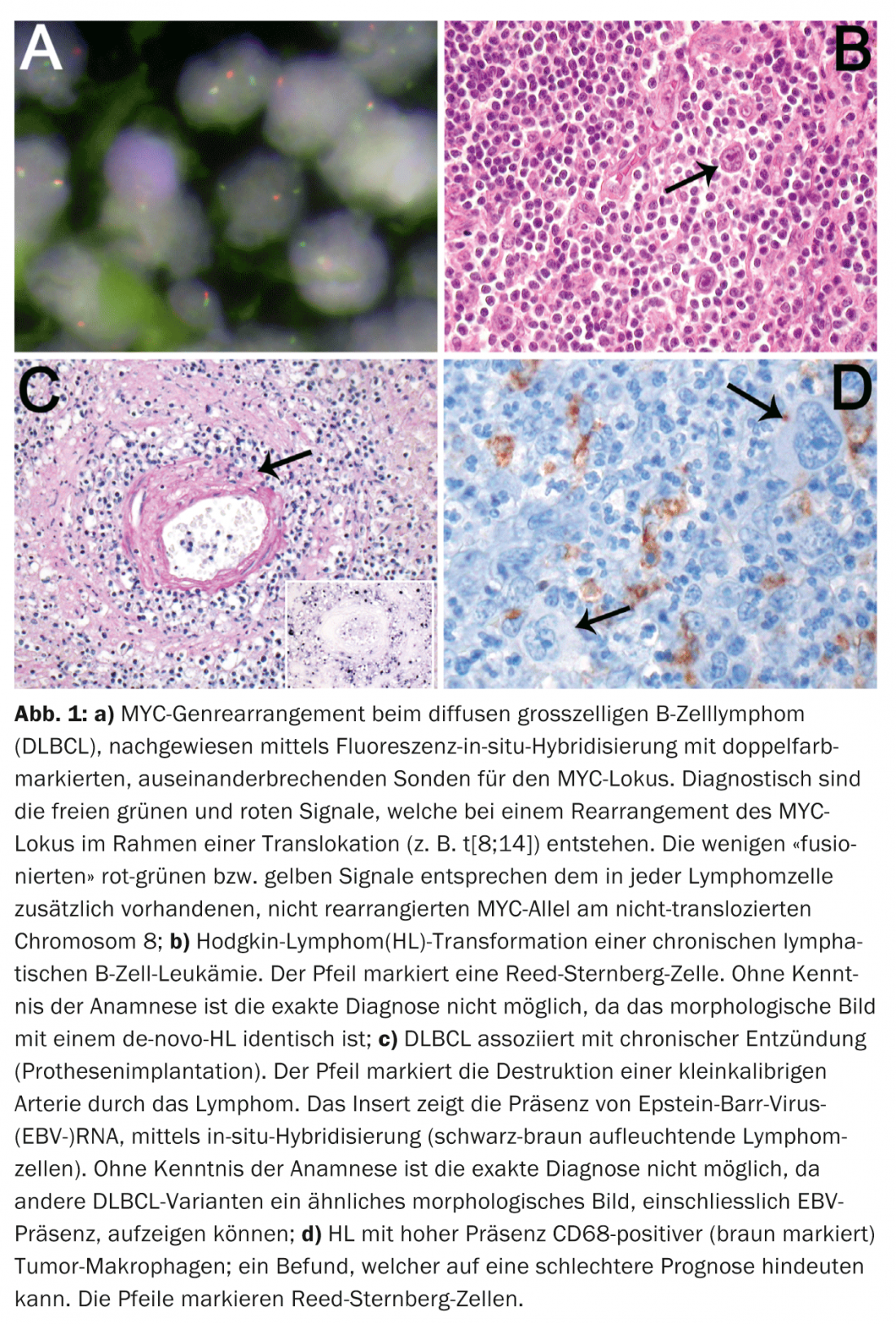
L’évolution clinique défavorable des cas de DLBCL hautement prolifératifs avec un arrangement du gène MYC (Fig. 1a) justifie en outre l’introduction d’une telle catégorie de zones grises afin de suivre ces cas, qui présentent une réponse insuffisante aux traitements standard du DLBCL, dans des essais thérapeutiques prospectifs.
Catégories diagnostiques basées sur des paramètres cliniques : La classification de l’OMS a fortement pris en compte le contexte lié au patient, comme l’âge, le traitement médicamenteux antérieur ou en cours, notamment immunosuppresseur, et la localisation. Quatre entités sont définies par l’âge des patients :
- FL pédiatrique
- lymphome B nodulaire de la zone marginale pédiatrique (LMZM)
- Maladie lymphoproliférative à cellules T de l’enfant associée au virus d’Epstein-Barr (EBV)
- DLBCL associé à l’EBV chez les personnes âgées.
La justification de l’introduction de ces entités est le lien entre l’émergence et l’immaturité ou la sénescence du système immunitaire. Alors que les trois premiers sont extrêmement rares, la proportion relative des derniers est de 3% de tous les DLBCL. Bien que des études menées en Extrême-Orient indiquent une agressivité évidente de ce lymphome, nos données d’Europe centrale ne montrent une agressivité clinique particulière que dans des cas isolés.
Pour refléter la fréquence et l’hétérogénéité du DLBCL, d’autres variantes clinico-pathologiques ont été définies dans la nouvelle classification. Pour certaines de ces variantes, comme le DLBCL associé à une inflammation chronique (pyothorax, ostéomyélite chronique, implants de corps étrangers infectés, i.e. prothèses vasculaires/articulaires, ulcères cutanés chroniques, articulations arthritiques en cas de polyarthrite rhumatoïde), la connaissance de la clinique est indispensable à la classification. (Fig. 1b). Comme 70% de ces lymphomes sont associés à l’EBV et surviennent en grande partie chez des patients âgés, la différenciation avec le DLBCL associé à l’EBV chez les personnes âgées n’est possible que sur la base des indices anamnestiques.
La connaissance de la clinique est également indispensable pour le diagnostic des maladies lymphoprolifératives iatrogènes, associées à l’immunodéficience (traitement par immunosuppresseurs), ainsi que pour le diagnostic des lymphoproliférations post-transplantation (transplantation d’organe ou allogénique de moelle osseuse). Il en va de même pour le diagnostic des “lymphomes B à petites cellules” secondaires et transformés (B-CLL, MZL, FL), qui peuvent se transformer en DLBCL, en lymphome B inclassable avec des caractéristiques intermédiaires entre un DLBCL et un BL, ou en HL. L’indication anamnestique d’un lymphome indolent antérieur appartenant au groupe des “lymphomes à petites cellules B” est essentielle pour la classification correcte de telles lésions. Ceci est important car les DLBCL ou HL (Fig. 1c), qui se transforment à partir de ces lymphomes à cellules B, ont une évolution nettement plus agressive que leurs analogues de novo.
Pronostic et prédiction
De nombreuses études menées au cours de la dernière décennie ont eu pour objectif d’établir des facteurs pronostiques importants liés aux tumeurs dans les lymphomes ganglionnaires les plus courants, tels que le DLBCL, le FL et le LH. Les facteurs pronostiques cliniques connus tels que l’indice pronostique international (IPI) pour le DLBCL, l’indice pronostique international FL (FLIPI) et le score pronostique international (IPS) pour le LH n’ont cependant pas été dépassés par l’inclusion de facteurs pronostiques liés à la tumeur. A l’exception de quelques variantes du DLBCL qui sont associées à un pronostic plutôt mauvais, comme le DLBCL riche en cellules T et en histocytes, la granulomatose lymphomatoïde et le DLBCL intravasculaire, seule la détection de réarrangements MYC est un paramètre pronostique indiscutable lié à la tumeur dans le DLBCL. Trois études indépendantes, récentes et de grande envergure ont mis en évidence le rôle pronostique défavorable de la co-expression phénotypique des protéines myc et bcl2 (appelée “phenotypic double-hit DLBCL”). Des études sur le LH et le LF ont montré un effet pronostique de la composition des cellules T du fond. Des études récentes sur l’expression des gènes ont également montré que les signatures des macrophages associés aux tumeurs peuvent avoir un impact significatif sur la survie dans le LH, ce qui se traduit morphologiquement par une quantité élevée de macrophages tissulaires chez les patients au pronostic défavorable (Fig. 1d).
En résumé, les marqueurs pronostiques dans le lymphome ne sont pas encore prêts à être utilisés dans la pratique quotidienne. La recherche de paramètres pronostiques associés au microenvironnement tumoral s’avère toutefois prometteuse, d’autant plus que cet environnement pourrait être manipulé à des fins thérapeutiques sans craindre le développement d’une résistance par la tumeur.
Un autre domaine de recherche concerne l’établissement de marqueurs prédictifs, c’est-à-dire de biomarqueurs indiquant la réponse ou la non-réponse à un traitement. Bien que l’expression de CD20 n’ait pas été spécifiquement étudiée dans les études cliniques menées lors de l’établissement de l’anticorps thérapeutique anti-CD20 rituximab, l’expérience montre que seuls les lymphomes à cellules B exprimant CD20 répondent à ce traitement. La détermination de l’expression du CD20 dans les lymphomes est donc un exemple de marqueur prédictif déterminable par histopathologie.
Des données récentes indiquent que la sensibilité spécifique aux inhibiteurs de la kinase Bruton (par exemple, l’ibrutinib), aux agents favorisant l’apoptose (par exemple, l’obatoclax) et aux inhibiteurs de la kinase phosphoinositide-3 (y compris les inhibiteurs de mTOR tels que l’évérolimus) peut être prédite à partir de modifications génétiques spécifiques des lymphocytes.
Pr Dr. med. Alexandar Tzankov
Professeur Dr. med. Stephan Dirnhofer
Littérature :
- Roman E, Smith AG : Histopathologie 2011 ; 58 : 4-14.
- Swerdlow SH, et al : WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon : IARC ; 2008.
- Hoeller S, et al : Hum Pathol 2010 ; 41 : 352-357.
- Tzankov A, et al. : Mod Pathol 2013 ; doi : 10.1038/modpathol.2013
- Hu S, et al : Blood 2013 ; 121 : 4021-4031.
- Steidl C, et al : N Engl J Med 2010 ; 362 : 875-885.
- Tzankov A, et al : Haematologica 2008 ; 93 : 193-200.
- Rahal R, et al : Nat Med 2014 ; 20 : 87-92.
- Wenzel SS, et al : Leukemia 2013 ; 27 : 1381-1390.
- Pfeifer M, et al. : Proc Natl Acad Sci U S A. 2013 ; 110 : 12420-12425.
InFo Oncologie & Hématologie 2014 ; 2(2) : 5-7











