Dans le traitement du diabète sucré de type 2, les dernières années ont apporté quelques nouveautés en ce qui concerne le diagnostic, les objectifs thérapeutiques et le choix des antidiabétiques. “A patient centered approach” sont les mots clés du document de position commun des associations américaines et européennes du diabète, qui propose une plus grande individualisation des objectifs thérapeutiques en ce qui concerne le contrôle de la glycémie et les facteurs de risque cardiovasculaire [1]. La durée du diabète, l’âge du patient, le risque d’hypoglycémie, les comorbidités et l’observance doivent être pris en compte lors de la définition des objectifs thérapeutiques. La mise en œuvre de modifications du mode de vie reste la mesure la plus importante dans le traitement du diabète sucré. Les antidiabétiques disponibles permettent d’adapter le traitement aux besoins et aux comorbidités du patient. Cependant, le nombre croissant de médicaments antidiabétiques exige également une formation continue et une expérience des médecins traitants. Cet article vise à donner un aperçu des objectifs et des options thérapeutiques pour les patients atteints de diabète de type 2.
L’HbA1c a été introduite en 2009 comme nouveau critère de diagnostic du diabète. Elle est moins sensible que la glycémie à jeun, mais elle est un outil pratique en raison de son test indépendant du moment de la journée. Les critères de diagnostic du pré-diabète et du diabète sucré manifeste sont énumérés dans le tableau 1. Un dépistage est proposé chez tous les patients âgés de 45 ans et plus, ainsi que chez les personnes en surpoids dont l’IMC est ≥25 kg/m2 et qui présentent un facteur de risque supplémentaire de diabète sucré [1].

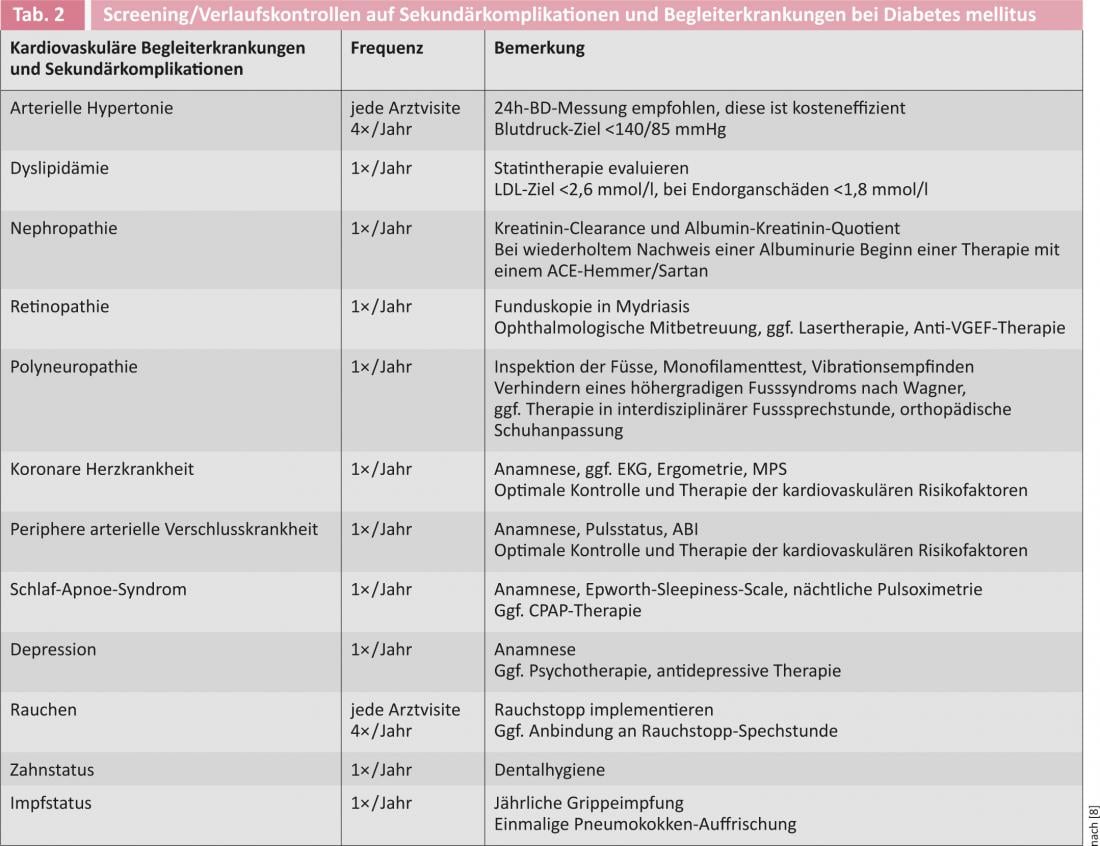
Étant donné qu’un trouble de la tolérance au glucose est généralement présent depuis plusieurs années lors du diagnostic initial du diabète sucré, il est recommandé de procéder à un dépistage des complications secondaires liées au diabète et des comorbidités cardiovasculaires dès le diagnostic (tableau 2). Le dépistage doit être répété à intervalles annuels.
Objectifs thérapeutiques
De grandes études cliniques telles que la “UK Prospective Diabetes Study” (UKPDS) ou l’étude Steno-2 ont montré qu’un contrôle optimal de la glycémie, associé à un traitement des autres facteurs de risque cardiovasculaire, entraîne une réduction significative des complications tant micro que macrovasculaires [2–6]. Les données de suivi à 10 ans de l’UKPDS nous ont appris qu’un contrôle strict de la glycémie après le premier diagnostic de diabète pendant une décennie après la fin de l’étude réduit les complications tardives et la mortalité (“mémoire métabolique”) [5]. Trois grandes études avec des objectifs thérapeutiques beaucoup plus agressifs (HbA1c <6% vs. 7-7,9% [7]) que par exemple dans l’UKPDS (7% vs. 7,9% [2]) ont montré une augmentation de la mortalité, c’est pourquoi un objectif “individualisé” est maintenant favorisé [1, 2, 7, 8]. Il s’agit de prendre davantage en compte la durée du diabète, l’âge du patient, les comorbidités et l’observance. Pour la majorité des patients (c’est-à-dire les patients ayant une longue espérance de vie, une courte durée de diabète, l’absence de comorbidités graves et une bonne adhérence au traitement), l’objectif thérapeutique reste une HbA1c <7%, tout en évitant les hypoglycémies. En cas de comorbidités importantes, notamment cardiovasculaires, d’espérance de vie courte, de risque élevé d’hypoglycémie et de risque de chute, il faut envisager d’assouplir l’objectif d’HbA1c à 7-8%.
Options thérapeutiques
Le traitement du diabète sucré de type 2 doit avoir une approche globale, c’est-à-dire qu’il doit toujours inclure une perte de poids, une optimisation du profil de risque cardiovasculaire et la prévention des hypoglycémies. Les hypoglycémies récurrentes sont probablement responsables des complications à long terme, tout comme les hyperglycémies, et doivent être évitées.
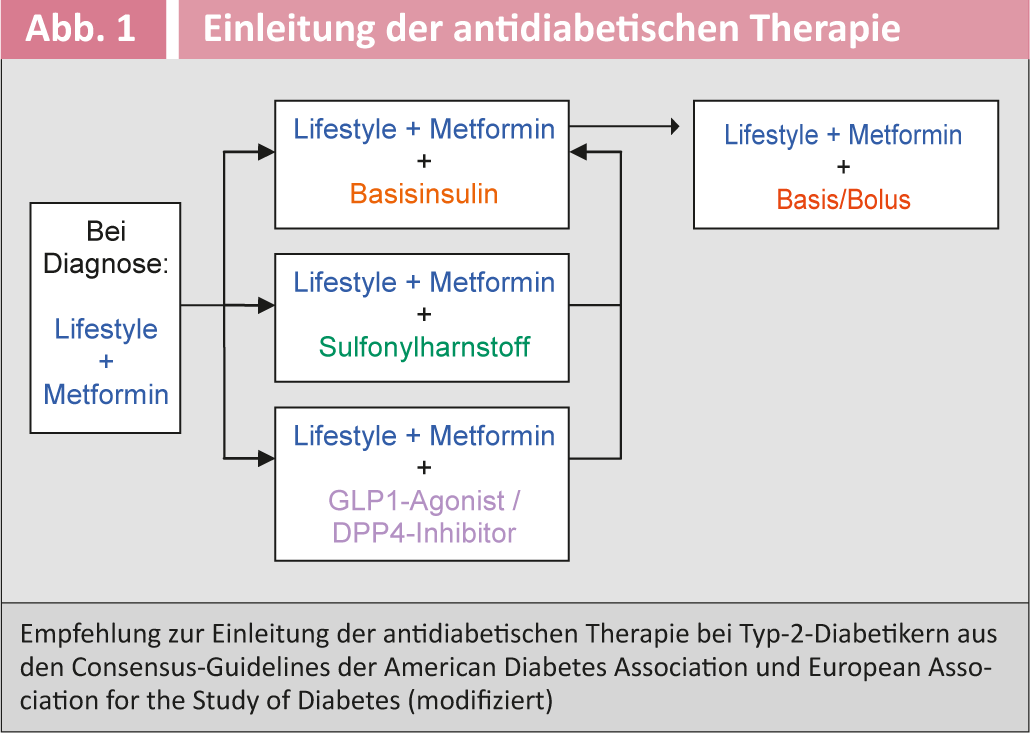
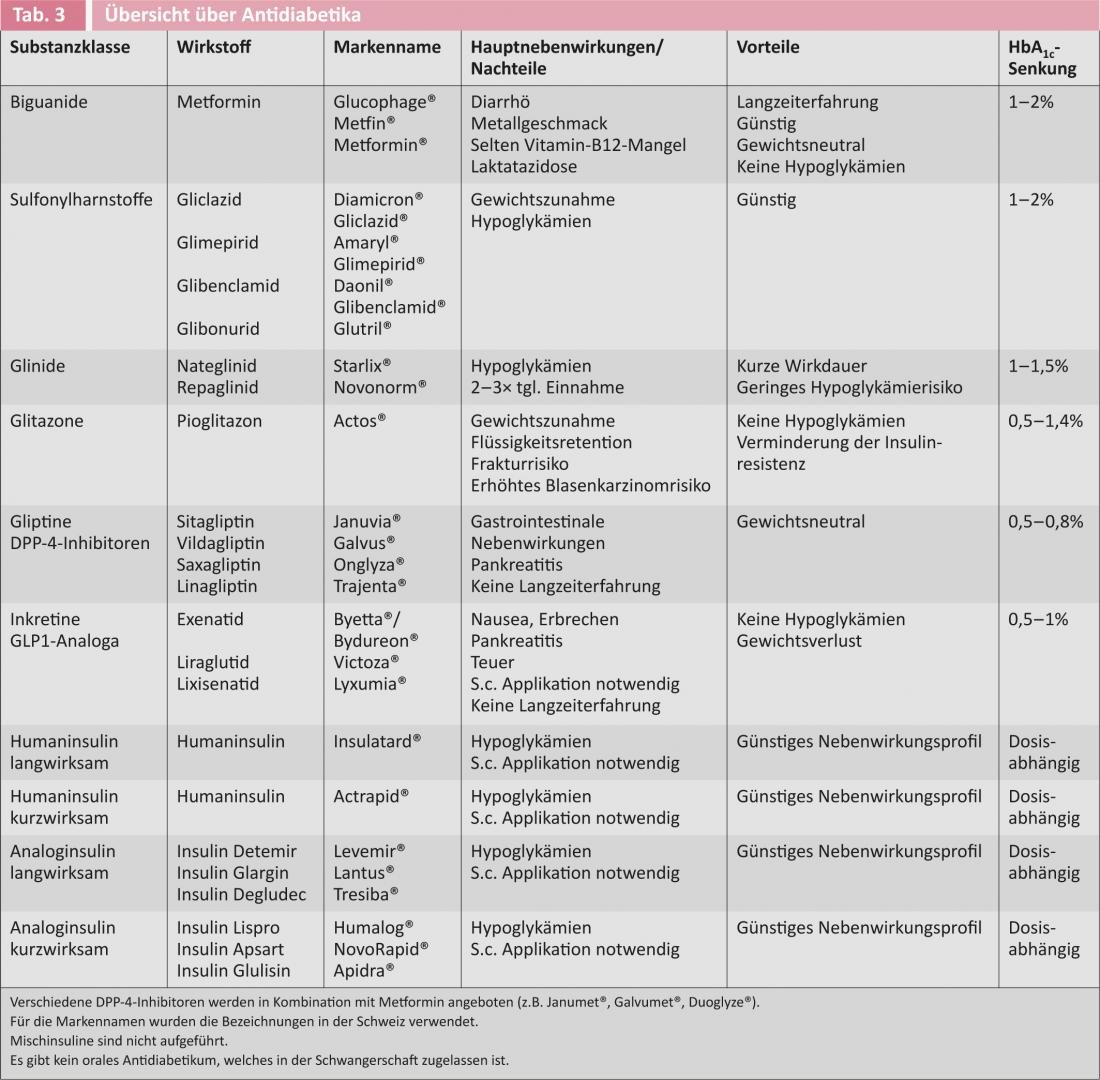
La figure 1 illustre les recommandations actuelles des associations américaine et européenne du diabète concernant l’initiation du traitement antidiabétique chez les diabétiques de type 2 [6]. Le tableau 3 donne un aperçu des antidiabétiques disponibles.
Intervention sur le mode de vie, sport
Le manque d’activité physique et la suralimentation, qui entraînent consécutivement un surpoids et une résistance à l’insuline, sont les principaux facteurs environnementaux qui augmentent le risque de diabète. Même une perte de poids modérée de 5 à 10 % du poids corporel entraîne une nette amélioration du métabolisme diabétique et du profil de risque cardiovasculaire et peut rendre inutile le traitement médicamenteux du diabète. Les modifications du mode de vie incluent un régime alimentaire sain, équilibré et hypocalorique tout au long de la vie, ainsi qu’une activité physique régulière (par exemple, au moins 150 min/semaine) [8]. Les interventions nutritionnelles et sportives accompagnées ont souvent des effets durables (par exemple, Diafit.ch).
Metformine
En l’absence de contre-indications, la metformine est l’antidiabétique oral de premier choix en raison de son profil d’action favorable et de sa longue expérience. La metformine est neutre ou légèrement hypoglycémiante et n’entraîne pas d’hypoglycémie. Ses principaux effets sont une réduction de la gluconéogenèse hépatique, une amélioration de l’absorption du glucose par les cellules musculaires et adipeuses et une réduction des triglycérides [9]. Depuis peu, son utilisation est recommandée dès le diagnostic chez les patients ayant peu de chances d’obtenir des changements radicaux de leur mode de vie. Des études récentes postulent une réduction de l’incidence du cancer et de la mortalité sous traitement par metformine. Les principaux effets secondaires sont des troubles gastro-intestinaux qui peuvent être réduits par une adaptation lente du médicament et une bonne information du patient [9]. Dans des cas extrêmement rares (<1 cas/100 000 patients), la survenue d’une acidose lactique a été décrite chez des patients présentant une insuffisance rénale sévère, la metformine est donc contre-indiquée chez les patients ayant une clairance de la créatinine <30 ml/min.
Sulfonylurées
Les sulfonylurées (glibenclamide, gliclazide, glimépiride, glibonuride) stimulent la sécrétion d’insuline indépendamment de la prise alimentaire, augmentant ainsi le risque d’hypoglycémie et entraînant souvent une prise de poids. Les hypoglycémies surviennent surtout chez les personnes âgées et en présence d’une insuffisance rénale sévère (clairance de la créatinine <30 ml/min), le risque étant le plus élevé avec les glibenclamides. L’avantage des sulfonylurées est qu’elles sont établies depuis longtemps et que leurs effets secondaires sont donc bien connus. Les patients sous traitement par sulfonylurée doivent pouvoir mesurer leur glycémie et recevoir une formation sur les hypoglycémies et les mesures comportementales à prendre avant de prendre le volant [1, 6].
Glinide
Comme les sulfonylurées, les glinides (natéglinide/répaglinide) stimulent la sécrétion d’insuline, il n’est donc pas judicieux de les associer. Les glinides ont une demi-vie plus courte et sont administrés à chaque repas. L’ampleur de la prise de poids est similaire à celle des sulfonylurées et le risque d’hypoglycémie est moindre [1, 6].
Glitazones
Les glitazones sont également appelées “sensibilisateurs à l’insuline”, car elles améliorent la sensibilité à l’insuline du muscle, de la graisse et du foie. La rosiglitazone a été retirée du marché suisse en 2010 en raison d’un risque cardiovasculaire accru, de sorte que la pioglitazone est la seule substance autorisée en Suisse. Outre la prise de poids connue, le traitement par glitazones peut entraîner une rétention de liquide, des œdèmes périphériques et, par conséquent, une insuffisance cardiaque, ainsi qu’une diminution de la densité osseuse, un risque accru de fractures et une augmentation de l’incidence du cancer de la vessie [1, 6]. La Société suisse d’endocrinologie et de diabétologie ne recommande l’utilisation de la pioglitazone que chez des patients sélectionnés présentant une insulinorésistance sévère et en l’absence de contre-indications, notamment une insuffisance cardiaque.
Incrétine
Agonistes des récepteurs GLP1 : l’effet dit “incrétin” décrit le phénomène selon lequel une prise orale de glucose induit une sécrétion d’insuline plus importante qu’une administration intraveineuse de glucose. L’effet incrétin est responsable d’environ 60% de la sécrétion d’insuline postprandiale. Les deux incrétines connues, le glucagon-like-peptide-1 (GLP1) et le glucose-dépendent-insulinotropic-peptide (GIP), sont libérées par les cellules entéroendocrines de la paroi intestinale après l’ingestion perorale de nourriture. Ceux-ci activent les cellules β pancréatiques, ce qui entraîne une augmentation de la sécrétion d’insuline. De plus, en agissant sur les cellules α, ils inhibent la gluconéogenèse, retardent la vidange gastrique et inhibent l’appétit de manière centrale. Comme l’action des incrétines est glucodépendante, il n’y a pas d’hypoglycémie en monothérapie. Autre effet positif, les agonistes du GLP1 favorisent la perte de poids. Les analogues du GLP1 sont coûteux et doivent être appliqués par voie sous-cutanée. Les principaux effets secondaires sont les nausées, les vomissements et la diarrhée [1, 6].
Inhibiteurs de la gliptine/de la DPP-4 : la GIP et le GLP1 sont rapidement dégradés par la dipetidyl peptidase-4 (DPP-4), ce qui a conduit au développement d’une autre classe de substances, les inhibiteurs de la DPP-4. Le traitement par les inhibiteurs de la DDP-4 ne provoque pas d’hypoglycémie et est neutre sur le plan pondéral. La tolérance des inhibiteurs de la DPP-4 est bonne, les troubles gastro-intestinaux sont rares. Cependant, il existe des preuves d’un risque accru de cancer du pancréas et de pancréas. Des études à long terme avec des critères d’évaluation durs et l’apparition d’effets secondaires sont attendues prochainement. En cas d’insuffisance rénale, un ajustement de la dose est nécessaire pour la plupart des inhibiteurs de la DPP-4 [1, 6].
Insuline
Toutes les formes de diabète présentent une carence en insuline, de sorte qu’un remplacement de l’insuline constitue en principe toujours une option thérapeutique appropriée. Tous les patients placés sous insulinothérapie doivent recevoir une formation sur l’auto-surveillance de la glycémie et la conduite à tenir en cas d’hypoglycémie dans le cadre d’une consultation de diabétologie. Chez les diabétiques de type 2, on commence par une insuline au coucher avant la nuit à raison de 0,2 U/kgKG ou 10 U, et on titre lentement jusqu’à ce que la glycémie à jeun soit inférieure à 7 mmol/l. L’insuline de base peut être associée à un antidiabétique oral, de préférence la metformine. L’association avec les sulfonylurées n’apporte pas d’effet additif significatif à la réduction de l’HbA1c. Si l’HbA1c est toujours >7%, il convient de passer à un schéma base/bolus [1, 6].
Opérations bariatriques
L’opération la plus courante est le pontage gastrique (appelé Roux-en-Y), qui consiste à réduire considérablement la taille de l’estomac et à relier l’intestin grêle directement à l’estomac. Les résultats de ces opérations sont très convaincants à court terme, puisque dans de nombreux cas, la perte de poids tant attendue peut atteindre 30 à 40%. Les effets secondaires sont des signes de malabsorption, notamment une carence en fer et en vitamine B12, qui doivent être substitués. En postopératoire, les problèmes psychologiques sont fréquents, notamment en raison de la disparition de l’effet gratifiant de la nourriture. La mortalité liée au pontage gastrique est de l’ordre de 0,5%. Il n’est pas encore possible de dire si la chirurgie bariatrique est la panacée dans la lutte contre le diabète sucré, car il n’existe pas de données à long terme concernant la rémission du diabète et la réduction de la mortalité. Dans une prise de position de l’International Diabetes Federation (IDF) de 2011, la chirurgie bariatrique est principalement recommandée pour les diabétiques de type 2 obèses (IMC ≥35kg/m2) qui n’atteignent pas les objectifs thérapeutiques avec les mesures conventionnelles et qui présentent des comorbidités cardiovasculaires [10]. La chirurgie bariatrique ne doit pas être évaluée comme une option de dernier recours chez les diabétiques obèses souffrant d’insulinorésistance, mais comme une option thérapeutique précoce.
Procédure dans la pratique clinique quotidienne
Lorsqu’un diabète sucré est diagnostiqué, il convient de commencer des interventions sur le mode de vie tout en prenant un médicament à base de metformine. Pour l’intervention sur le mode de vie, il existe des programmes d’éducation ambulatoire pour les diabétiques. En outre, à ce stade, il convient de recenser tous les facteurs de risque cardiovasculaire et de rechercher les lésions des organes terminaux. Si le diabète est encore insuffisamment contrôlé par ces mesures (HbA1c >7,0%), la metformine doit être associée à une sulfonylurée ou à l’incrétine, ou encore à une insuline au coucher. Si le contrôle du diabète reste insuffisant, la mise en place d’une insuline au coucher ou d’un système de bolus de base est indiquée. Nous recommandons que les diabétiques obèses qui ne parviennent pas à perdre du poids de manière autonome soient rattachés à un centre de traitement de l’obésité expérimenté. La participation à un groupe ou à une association de lutte contre l’obésité peut y être proposée. l’option d’une intervention bariatrique doit être évaluée.
Bibliographie chez l’éditeur
Dr Stefanie Meyer
CARDIOVASC 2013 ; 12(4) : 20-24











