Une approche prometteuse pour le traitement de la sclérose en plaques réside dans le traitement spécifique à l’antigène. Elle vise à inhiber spécifiquement la réponse immunitaire autoréactive afin d’éviter les risques d’une immunosuppression globale.
Les maladies à médiation immunitaire, telles que les maladies auto-immunes, sont jusqu’à présent traitées par des thérapies non spécifiques et globalement immunosuppressives. Il en résulte souvent des effets secondaires et des risques accrus de complications. La sclérose en plaques (SEP) est une maladie auto-immune paradigmatique du système nerveux central. Le développement de nouveaux traitements pour la SEP a été très fructueux au cours de la dernière décennie et nous disposons désormais d’un grand nombre de nouveaux médicaments très efficaces. Cependant, toutes ces immunothérapies ont un effet non spécifique et entraînent une immunosuppression parfois plus profonde, avec les effets secondaires connus et des risques parfois élevés. Une autre conséquence est une restriction dans de nombreux domaines de la vie, comme la planification familiale, les vaccinations et les voyages.
Le développement de thérapies spécifiques aux antigènes, qui traitent avec une grande sélectivité uniquement les parties du système immunitaire responsables de l’inflammation autoréactive, aurait le potentiel de traiter la maladie au plus près de sa cause et d’éviter les risques de l’immunosuppression globale [1]. Une mise en œuvre réussie de cette stratégie thérapeutique constituerait une étape essentielle en médecine et un pas de plus vers la médecine de précision.
Alors que les premières études sur les thérapies spécifiques aux antigènes n’ont généralement pas atteint le succès escompté, des progrès importants ont été réalisés dans ce domaine au cours des dernières années, de sorte qu’une mise en œuvre réussie de ce concept thérapeutique prometteur est à portée de main. Parmi celles-ci figurent des stratégies thérapeutiques innovantes, qui sont déjà en cours de développement clinique précoce, et l’identification de nouveaux antigènes cibles de la réponse immunitaire autoréactive des patients atteints de SEP, ce qui ouvre la voie à de toutes nouvelles approches pour des thérapies spécifiques aux antigènes [2,3].
Une bonne compréhension de la pathogenèse de la maladie et des antigènes cibles de la réponse immunitaire autoréactive est une condition préalable essentielle au développement de thérapies spécifiques aux antigènes. La cause de la SEP n’est pas connue, mais on pense que des facteurs environnementaux et génétiques contribuent au déclenchement et à l’évolution de la maladie. Le facteur génétique de loin le plus important est un antigène leucocytaire humain spécifique (HLA), une molécule de surface responsable de la reconnaissance des antigènes par les lymphocytes T et qui constitue donc un facteur important dans le profilage des réponses immunitaires individuelles. En moyenne, 50% des patients atteints de SEP portent l’allèle à risque important HLA DRB1*1501, les autres se répartissant entre plusieurs autres allèles HLA. Le type HLA individuel devrait donc être pris en compte à l’avenir lors de l’examen des thérapies spécifiques aux antigènes chez les patients atteints de SEP. En outre, de nombreux résultats suggèrent une réponse immunitaire à médiation immunitaire et dirigée contre des auto-antigènes spécifiques dans la SEP [4].
Le spectre antigénique dans la SEP
Un certain nombre d’antigènes cibles différents ont été décrits dans la sclérose en plaques. Sur la base de la physiopathologie, avec une démyélinisation au premier plan dans le SNC, les protéines de la couche de myéline des cellules nerveuses du cerveau et de la moelle épinière ont été principalement étudiées. Les protéines les plus importantes dans ce contexte sont la protéine basique de la myéline (MBP), la protéine protéolipidique (PLP) et la gylocoprotéine oligodendrocytaire de la myéline (MOG). Dans différents modèles animaux chez la souris, le rat et le singe, une réaction immunitaire induite contre l’une de ces protéines peut déclencher une maladie inflammatoire démyélinisante qui ressemble à la SEP par de nombreuses caractéristiques. Cette réaction immunitaire est généralement dirigée contre quelques séquences peptidiques de ces protéines, qui sont décrites comme immunodominantes. Il est intéressant de noter que ces peptides immunodominants chez l’animal se chevauchent en grande partie avec les réactivités immunitaires trouvées chez les patients atteints de SEP [4]. Dans une étude sur des patients atteints de SEP, sept peptides de la myéline (MOG1-20, MOG35-5, MBP13-32 ; MBP83-99, MBP111-129, MBP146-170, PLP139-154) ont été identifiés à partir d’un plus grand nombre de peptides immunodominants des protéines de la myéline MBP, PLP, MOG et de la phosphodiestérase nucléotidique cyclique (CNP), pour lesquels la réactivité chez les patients atteints de SEP était différente de celle des contrôles [5]. Cet ensemble de peptides sert désormais de base à des thérapies spécifiques aux antigènes dans plusieurs approches.
Outre les protéines de la myéline, d’autres protéines pourraient jouer un rôle important en tant qu’antigènes cibles de la réponse immunitaire autoréactive dans le SNC, et récemment, deux nouveaux candidats ont été identifiés comme antigènes cibles importants chez les patients atteints de SEP. Contrairement aux études précédentes, qui reposaient essentiellement sur des concepts physiopathologiques préexistants et étaient transposées à l’homme à partir de modèles animaux, ces études récentes sont parties de patients atteints de SEP et ont examiné quelles séquences peptidiques étaient reconnues par des cellules T isolées directement à partir de tissus cérébraux inflammatoires de patients atteints de SEP [3]. La protéine TSTA3, une GDP L-fucose synthase, a ainsi été découverte comme antigène cible de la réponse immunitaire autoréactive [3]. Un aspect intéressant et très probablement pertinent d’un point de vue physiopathologique est que la protéine est également exprimée par certaines bactéries intestinales (Akkermansia), qui sont fréquemment détectées chez les patients atteints de SEP. Ces bactéries pourraient contribuer à l’activation immunitaire qui conduit ou entretient l’inflammation dans le cerveau. Un autre antigène cible important est la protéine RAS Guanyl Releasing Protein 2 (RASGRP2), qui est exprimée à la fois dans les cellules B du sang périphérique et du cerveau. Les cellules T des patients atteints de SEP, qui sont activées dans le sang périphérique, qui ont tendance à s’autoprolifier davantage et qui migrent préférentiellement vers le cerveau, présentent une réactivité accrue contre la protéine RASGRP2 et peuvent être détectées dans les lésions des patients atteints de SEP [2].
On ne peut pas supposer que la réponse immunitaire pathogène d’un patient atteint de SEP, ou en général dans la SEP, est dirigée contre un seul antigène, mais peut concerner différents antigènes. De plus, il a été démontré dans le modèle animal que cette autoréactivité peut se diversifier au cours de la maladie et s’étendre à différents antigènes. Chez l’homme, il existe peu de données à ce sujet, mais elles sont importantes, car la plupart du temps, le début de la maladie n’est pas clairement établi et, par conséquent, la cascade de diversification, et donc le spectre antigénique complet chez le patient individuel, n’est pas connu.
Mécanismes de la tolérance immunitaire
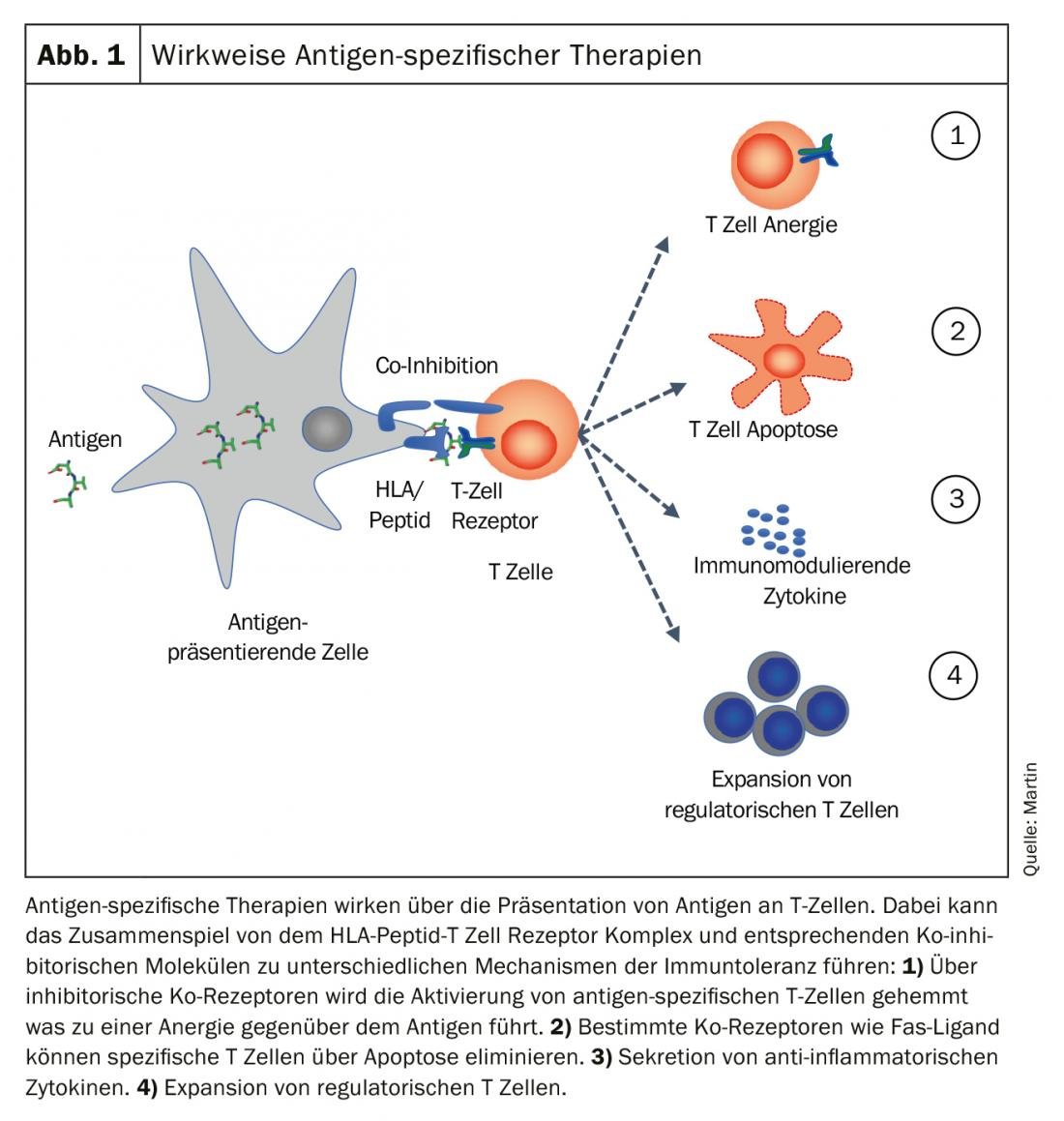
L’objectif des thérapies spécifiques à un antigène est de “rétablir” la tolérance immunologique à l’antigène spécifique. Différents mécanismes, seuls ou combinés, peuvent contribuer à l’établissement mais aussi au maintien de la tolérance immunitaire. Les quatre principaux mécanismes sont illustrés dans la figure 1.
- La cellule présentatrice d’antigène peut empêcher l’activation des lymphocytes T spécifiques de l’antigène via des co-récepteurs inhibiteurs et générer une anergie vis-à-vis de l’antigène.
- Les corécepteurs tels que Fas-Ligand peuvent déclencher une apoptose dans des cellules T spécifiques et les éliminer.
- La sécrétion de cytokines anti-inflammatoires crée un environnement tolérogène et induit l’expansion des cellules T régulatrices.
Thérapies spécifiques aux antigènes dans les essais cliniques
Différentes stratégies utilisant des thérapies spécifiques à l’antigène ont été testées jusqu’à présent dans le cadre d’essais cliniques chez des patients atteints de SEP. La plupart d’entre elles se sont focalisées soit sur des protéines de myéline individuelles, soit sur un petit nombre de peptides en tant qu’antigènes cibles pour l’induction de la tolérance. Seules quelques approches ont utilisé plusieurs peptides provenant de différentes protéines de myéline. Les voies d’administration testées étaient la voie orale, la voie transdermique, la voie épi- et sous-cutanée et la voie intraveineuse. Après les résultats négatifs des études sur l’administration orale de myéline ou l’application intraveineuse de peptides MBP, la vaccination des cellules T ou des récepteurs des cellules T, certaines approches thérapeutiques ont récemment montré des résultats positifs dans les études [1]. Une étude de phase II a examiné l’administration transdermique de trois peptides de la myéline, MOG35-55, MBP85-99 et PLP139-151, appliqués via un patch sur le haut du bras [6]. L’étude menée chez 30 patients atteints de SEP rémittente a atteint le critère d’étude d’une réduction des foyers prenant le contraste à l’IRM cérébrale. Les auteurs ont également pu montrer, au niveau mécanistique, une réduction des cellules T spécifiques du peptide et décrire l’importance des cellules dendritiques dans les ganglions lymphatiques de drainage [7]. Une autre approche thérapeutique utilise quatre peptides MBP qui sont appliqués par voie parentérale. Une étude de phase II menée chez 37 patients en rechute ayant reçu une injection intradermique bihebdomadaire de peptides MBP a démontré une réduction significative des lésions prenant le contraste à l’IRM cérébrale [8]. L’effet était lié à la dose et a persisté pendant toute la durée du traitement. L’injection intramusculaire d’un ADN conduisant à l’expression de la protéine MBP dans les cellules musculaires a été testée chez 267 patients. L’étude n’a pas atteint le critère d’évaluation principal, mais a pu démontrer une réduction des nouvelles lésions RM [9]. Cette méthode est actuellement poursuivie dans le traitement du diabète de type I. Elle permet de réduire le risque de complications. Une petite étude clinique de phase Ib sur des cellules dendritiques tolérogènes a confirmé l’innocuité et la tolérance de la procédure et a montré des preuves d’un effet sur les cellules immunitaires autoréactives [10]. Dans cette procédure, des monocytes autologues ont été obtenus par leucaphérèse et des cellules dendritiques tolérantes (tolDCs) chargées de peptides de myéline ont été cultivées in vitro à partir de ces monocytes. Les tolDCs ont été injectés par voie intraveineuse à huit patients atteints de SEP.
Outre la stratégie spécifique et la voie d’application, le choix et probablement le nombre des antigènes contre lesquels le traitement est dirigé sont importants pour le succès de la procédure. Une stratégie thérapeutique que nous avons suivie ces dernières années consiste à injecter par voie intraveineuse des cellules sanguines (leucocytes ou érythrocytes) couplées ex vivo à des peptides à la surface des cellules. Cette approche permet d’utiliser un plus grand nombre de peptides et d’inhiber ainsi la réaction immunitaire spécifique à l’antigène simultanément contre plusieurs antigènes. Dans le modèle animal, il a été possible de prévenir très efficacement aussi bien l’apparition de la maladie (prophylactique) que sa progression (thérapeutique), et la thérapie a été couronnée de succès dans différents modèles de maladies auto-immunes, d’allergie et de transplantation. De plus, les cellules couplées à l’antigène sont la seule méthode dont il a été démontré qu’elle pouvait empêcher la diversification de la réponse immunitaire.
Une première étude de phase Ib portant sur neuf patients atteints de SEP a évalué la sécurité et la tolérance de cellules sanguines mononucléées périphériques autologues couplées ex vivo à sept peptides de myéline provenant de MOG (MOG1-20, MOG35-55), MBP (MBP1-32, MBP83-99, MBP111-129, MBP146-170) et PLP (PLP139-154) [11]. Dans l’ensemble, le traitement a été très bien toléré et l’évolution de la SEP est restée stable. Les études immunologiques concomitantes n’ont pas non plus mis en évidence d’activité inflammatoire après le traitement et une réduction de la réactivité des cellules T spécifiques au peptide a été observée chez les patients ayant reçu la dose la plus élevée. Ces résultats ont été récemment confirmés avec des érythrocytes autologues comme cellules porteuses tolérogènes et des preuves d’un effet positif au niveau cellulaire et humoral ont été trouvées [Lutterotti et al. Congrès ECTRIMS, Stockholm, 2019]. Une extension de cette étude de phase Ib est en cours. À l’avenir, d’autres peptides provenant de nouveaux antigènes pourront être ajoutés à la procédure, ce qui permettra d’utiliser l’ensemble d’auto-antigènes le plus complet à ce jour dans une procédure de thérapie spécifique à un antigène.
Défis actuels et futurs
À l’ère de la médecine de précision, les thérapies spécifiques aux antigènes reviennent au premier plan des nouveaux développements thérapeutiques. Cette tendance est également soutenue par une meilleure compréhension de la genèse auto-immune de la maladie et l’identification de nouveaux antigènes cibles.
De nouvelles technologies, telles que les approches basées sur les nanoparticules et les cellules, sont déjà en développement préclinique précoce et élargiront à l’avenir l’éventail des possibilités thérapeutiques. La détection biologique de la tolérance immunitaire induite constitue un défi majeur pour l’évaluation et la comparabilité des nouvelles approches thérapeutiques. Jusqu’à présent, il n’existe aucune méthode biomédicale standardisée permettant de confirmer une réduction de la réponse immunitaire autoréactive au niveau cellulaire ou humoral après un traitement. Le développement de tests permettant d’identifier et de quantifier les réponses immunitaires spécifiques à un antigène après un traitement approprié est un aspect important du développement clinique et devrait également être utilisé pour la sélection et la stratification des patients dans les essais cliniques de thérapies spécifiques à un antigène. L’idéal serait de sélectionner les patients en fonction de leur immunoréactivité individuelle, de mesurer la réduction de la réponse immunitaire spécifique après traitement et de la corréler à la réponse clinique. De plus, l’exclusion d’une activation du système immunitaire par le traitement est un élément de sécurité pertinent, car elle pourrait entraîner une augmentation de l’activité de la maladie [12].
Les thérapies spécifiques aux antigènes amélioreront l’arsenal thérapeutique pour traiter la SEP et devraient idéalement être utilisées tôt dans la maladie afin d’empêcher la propagation des réponses immunitaires autoréactives. La bonne tolérance et le profil de sécurité élevé de cette approche thérapeutique constituent un avantage par rapport aux traitements non spécifiques actuels, en particulier dans les premières phases de la maladie. A l’avenir, en particulier chez les patients dont l’activité de la maladie est élevée, il faudrait également étudier la combinaison d’approches spécifiques à l’antigène avec les traitements standard actuels, dans le but d’obtenir un contrôle rapide de l’inflammation et de ne plus traiter que par un traitement spécifique à l’antigène au cours de l’évolution. Cela permet d’éviter les risques à long terme des thérapies actuelles.
Une question essentielle sera de savoir si une tolérance immunitaire à long terme, c’est-à-dire une élimination complète de l’autoréactivité même après l’arrêt du traitement, peut être obtenue ou si un traitement permanent spécifique à l’antigène doit être mis en place pour contrôler la maladie. Quoi qu’il en soit, les thérapies spécifiques aux antigènes révolutionneraient le traitement de la sclérose en plaques et d’autres maladies auto-immunes et représenteraient un grand progrès pour la médecine.
Messages Take-Home
- Les thérapies spécifiques aux antigènes sont un concept thérapeutique prometteur pour le traitement de la sclérose en plaques.
- L’objectif des thérapies spécifiques à l’antigène est d’inhiber spécifiquement la réponse immunitaire autoréactive et d’éviter les risques d’une immunosuppression globale.
- L’identification de nouveaux antigènes cibles dans la sclérose en plaques est une base importante pour le développement de thérapies spécifiques aux antigènes.
- Différentes approches thérapeutiques sont déjà dans les premières phases de développement clinique et montrent les premiers succès quant à leur efficacité.
Littérature :
- Lutterotti A, Martin R : Approches de la tolérance spécifique aux antigènes dans la sclérose en plaques. Expert Opin Investig Drugs 2014 ; 23:9-20.
- Jelcic I, Al Nimer F, Wang J, et al : Memory B Cells Activate Brain-Homing, Autoreactive CD4(+) T Cells in Multiple Sclerosis. Cell 2018 ; 175 : 85-100 e123.
- Planas R, Santos R, Tomas-Ojer P, et al : GDP-l-fucose synthase is a CD4(+) T cell-specific autoantigen in DRB3*02:02 patients with multiple sclerosis. Sci Transl Med 2018 ; 10.
- Sospedra M, Martin R : Immunologie de la sclérose en plaques. Annu Rev Immunol 2005 ; 23 : 683-747.
- Bielekova B, Sung MH, Kadom N, et al : Expansion and functional relevance of high-avidity myelin-specific CD4+ T cells in multiple sclerosis. J Immunol 2004 ; 172 : 3893-3904.
- Walczak, A, Siger M, Ciach A, et al : Application transdermique de peptides de myéline dans le traitement de la sclérose en plaques. JAMA Neurol 2013 ; 70 : 1105-1109.
- Jurynczyk M, Walczak A, Jurewicz A, et al : Immune regulation of multiple sclerosis by transdermally applied myelin peptides. Ann Neurol 2010 ; 68 : 593-601.
- Chataway J, Martin K, Barrell K et al. Effets de l’immunothérapie par ATX-MS-1467 pendant 16 semaines dans la sclérose en plaques en rechute. Neurology 2018 ; 90 : e955-e962.
- Garren H, Robinson WH, Krasulova E, et al : Phase 2 trial of a DNA vaccine encoding myelin basic protein for multiple sclerosis. Ann Neurol 2008 ; 63 : 611-620.
- Zubizarreta I, Florez-Grau G, Vila G, et al : Tolérance immunitaire dans la sclérose en plaques et la neuromyélite optique avec des cellules dendritiques tolérogènes chargées en peptides dans un essai de phase 1b. Proc Natl Acad Sci U S A 2019 ; 116 : 8463-8470.
- Lutterotti A, Yousef S, Sputtek A, et al : Antigen-specific tolerance by Autologous Myelin Peptide-Coupled Cells – A Phase I Trial in Multiple Sclerosis. Science Translational Medicine 2013 ; 5 : 188ra75.
- Bielekova B, Goodwin B, Richert N, et al : Potentiel encéphalitogène du peptide protéique de base de la myéline (acides aminés 83-99) dans la sclérose en plaques : résultats d’un essai clinique de phase II avec un ligand peptidique altéré. Nat Med 2000 ; 6 : 1167-1175.
InFo NEUROLOGIE & PSYCHIATRIE 2019 ; 17(6) : 10-13