Les mucolytiques sont inclus dans plusieurs directives en tant qu’option de traitement pour les patients souffrant d’exacerbations fréquentes. Selon le GOLD, ils peuvent réduire les exacerbations et améliorer légèrement l’état de santé. Cependant, les preuves manquent actuellement. Des chercheurs se sont penchés sur la question dans un article de synthèse et ont tenté de déterminer l’effet réel de cette classe de médicaments.
Il n’existe pas de consensus international sur la place des mucolytiques dans le traitement de la BPCO. Les directives de l’American Thoracic Society et de l’European Respiratory Society (ATS / ERS) sur la prévention des exacerbations stipulent que “pour les patients atteints de BPCO présentant une obstruction modérée ou sévère du flux d’air et des exacerbations malgré un traitement par inhalation optimal, nous recommandons un traitement par mucolytique oral afin de prévenir les futures exacerbations”. Toutefois, il ne s’agit que d’une recommandation conditionnelle, basée sur des preuves de faible qualité. Des chercheurs dirigés par le Dr Phillippa Poole du Département de médecine de l’Université d’Auckland, en Nouvelle-Zélande, ont évalué dans une revue Cochrane 38 études randomisées et contrôlées par placebo portant sur un total de 10 377 patients adultes souffrant soit de BPCO, soit de bronchite chronique (15 études ont examiné l’utilisation de mucolytiques uniquement chez les personnes atteintes de BPCO, les autres chez celles atteintes de bronchite chronique, de BPCO ou des deux) [1]. Cette étude se fonde sur un travail de synthèse antérieur, également réalisé par Poole en 2015.
Toutes les études, sauf quatre, ont été décrites comme étant en double aveugle. L’âge moyen des participants se situait entre 40 et 71 ans. Le pourcentage de fumeurs actuels ou anciens se situait entre 55% et 100%. Les études considérées ont duré entre deux mois et trois ans et ont utilisé divers agents expectorants, notamment la N-acétylcystéine (NAC), la carbocystéine et l’erdostéine. Les expectorants ont été pris par voie orale jusqu’à trois fois par jour. L’utilisation de mucolytiques par inhalation n’a pas été prise en compte. Les objectifs des études étaient des critères d’évaluation tels que les poussées de la maladie, les hospitalisations, la qualité de vie, la fonction pulmonaire et les effets secondaires. Les études sur les patients souffrant d’asthme ou de mucoviscidose étaient exclues, de même que celles sur les mucolytiques inhalés et les combinaisons de mucolytiques avec des antibiotiques et avec des bronchodilatateurs, ainsi que les études sur la désoxyribonucléase ou les protéases.
Réduction des effets dans les études récentes
Les mucolytiques augmentent l’expectoration des crachats en modifiant les propriétés physiques des sécrétions, par exemple en dégradant les polymères de mucine, la fibrine ou l’ADN dans les sécrétions respiratoires, ce qui les rend moins visqueuses. La réduction de la viscosité permet à l’organisme de tousser plus facilement et de réduire le risque de contamination bactérienne. Les mucolytiques classiques tels que la N-acétylcystéine exercent leur action en dépolymérisant les glycoprotéines de la mucine via une réaction d’hydrolyse. Une étude a montré que la NAC pouvait améliorer la fonction pulmonaire, mais il n’était pas certain que cela soit dû à sa capacité antioxydante ou à d’autres facteurs. Compte tenu du fait que le stress oxydatif est un mécanisme aggravant dans la BPCO, cette propriété de la N-acétylcystéine peut être utile dans les maladies respiratoires chroniques. Les expectorants sont administrés en association avec d’autres traitements de la BPCO, tels que les bêta-agonistes à longue durée d’action (LABA) inhalés et les antagonistes muscariniques à longue durée d’action (LAMA), et non à leur place.
La tendance selon laquelle les participants auxquels des mucolytiques ont été administrés sont plus susceptibles d’être exempts d’exacerbation a été observée dans presque toutes les études. Cependant, l’hétérogénéité était élevée (I²=62%), c’est pourquoi Poole et al. ont effectué une analyse post-hoc en sous-groupe montrant les résultats d’études en double aveugle, classés par année de publication et divisés par décennie de publication. Ici, il est remarquable de constater que les études récentes ont tendance à fournir des résultats plus conservateurs : les études publiées avant 1990 (Peto OR 2,34 ; IC à 95% 1,97-2,79) et entre 1990 et 1999 (Peto OR 1,91 ; IC à 95% 1,50-2,44) ont une taille d’effet plus importante que celles publiées entre 2000 et 2009 (Peto OR 1,24 ; IC à 95% 1,01-1,54) ou depuis 2010 (Peto OR 1,28 ; IC à 95% 1,03-1,59). (Tab. 1). Il convient également de noter que sur les six études dont l’attribution a été raisonnablement masquée, une seule a rapporté un bénéfice tangible du traitement en termes de prévention des exacerbations.
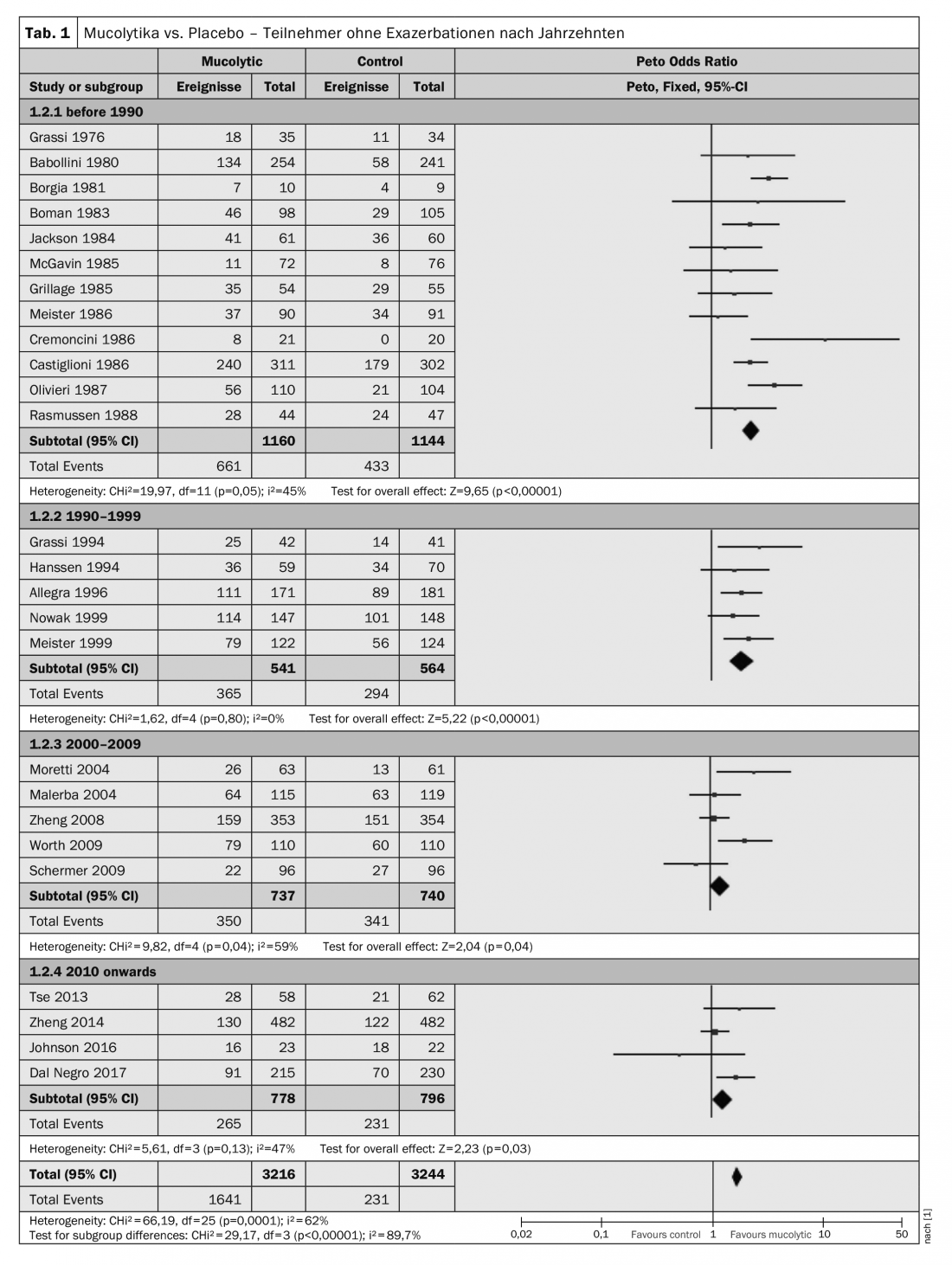
Deux facteurs pourraient, selon Poole et al. L’amélioration de la conception, de la mise en œuvre et du reporting des études au fil des années est l’un des facteurs qui ont contribué à ce résultat. Des définitions plus strictes de la bronchopneumopathie chronique obstructive ont également été utilisées dans des études récentes. La prise en charge de la BPCO inclut désormais l’aide au sevrage tabagique, la vaccination, la réhabilitation pulmonaire et l’utilisation de corticostéroïdes inhalés (CSI), de LABA et d’anticholinergiques, qui peuvent avoir un impact sur la fréquence des exacerbations ou la sévérité.
Aucune différence clinique en termes de qualité de vie
Bien que des évaluations globales du bien-être aient souvent été rapportées par les participants et/ou les médecins, seules dix études ont utilisé des instruments validés pour évaluer la qualité de vie liée à la santé (HRQoL) chez les participants atteints de BPCO. George’s Respiratory Questionnaire (SGRQ) a été utilisé dans neuf d’entre eux. Le score total du SGRQ est dérivé des scores obtenus dans trois sous-échelles – symptômes, activités et impact – pour obtenir un score sur 100. Des valeurs plus faibles indiquent une meilleure qualité de vie.
Bien que le résultat groupé favorisait les mucolytiques par rapport au placebo, l’intervalle de confiance ne contenait aucune différence (MD -1,37 ; IC à 95% -2,85-0,11 ; n=2721). Une hétérogénéité considérable entre les études était évidente (I²=64%). Cet effet ne répond pas à la différence minimale cliniquement importante de 4 unités dans le SGRQ, mais on ne peut pas évaluer les effets des mucolytiques au niveau de la population sans effectuer une analyse des répondeurs, expliquent les auteurs. Cela n’était pas possible auparavant.
Renforcement des résultats antérieurs
Pour les chercheurs, les résultats de leur examen renforcent les études antérieures qui indiquent que les participants auxquels un mucolytique a été administré pendant neuf mois en moyenne sont plus susceptibles de ne pas avoir d’exacerbation pendant cette période. Les mucolytiques peuvent être associés à une réduction de la déficience d’environ une demi-journée par participant et par mois.
L’ajout d’études récentes augmente la certitude que les mucolytiques n’ont pas d’impact significatif sur le déclin de la fonction pulmonaire ou sur la mortalité. Toutefois, Poole et ses collègues soulignent que certains résultats ne peuvent être interprétés qu’avec une prudence particulière en raison de leur hétérogénéité.
Les analyses présentées dans leur revue suggèrent que les mucolytiques peuvent en outre avoir une influence sur la durée et la gravité des exacerbations qui surviennent, ainsi que sur la probabilité de prendre des antibiotiques. Les données de quatre études suggèrent que les mucolytiques sont associés à des taux d’hospitalisation réduits. Il serait utile, selon les auteurs, que de futures études examinent ce résultat, car c’est là que se situent la plupart des coûts liés aux maladies plus graves. Peu d’autres traitements pharmacologiques réduisent l’hospitalisation dans la mesure.
Littérature :
- Poole P, Sathananthan K, Fortescue R : Cochrane Database of Systematic Reviews 2019 ; 5 ; doi : 10.1002/14651858.CD001287.pub6
InFo PNEUMOLOGIE & ALLERGOLOGIE 2020 ; 2(2) : 21-23