En cas de suspicion d’artérite à cellules géantes, il convient de procéder immédiatement à un examen plus approfondi et à un traitement. Les symptômes typiques tels que les maux de tête ou les douleurs à la mâchoire et les troubles de la vision peuvent être absents. Le RZA oligosymptomatique peut être diagnostiqué par imagerie. La biopsie de l’artère temporale est l’étalon-or du diagnostic. Le tocilizumab (Actemra), un antagoniste des récepteurs de l’IL-6, est très efficace dans le traitement des patients réfractaires aux stéroïdes et sera utilisé plus fréquemment à l’avenir – et vraisemblablement en traitement de première intention.
Historiquement, nous entendons par artérite à cellules géantes (ACG) la maladie de Horton ou artérite temporale, c’est-à-dire une inflammation auto-immune de l’artère temporale. Des symptômes crâniens peuvent apparaître, tels que des maux de tête et des douleurs à la mâchoire, des troubles de la vision comme la neuropathie optique ischémique antérieure (AION) ou encore un accident vasculaire cérébral, accompagné d’une réaction inflammatoire systémique. Cela correspond également aux critères de classification de la Société américaine de rhumatologie (ACR) établis il y a plus de 25 ans pour la RZA : âge >50 ans, céphalées d’apparition récente, BSG >40 mm/1h, artère temporale anormale (absence de pouls, artère durcie) et mise en évidence d’une inflammation transmurale dans la biopsie de l’artère temporale. Il convient de noter que ces critères sont destinés à la classification des patients à des fins d’étude et non à des fins de diagnostic.

Le cas 1 est un patient typique. En outre, ces patients peuvent présenter d’autres symptômes ischémiques tels que des douleurs à la mastication, une sensibilité du cuir chevelu, des troubles visuels (vision brumeuse, vision double). Une polymyalgie rhumatismale (PMR) concomitante et/ou des symptômes généraux sont possibles.
Cependant, avec le développement et la disponibilité plus large de méthodes de diagnostic telles que l’échographie, l’IRM et le PET-CT, nous enregistrons de plus en plus de patients présentant une vascularite des gros vaisseaux sans implication de l’artère temporale et sans symptômes crâniens. Le spectre des maladies diagnostiquées s’élargit donc. Comme illustré dans le cas 2, la présentation clinique peut varier considérablement. En particulier, les critères ACR mentionnés sont insuffisamment ou pas du tout remplis par nombre de ces patients.
Examen de l’artérite temporale “classique
Si un patient se présente à votre cabinet comme le cas 1, le diagnostic de RZA est évident. Un traitement rapide avec de fortes doses de cortisone pour prévenir une perte de vision irréversible ou un accident vasculaire cérébral est critique dans cette situation. Si le patient y répond rapidement et bien, on est souvent tenté de renoncer à d’autres diagnostics. Bien que cela puisse être possible sans problème dans certains cas, il est recommandé de chercher à établir un diagnostic définitif pour plusieurs raisons.
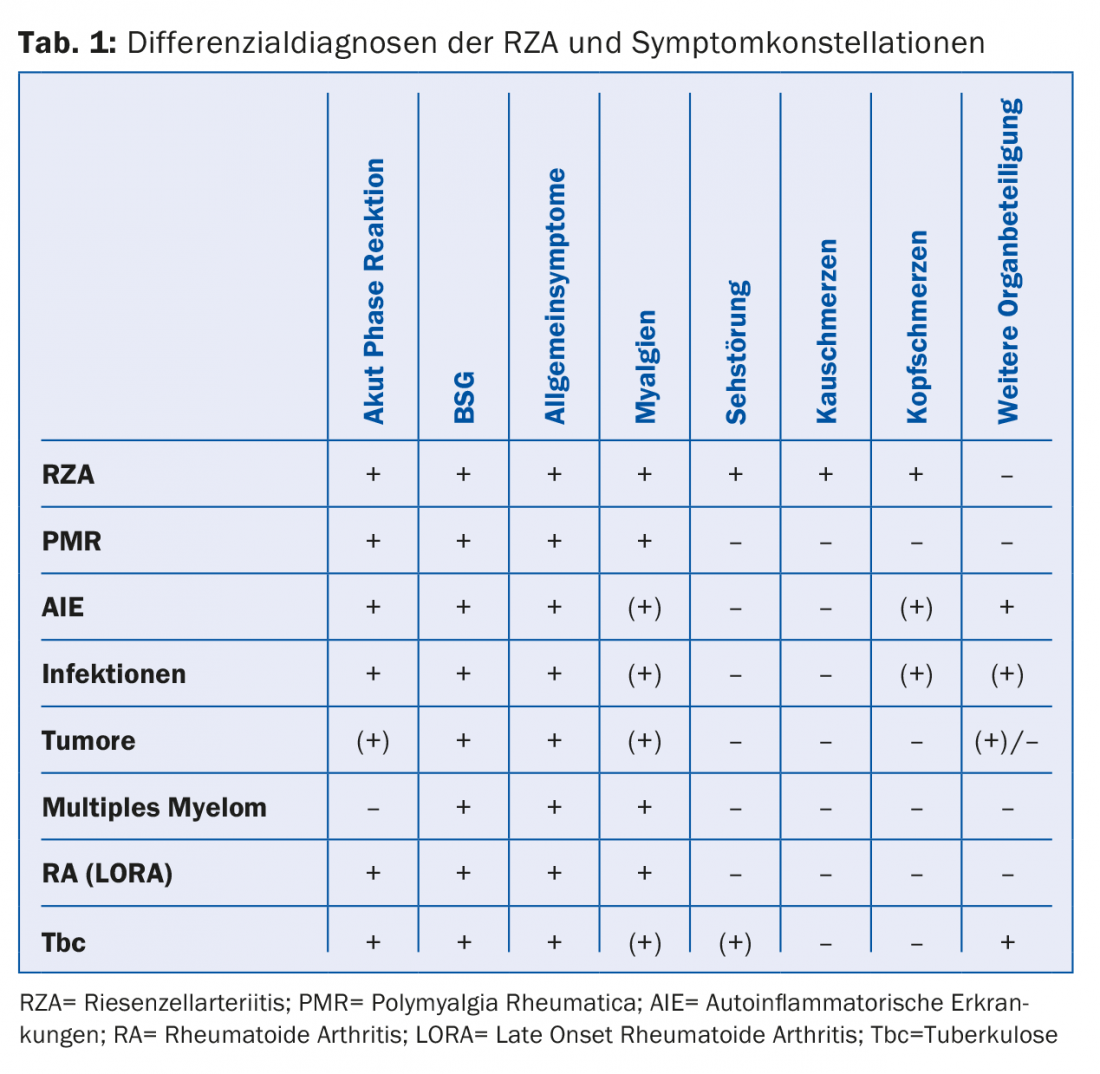
Spécificité insuffisante de nombreux symptômes de RZA : L’exemple volontiers cité du patient grippé de 70 ans montre que des myalgies, des céphalées et/ou une réaction inflammatoire ne constituent pas une vascularite. De même, l’excellente réponse des symptômes à un traitement à la cortisone est suggestive, mais pas spécifique d’une RZA. La PMR, qui partage de nombreux symptômes avec la RZA, ou d’autres maladies inflammatoires systémiques, répondent également à des doses plus élevées de prednisone. Les incertitudes quant au diagnostic définitif ou à la marche à suivre ne sont alors pas rares. Souvent, le diagnostic est malheureusement infructueux à ce stade, car les patients sont déjà sous traitement de prednisone depuis longtemps, ce qui rend l’interprétation des examens difficile, voire impossible.
D’autre part, nous devons éviter les traitements inutilement longs et intensifs à la cortisone. En fin de compte, l’exclusion des diagnostics différentiels possibles (tab. 1) peut être coûteuse et ne pas être justifiée dans tous les cas.
En raison de la nécessité de commencer rapidement le traitement en cas de symptômes crâniens, le reste du diagnostic devrait également être effectué idéalement dans les 24 heures, car la sensibilité des méthodes de test diminue considérablement après quelques jours de traitement. Dans les hôpitaux centraux, des cliniques dites “fast-track” s’établissent de plus en plus, auxquelles les prestataires de soins primaires peuvent envoyer les patients en urgence pour un diagnostic rapide en cas de suspicion.
Échographie : une échographie de l’artère temporale est souvent réalisée. Celle-ci a une très bonne sensibilité (88%) et spécificité (97%) pour le diagnostic d’artérite des artères temporales [1]. De plus, les carotides et les artères axillaires peuvent être visualisées au cours de la même séance, ce qui augmente la sensibilité. La détection positive d’une vascularite par échographie Doppler repose généralement sur la mise en évidence d’un épaississement hypoéchogène de la paroi vasculaire, par opposition aux modifications focales hyperéchogènes observées dans l’athérosclérose. (Fig. 1A, B). Les nouveaux développements techniques des appareils de TEP, de scanner et d’IRM permettent désormais de visualiser les artères temporales, ce qui peut constituer un outil de diagnostic supplémentaire.
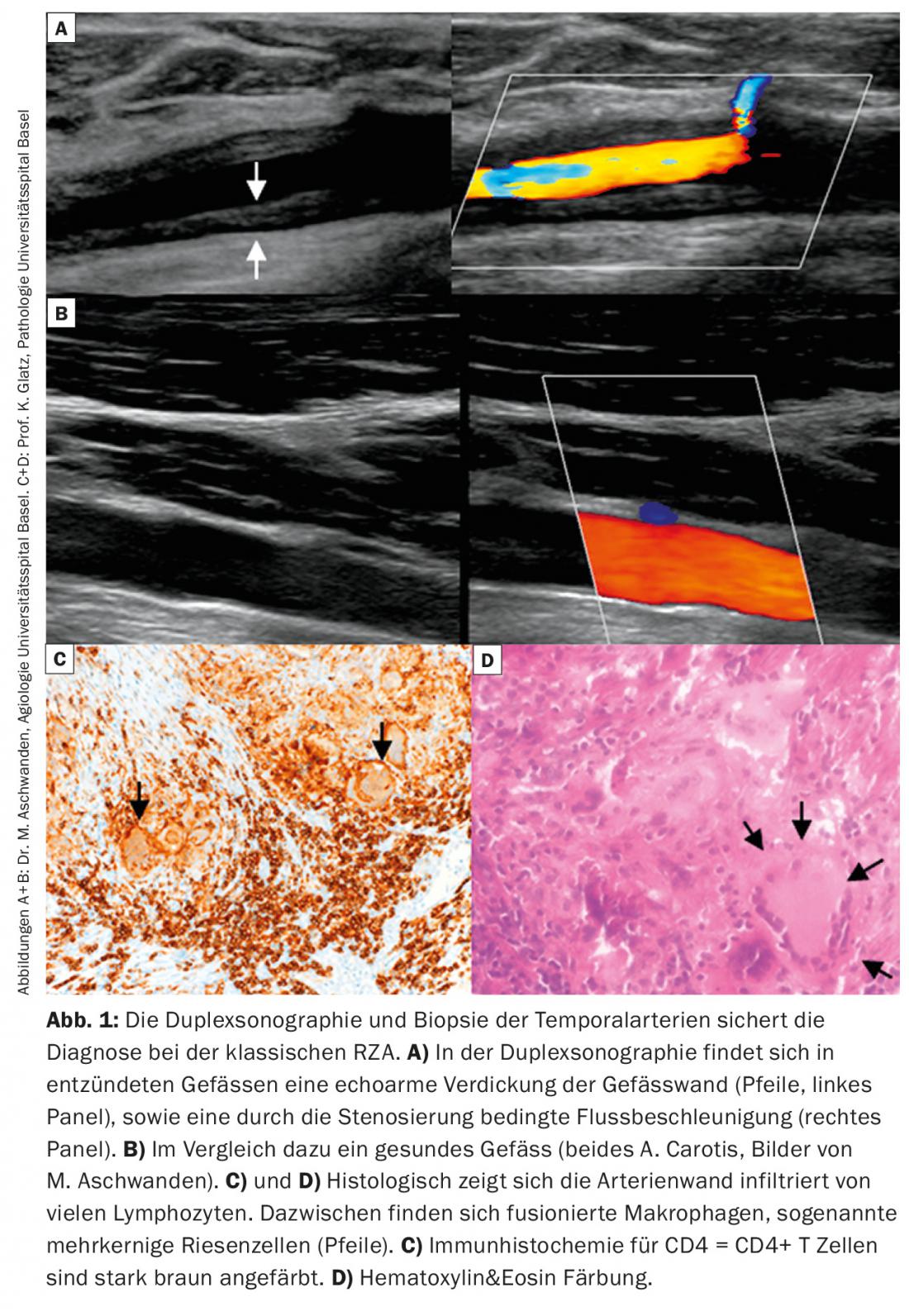
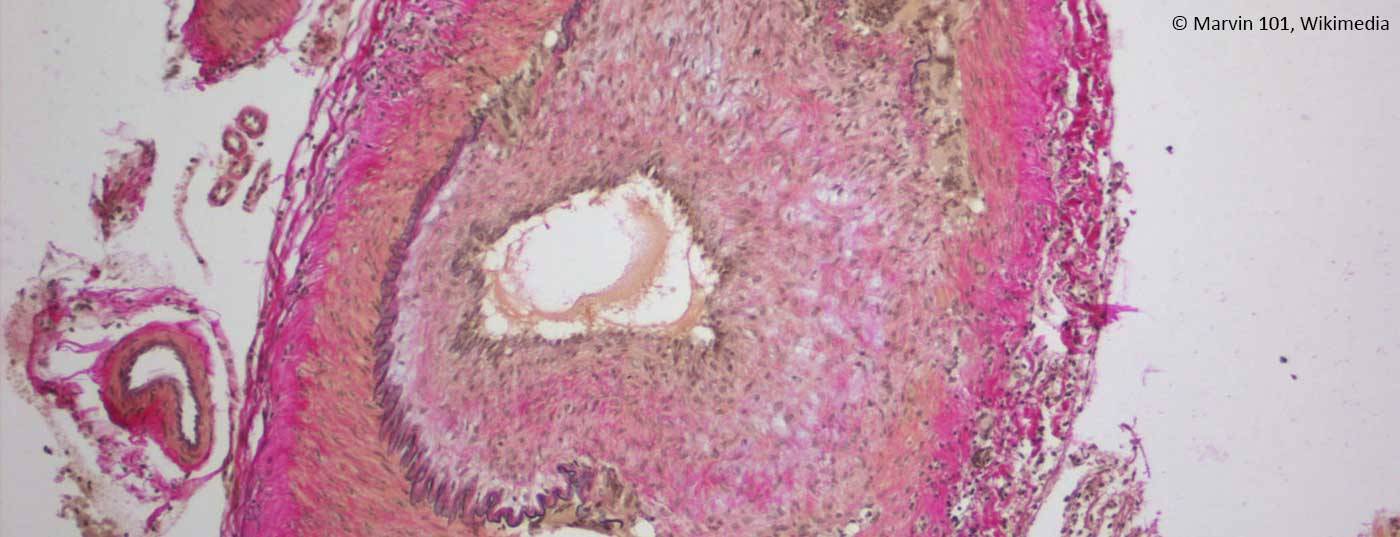
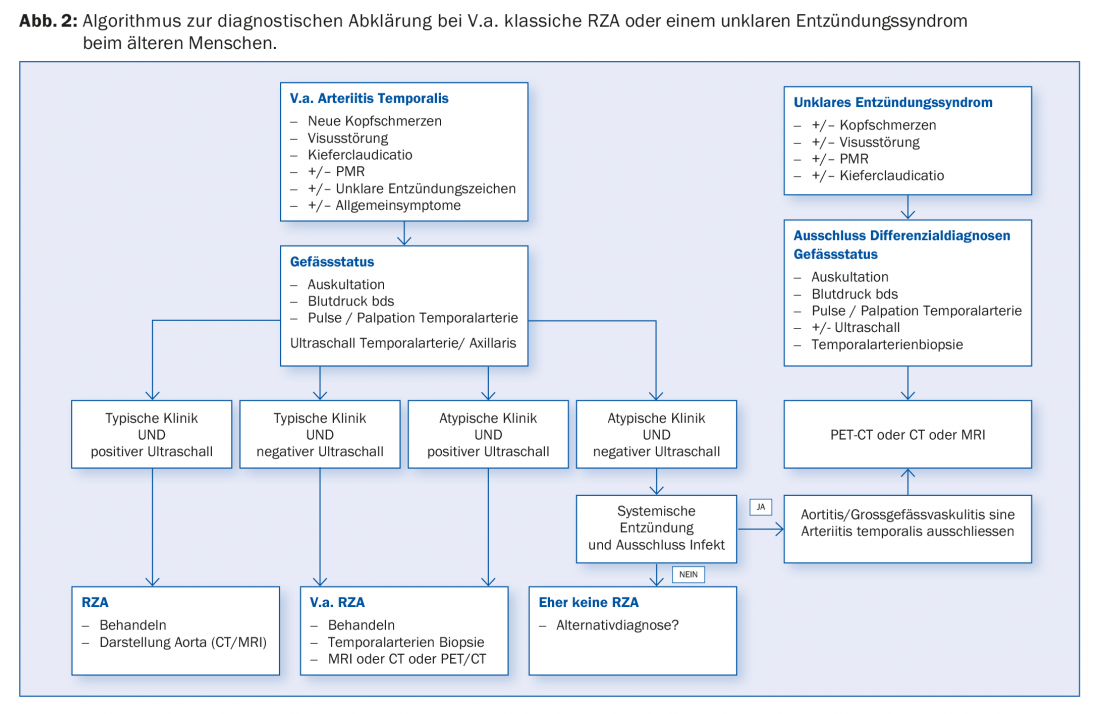
Confirmation positive du diagnostic : la confirmation positive du diagnostic par histologie fournit la preuve de la présence d’un RZA. Celle-ci montre une infiltration de lymphocytes et de macrophages qui parcourent toute la paroi vasculaire (Fig. 1C). La présence de cellules géantes, des macrophages multinucléés fusionnés, est pathognomonique (fig. 1D). Ces cellules sont cependant absentes chez près de la moitié des patients. D’autres signes peuvent être un épaississement de l’intima avec rétrécissement de la lumière vasculaire, une fragmentation de la lamina elastica interna ou une inflammation dans l’adventice. Ces derniers résultats ne sont toutefois en faveur d’une RZA que si un infiltrat inflammatoire est également mis en évidence. Lorsqu’elles se produisent sans inflammation, elles peuvent également être dégénératives en raison de l’âge. Il convient également de noter qu’après 7 à 14 jours de traitement par la prednisone, l’infiltrat inflammatoire disparaît, ce qui entraîne une biopsie “faussement négative”. Il convient de noter qu’une biopsie négative avec une clinique typique n’exclut jamais le diagnostic, car la biopsie peut être négative chez jusqu’à 40% des patients. Comme il s’agit toujours d’une intervention invasive (bien que mineure), on s’efforce d’établir d’autres algorithmes de diagnostic qui rendent la biopsie superflue dans certains scénarios cliniques (Fig. 2).
Le RZA oligosymptomatique – un diagnostic différentiel important
De plus en plus souvent, le diagnostic de RZA est posé chez des patients présentant une inflammation systémique au premier plan, souvent après de longues investigations. L’imagerie est alors souvent déterminante pour le diagnostic de ces patients. Une imagerie réalisée à la recherche d’une tumeur/d’une infection ou même intentionnellement à la recherche d’une ACR révèle alors des modifications correspondantes de l’aorte et de ses branches, qui permettent de suspecter le diagnostic (Fig. 2).
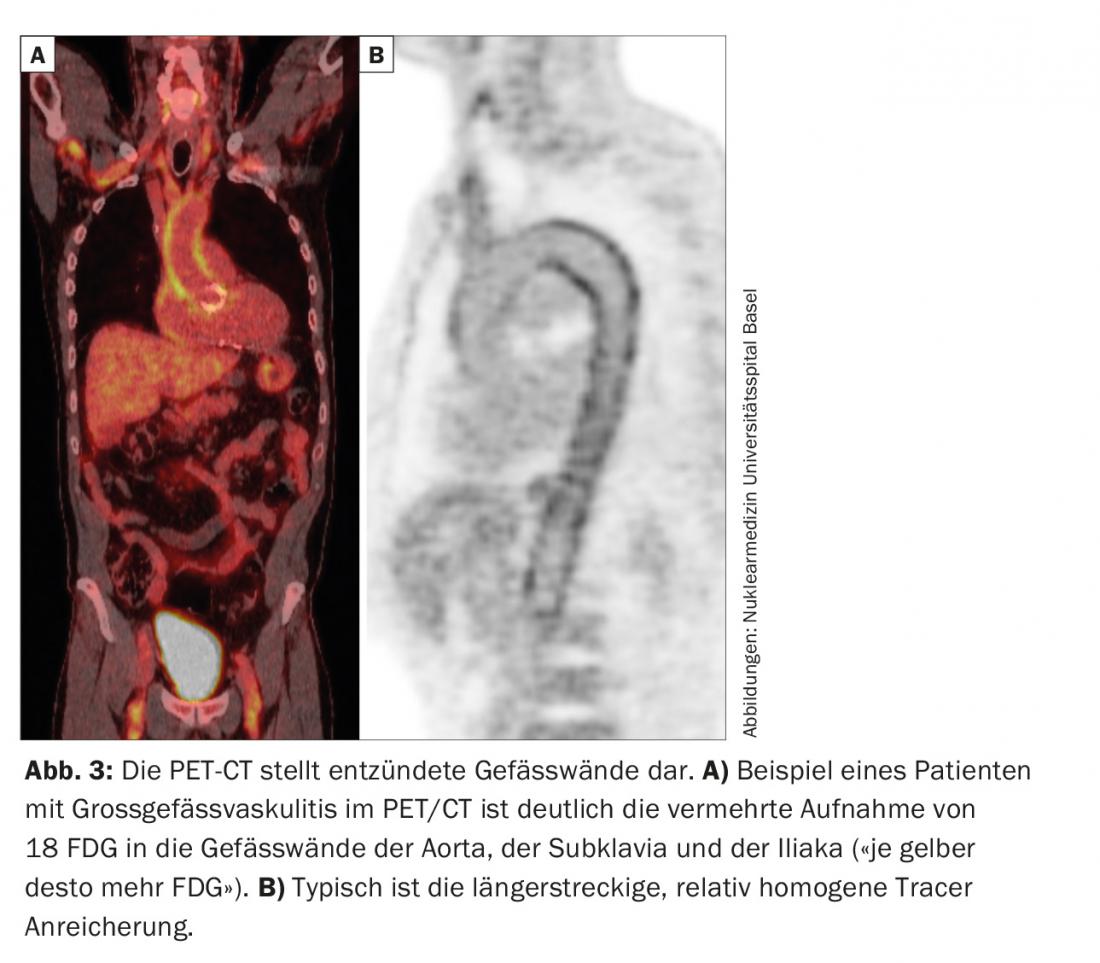
Il faut penser au RZA chez les patients âgés, avec une inflammation systémique et l’absence de signes évidents d’infection ou de malignité [2]. Même si ces derniers ne se plaignent pas de maux de tête, de perte d’acuité visuelle ou de douleurs à la mastication (voir l’exemple de cas 2). Là encore, une biopsie de l’artère temporale peut être réalisée. Dans le cas positif, le diagnostic est confirmé, dans le cas négatif, il n’est pas exclu, car en l’absence de “symptomatologie crânienne”, les artères temporales ne sont pas nécessairement enflammées. C’est pourquoi on parle aussi de vascularite des gros vaisseaux. Différentes techniques d’imagerie (IRM, TEP, scanner) sont capables de visualiser l’inflammation de la paroi vasculaire. Ils peuvent se présenter sous la forme d’un épaississement de la paroi (échographie), avec par exemple une prise de contraste au scanner. Le PET représente – via un traceur de médecine nucléaire – l’absorption du glucose dans les tissus. L’inflammation a besoin de plus de glucose, c’est pourquoi une paroi vasculaire enflammée s’allume sur le PET (Fig. 3). Comme la représentation est basée sur l’activité métabolique, l’examen TEP est probablement proche d’une véritable détermination de l’activité. Ceci contrairement au scanner, à l’IRM et à l’échographie, où les changements chroniques post-inflammatoires sont parfois difficiles à distinguer de l’inflammation active.
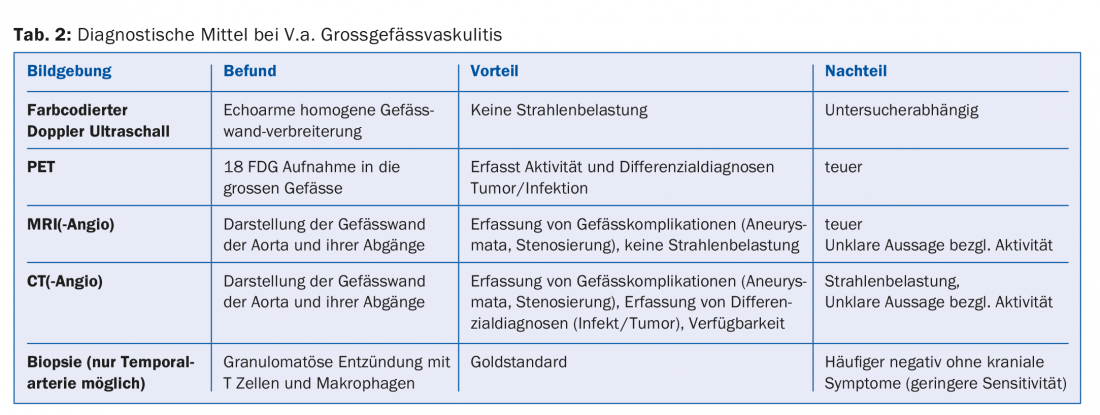
L’un des avantages de l’imagerie des gros vaisseaux est qu’elle permet de visualiser simultanément d’éventuelles complications vasculaires préexistantes, telles que des sténoses ou des anévrismes. Comme le RZA est associé à un risque nettement accru de telles complications vasculaires, il est généralement recommandé de procéder à une imagerie initiale des gros vaisseaux chez tous les patients atteints de RZA (tab. 2). Là encore, un traitement est indispensable, car ces patients peuvent tout à fait développer des complications ischémiques ou anévrismales/sténotiques au cours de l’évolution. Une proposition d’étapes d’évaluation diagnostique en cas d’artérite à cellules géantes est présentée dans la figure 2.
Traitement à la prednisone à haute dose et de longue durée
Les stéroïdes sont toujours la base du traitement. La dose habituellement utilisée est de 1 mg/kg PC, un maximum de 60 mg/jour étant recommandé [1]. Les exceptions sont les événements ischémiques graves. Il s’agit notamment de troubles de la vision/cécité ou d’un accident vasculaire cérébral. Dans ce cas, des doses plus élevées sont utilisées initialement sous la forme d’une thérapie de choc afin d’éviter de nouvelles ischémies.
La dose de stéroïdes doit être réduite au fil du temps, l’objectif étant d’atteindre 5 mg vers 6 mois [1]. Pendant cette phase, la clinique et les paramètres inflammatoires doivent être régulièrement contrôlés. En cas d’indication de récidive, la dose doit être ajustée en conséquence. Plus de la moitié des patients présentent une ou plusieurs rechutes [3]. C’est pourquoi un traitement de préservation des stéroïdes est généralement suivi à titre préventif. Il existe peu de données concernant la meilleure durée et la meilleure dose de ce traitement. En particulier, il n’existe pas à ce jour de facteurs prédictifs permettant d’identifier les patients présentant un risque plus élevé de rechute. Le plus souvent, le traitement se fait avec 5(-7,5) mg de prednisone pendant une année supplémentaire à 18 mois maximum [1,4].
Le revers de la médaille du contrôle de la maladie, ce sont les effets secondaires des stéroïdes. Ceux-ci sont extrêmement fréquents en raison de l’âge et des comorbidités, de sorte que presque tous les patients développent au moins un problème. Parmi eux, les plus fréquents sont la cataracte, les fractures et les infections (31%). De plus, une hypertension (22%) ou un diabète sucré (9%) sont souvent présents [5].
Outre le traitement immunosuppresseur et le contrôle des effets secondaires, plusieurs autres mesures prophylactiques sont recommandées [1]. Il est probable que les patients présentent moins d’événements ischémiques sous acide acétylsalicylique (ASA), raison pour laquelle l’EULAR recommande un traitement ASA à faible dose (75-150 mg/jour). En cas d’association ASA et cortisone, un inhibiteur de la pompe à protons doit être prescrit. En outre, tous les patients doivent recevoir une prophylaxie de l’ostéoporose et, le cas échéant, un traitement. En conséquence, nous effectuons systématiquement une évaluation des risques et une ostéodensitométrie au début du traitement.
Evolution réfractaire et traitement des récidives
Une récidive est souvent suivie d’une deuxième. Des augmentations répétées de la cortisone conduisent alors à des doses cumulatives élevées qui potentialisent les effets secondaires et peuvent compromettre le système immunitaire à long terme.
Dans une méta-analyse d’essais randomisés, seul le métotrexate s’est jusqu’à présent révélé être un médicament à faible épargne stéroïdienne. Parmi les traitements alternatifs, le tocilizumab (antagoniste des récepteurs IL6 Actemra®) s’est imposé au cours des dernières années. Des améliorations étonnantes et rapides ont été constatées chez des patients réfractaires [6]. L’IL-6 étant également le principal stimulus de la production de protéines de phase aiguë dans le foie, le blocage de l’IL-6 entraîne une normalisation rapide de la CRP et de la BSG.
Le blocage de l’IL6 marque-t-il le début d’une nouvelle ère ?
Il existe désormais des données sur l’utilisation du tocilizumab en traitement de première intention. Une étude randomisée contrôlée menée à l’hôpital universitaire de Berne a montré que les patients ayant reçu du tocilizumab en première intention n’ont pratiquement pas eu de récidives malgré une réduction relativement rapide du traitement à la prednisone, avec un effet d’épargne stéroïdienne significatif [7]. Les données d’une étude réglementaire internationale sur le traitement initial par tocilizumab (GiACTA) aboutissent à la même conclusion, bien que les données définitives ne soient pas attendues avant fin 2016. Il est probable que cela conduise à une utilisation plus fréquente et plus précoce du tocilizumab chez les patients atteints de RZA.
Il convient de noter que la CRP est supprimée sous tocilizumab, ce qui peut masquer des infections. Ainsi, chez ces patients, une évaluation et un traitement précoces sont indispensables en cas d’infection présumée. Les autres effets secondaires incluent, outre les augmentations des transaminases et des lipides, une neutropénie et une thrombocytopénie rares mais potentiellement dangereuses. Les perforations intestinales ont été observées plus fréquemment chez les patients atteints de diverticulite lors des études réglementaires initiales.
Littérature :
- Mukhtyar C, et al : Recommandations de l’EULAR pour la prise en charge de la vascularite des gros vaisseaux. Ann Rheum Dis 2009 ; 68(3) : 318-23.
- Muto G, et al : Large vessel vasculitis in elderly patients : early diagnosis and steroid-response evaluation with FDG-PET/CT and contrast-enhanced CT. Rheumatology International. 2014 ; 34(11):1545-54.
- Alba MA, et al : Relapses in patients with giant cell arteriitis : prevalence, characteristics, and associated clinical findings in a longitudinally followed cohort of 106 patients. Medicine (Baltimore) 2014 ; 93(5) : 194-201.
- Weyand CM, et al. : Pratique clinique. Artérite à cellules géantes et polymyalgia rheumatica. N Engl J Med 2014 ; 371(1) : 50-7.
- Proven A, et al : Glucocorticoid therapy in giant cell arteritis : duration and adverse outcomes. Arthritis Rheum 2003 ; 49(5) : 703-8.
- Osman M, et al : Le rôle des agents biologiques dans la prise en charge de la vascularite des gros vaisseaux (VGV) : une revue systématique et une méta-analyse. PLoS One 2014;9(12):e115026.
- Villiger PM, et al : Tocilizumab for induction and maintenance of remission in giant cell arteritis : a phase 2, randomised, double-blind, placebo-controlled trial. Lancet 2016 ; 387(10031) : 1921-7.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(9) : 22-26