Le cancer de l’ovaire n’est généralement diagnostiqué qu’à un stade avancé et son pronostic est défavorable. La chirurgie cytoréductrice la plus large possible est la première priorité thérapeutique et pronostique, suivie d’une chimiothérapie à base de platine. Dans les stades III-IV sans réopération planifiée, l’ajout de bevacizumab à la première chimiothérapie et en traitement d’entretien est autorisé depuis quelques mois. Il en va de même pour le traitement des récidives sensibles au platine. La dernière indication en date est le bevacizumab dans les cancers de l’ovaire résistants au platine après un maximum de deux traitements antérieurs par monochimiothérapie. Les femmes atteintes d’un cancer de l’ovaire génétiquement induit sont traitées de la même manière que les patientes atteintes de tumeurs sporadiques, mais ont désormais la possibilité de suivre un traitement d’entretien par olaparib en cas de récidive.
Le cancer de l’ovaire est le deuxième cancer le plus fréquent dans le domaine de l’oncologie gynécologique et, parmi ces cancers, c’est celui qui entraîne le plus de décès. En Suisse, il touche environ 600 femmes par an (3% de tous les cancers). L’âge moyen au moment du diagnostic est de 63 ans, 14% des femmes ont moins de 50 ans. 90% des cancers de l’ovaire sont des tumeurs d’origine épithéliale, les autres sont des tumeurs des cellules germinales, du stroma ou des tumeurs sarcomateuses ou des cancers de l’ovaire. les néoplasies à petites cellules. L’OMS divise les carcinomes épithéliaux en six classes histologiques. Les carcinomes séreux sont les plus fréquents (environ 80%), ils peuvent être peu ou très agressifs.
Diagnostic et facteurs de risque
Les symptômes qui précèdent souvent le diagnostic depuis longtemps ne sont pas spécifiques : douleurs abdominales, tensions abdominales, troubles mictionnels et, au cours de l’évolution, augmentation du volume de l’abdomen ou troubles du cycle menstruel. Les facteurs de risque sont le nombre d’ovulations (plus il y a d’ovulations, plus le risque est élevé), l’endométriose, les ovaires polykystiques et un gène BRCA 1 ou 2. En revanche, l’accouchement, l’allaitement, la contraception orale, la ligature des trompes et l’hystérectomie réduisent le risque.
Le diagnostic est généralement posé à un stade avancé (FIGO III et IV), ce qui signifie qu’environ 15% seulement des cancers de l’ovaire sont limités à un seul ovaire. Les facteurs pronostiques sont le stade, l’histologie et une opération aussi complète que possible. Le pronostic des cancers de l’ovaire en tant que groupe reste malheureusement mauvais : seuls environ 40% des patientes au stade FIGO III (métastases en dehors du petit bassin mais intra-abdominales) et seulement environ 19% au stade FIGO IV (métastases à distance) survivent cinq ans, ces données datant d’avant les possibilités thérapeutiques modernes (bevacizumab +/- traitement d’entretien, olaparib, HIPEC).
Évaluation et traitement chirurgical
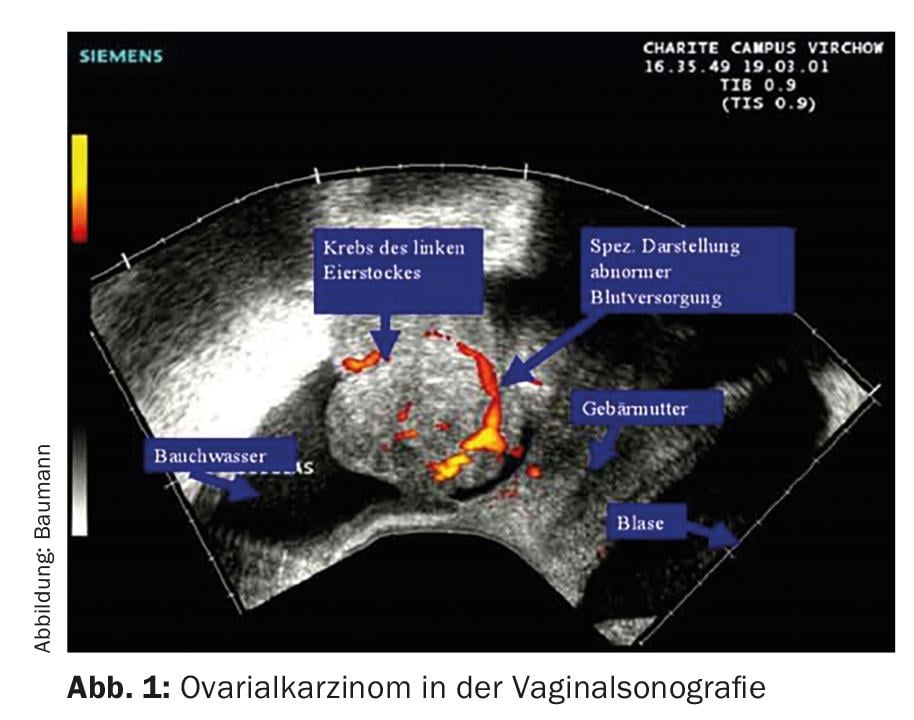
Sans staging chirurgical ou opération, l’étendue exacte de la maladie ne peut pas être déterminée de manière fiable. La plupart du temps, les femmes s’adressent d’abord à leur gynécologue, qui effectue une échographie vaginale pour obtenir un diagnostic (Fig. 1) .
Si un carcinome est suspecté, il est suivi d’un scanner ou d’un PET-CT (Fig. 2). Le dosage du marqueur tumoral Ca 125 peut également s’avérer utile.
L’opération comprend une hystérectomie, une annexectomie bilatérale, une lymphadénectomie rétropéritonéale et, selon l’étendue de la tumeur, une omentectomie infracolique et infragastrique, ainsi que de multiples biopsies péritonéales ciblées. L’expérience du chirurgien (nombre d’interventions réalisées chaque année) est importante, car le pronostic est influencé par le résultat chirurgical obtenu (débullage optimal). Dans la mesure du possible, toutes les tumeurs visibles macroscopiquement doivent être enlevées, ce qui signifie que l’opération nécessite des gynécologues expérimentés et, dans certaines circonstances, des chirurgiens viscéraux capables de pratiquer des interventions abdominales parfois plus importantes, telles que l’ablation partielle de l’intestin, la péritonectomie, etc. Le traitement du cancer de l’ovaire avancé doit faire l’objet d’une discussion interdisciplinaire préopératoire et les interventions ou les traitements possibles doivent être définis. dont les conséquences/morbidités doivent être discutées au préalable avec les patientes. La stadification post-opératoire se fait selon la classification FIGO ou TNM [1].
Traitement des stades précoces (FIGO I-IIA)
En ce qui concerne le traitement des stades précoces, rien n’a changé au cours des dernières années. Les patientes à ces stades (environ 20%) ont un meilleur pronostic (survie à 5 ans de 60 à 90%). Des facteurs tels que le grade, la rupture de la capsule, l’atteinte unilatérale ou bilatérale et éventuellement l’âge de la patiente sont importants pour décider si un traitement adjuvant doit être mis en place. Aucune chimiothérapie n’est recommandée aux patientes de stade FIGO IA, G1. Au stade IB, les facteurs supplémentaires et un staging chirurgical optimal sont importants, et là aussi, la chimiothérapie peut souvent être supprimée.
Toutes les autres patientes à un stade précoce (tous les stades FIGO II et/ou tous les gradings histologiques supérieurs à 1) bénéficient d’une chimiothérapie adjuvante à base de platine. Je n’entrerai pas ici dans le débat de savoir si le carboplatine seul suffit (six cycles) ou si l’association carboplatine/paclitaxel est préférable (trois cycles peuvent éventuellement suffire, mais la plupart du temps, six cycles sont administrés) [2,3].
Traitement des stades avancés (FIGO IIB-IV)
Dans les stades avancés, une opération aussi complète que possible est particulièrement importante. Les patientes chez qui aucune tumeur n’est plus visible macroscopiquement ont le meilleur pronostic. Si une tumeur doit être laissée en place, les femmes dont les résidus tumoraux mesurent moins de 1 cm ont plus de chances que celles dont les résidus tumoraux mesurent plus de 1 cm. Pour les patientes ayant subi une opération primaire non optimale (par exemple, pas d’équipe interdisciplinaire – bien que nécessaire), il peut être utile de procéder à ce que l’on appelle un débullage d’intervalle. Dans ce cadre, trois cycles de chimiothérapie standard à base de carboplatine et de paclitaxel sont d’abord effectués, suivis, en cas de réponse, d’une deuxième opération et de trois autres cycles de chimiothérapie.
Toutes les patientes présentant des stades avancés sont jusqu’à présent traitées par six cycles de chimiothérapie combinée à base de platine (généralement avec du paclitaxel). L’ajout d’autres cytostatiques ou la réalisation de plus de six cycles n’ont pas montré de bénéfice.
En 2009, un groupe japonais a publié un travail sur le “dose-dense paclitaxel/carboplatine”, qui a montré une meilleure survie globale de 72% à trois ans, contre 65% dans le groupe de patientes sous traitement standard [4]. “Dose-dense” signifie que le paclitaxel est administré chaque semaine sans pause, tandis que le carboplatine continue à être administré toutes les trois semaines. Les effets secondaires (surtout hématologiques) ont été un peu plus fréquents dans le groupe de patients ainsi traités. Il existe toutefois des schémas d’utilisation hebdomadaire des deux substances [5].
Traitement par bevacizumab
L’ajout de bevacizumab à la chimiothérapie est une option thérapeutique récente. Le bevacizumab inhibe toutes les isoformes du récepteur du VEGF-A. Il s’agit d’un inhibiteur de l’enzyme de conversion du VEGF. Il existe désormais quatre grandes études démontrant l’efficacité de l’inhibition de l’angiogenèse dans le cancer de l’ovaire (GOG 0218 et ICON7 en première ligne, OCEANS et AURELIA pour la situation de récidive). Toutes les études ont en commun une amélioration de 3,5 à 4 mois de la survie sans progression (PFS) et du taux de réponse, mais pas de la survie globale. Les études diffèrent non seulement par leur indication et leur conception, mais aussi par la dose de bevacizumab et la durée du traitement. Dans ces études, l’inhibition de l’angiogenèse n’est pas seulement utilisée parallèlement à la chimiothérapie, mais surtout comme traitement d’entretien. Avec le bevacizumab, c’est la première fois qu’un traitement d’entretien a montré un bénéfice.
Le bevacizumab est autorisé en Suisse chez les patientes atteintes d’un cancer de l’ovaire avancé (FIGO III-IV), en association avec le carboplatine/paclitaxel en première intention, lorsqu’il n’est pas possible de procéder à une deuxième opération ou à une troisième intervention chirurgicale. un débouclage d’intervalle est prévu. Les patientes reçoivent du bevacizumab 7,5 mg/kgKG toutes les trois semaines en parallèle à six cycles de chimiothérapie ; le bevacizumab est ensuite administré en traitement d’entretien toutes les trois semaines jusqu’à la progression ou l’arrêt de la maladie. pendant 15 mois au maximum. Le spectre des effets secondaires du bevacizumab est bien connu des autres traitements anti-tumoraux : hypertension artérielle, protéinurie, rarement des thromboembolies et surtout un taux de perforation intestinale légèrement plus élevé sont à mentionner – en plus des coûts de traitement nettement plus élevés.
Chimiothérapie intrapéritonéale
Dès les années 1970, on a tenté d’augmenter les chances de survie des patientes préopérées de manière optimale en leur administrant de fortes doses de chimiothérapie locale (intrapéritonéale). Cette procédure très complexe et chronophage a été constamment améliorée au fil des ans. Une chimiothérapie intraveineuse est toujours administrée parallèlement à la chimiothérapie intrapéritonéale. Les substances utilisées dans la partie intraveineuse du traitement ont été partiellement changées et la chimiothérapie intrapéritonéale avec du cisplatine et du paclitaxel est réalisée par chauffage (chimiothérapie intrapéritonéale hyperthermique, HIPEC). La toxicité et les complications restent importantes, de sorte que ce traitement n’est pas un standard, malgré le bénéfice en termes de survie démontré dans certaines études, mais il est de plus en plus utilisé dans les grands centres [6]. Une revue de l’utilisation et des bénéfices de la chimiothérapie intrapéritonéale dans six grands centres américains a récemment été publiée [7]. Au fil du temps (2007-2012), la HIPEC a été de plus en plus utilisée, mais selon les auteurs, cette procédure est encore utilisée chez moins de 50% des patientes éligibles. La survie globale à trois ans était de 81% dans le bras HIPEC et de 71% dans le bras standard.
Traitements des récidives
Comme la plupart des patientes atteintes d’un cancer de l’ovaire avancé font une rechute, la question se pose de savoir quel est le traitement de la récidive le plus optimal possible. Pour les patientes avec un long intervalle sans traitement, en bon état général et avec une récidive qui peut être enlevée macroscopiquement in toto, une deuxième opération est une option, bien que les études ne soient pas très bonnes dans ce cas. Dans des cas exceptionnels, une HIPEC est également évaluée dans cette situation.
Il s’agit en premier lieu de déterminer si le carcinome est sensible ou résistant au platine (la rechute n’intervient qu’après six ou, mieux, douze mois). En cas de carcinome sensible, on peut à nouveau utiliser le doublet carboplatine (mieux toléré, aussi efficace que le cisplatine) et paclitaxel ou alternativement carboplatine/doxorubicine liposomale pégylée ou carboplatine/gemcitabine. Là encore, la thérapie combinée est plus efficace que la monothérapie [4]. En cas de maladie réfractaire au platine (rechute avant six mois), il convient d’utiliser des médicaments ne présentant pas de résistance croisée : gemcitabine, étoposide oral, vinorelbine ou encore docetaxel et oxaliplatine. Il existe également des données sur la trabectédine en association avec Caelyx® [8].
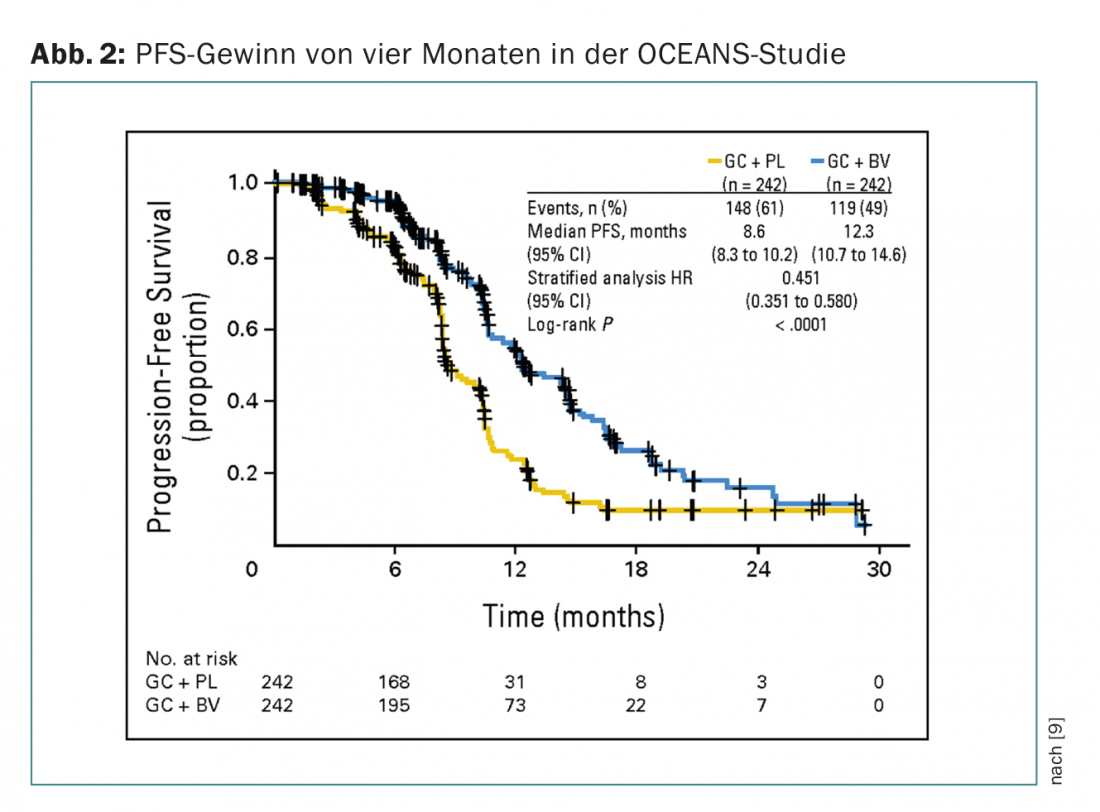
Dans les situations de récidive, l’ajout de bevacizumab (également en traitement d’entretien) a également montré un avantage en termes de PFS dans une mesure analogue. L’étude OCEANS (phase III, gain de PFS de quatre mois) a inclus des patientes atteintes d’un cancer de l’ovaire sensible au platine (figure 2) [9]. La chimiothérapie consistait en carboplatine/gemcitabine dans les deux bras. Le bevacizumab a été utilisé dans le bras expérimental à raison de 15 mg/kgKG toutes les trois semaines jusqu’à la progression. Les patientes ne devaient pas avoir reçu de traitement préalable (sauf adjuvant) et un traitement anti-VEGF préalable n’était pas autorisé. En Suisse, le bevacizumab est également autorisé dans cette situation, mais une garantie de paiement doit être obtenue (ce qui est valable pour toutes les indications du bevacizumab).
La dernière indication du bevacizumab dans le cancer de l’ovaire est le cancer résistant au platine (AURELIA) avec au maximum deux traitements antérieurs sans inhibiteurs de l’angiogenèse préalables. Le traitement est associé soit au topotécan, soit au paclitaxel, soit au Caelyx®. La posologie est de 10 mg/kgKG tous les 14 jours jusqu’à la progression de la maladie. Le gain de PFS est ici aussi de 3,5 mois, ce qui peut être considéré comme significatif dans cette situation où les patientes survivent généralement moins de 12 mois. AURELIA a en outre montré une amélioration de la qualité de vie. Il y a toutefois quelques caviars à mentionner dans cette étude, notamment le design open-label avec possibilité de cross-over.
On sait depuis longtemps que l’inhibition de l’angiogenèse joue un rôle dans le cancer de l’ovaire (y compris dans la genèse de l’ascite). Nous pouvons désormais utiliser ce principe thérapeutique. Cependant, le moment le plus optimal n’est toujours pas clair (éventuellement plusieurs fois ?), et les coûts ne peuvent pas non plus être ignorés dans la situation actuelle [10].
Traitement des femmes porteuses de BRCA 1 et 2
Environ 10 à 15% des cancers de l’ovaire sont d’origine familiale, les deux gènes BRCA étant les plus importants. Le risque de cancer de l’ovaire au cours de la vie d’une femme porteuse de BRCA 1 est de 25 à 55%, celui d’une femme porteuse de BRCA 2 est de 10 à 25%. Une fois le planning familial terminé, l’annexectomie bilatérale prophylactique doit être discutée avec ces patientes (en plus des autres possibilités de prévention).
Jusqu’à présent, le traitement de ces cancers de l’ovaire ne diffère pas de celui des cancers sporadiques, et le pronostic n’est pas plus mauvais [11]. Une nouveauté à mentionner ici est un traitement d’entretien par l’olaparib.
Jusqu’à 50% des carcinomes séreux de haut grade présentent un défaut de recombinaison homologue (dans la lignée germinale, comme chez les femmes porteuses de BRCA, ou somatique dans les cellules tumorales), une voie importante de correction des dommages à l’ADN. Les enzymes PARP (polymérases) sont responsables de la réparation des cassures simple brin de l’ADN. Dans les cellules saines, elles sont recombinées de manière homologue. Mais sans un gène BRCA fonctionnel, cela n’est pas possible. Les inhibiteurs de la PARP entraînent une instabilité cellulaire et la mort des cellules (“synthetic lethality”). Les cellules tumorales sont particulièrement vulnérables à ce mécanisme.
Une étude de phase II a montré qu’un traitement d’entretien par l’olaparib, un inhibiteur de la PARP par voie orale, apportait un avantage en termes de SSP chez les femmes atteintes d’un cancer de l’ovaire très séreux et prétraité (au moins deux thérapies, sensible au platine, répondant à la dernière thérapie) [12]. Le gain de PFS a été principalement démontré chez les patientes atteintes de la maladie BRCA-positive (lignée germinale ou dans la tumeur) et a tout de même été de sept mois dans ce groupe (HR 0,35). Un bénéfice OS n’a pas pu être démontré jusqu’à présent. En Suisse, l’olaparib n’est pas encore officiellement autorisé, mais les patientes BRCA-positives peuvent être admises dans un programme spécial via l’entreprise. Les effets secondaires sont acceptables (principalement fatigue, gastro-intestinaux, hématologiques) et rarement de grade 3 ou 4.
Le congrès ASCO de cette année a également été l’occasion de présenter les premières données cliniques sur les inhibiteurs de points de contrôle immunitaires avec des anticorps anti-PD-1 et anti-PDL-1. Ces “immunothérapies” – pour simplifier – lèvent le frein du système immunitaire de l’organisme contre les cellules tumorales, et elles sont déjà utilisées avec de bons résultats dans le mélanome et le cancer bronchique. Les inhibiteurs de points de contrôle immunitaires semblent également avoir un effet sur le cancer de l’ovaire, en particulier sur les tumeurs induites par des mutations BRCA.
On peut espérer que le pronostic des patientes atteintes d’un cancer de l’ovaire avancé s’améliorera bientôt grâce aux nouvelles options thérapeutiques.
Littérature :
- Cancer Staging Handbook, AJCC staging Manual 7th edition 2010.
- Sandercock J, et al : Traitement de première ligne pour le cancer ovarien avancé : paclitaxel, platine et les preuves. British Journal of Cancer 2002 ; 87 : 815-824.
- The International Collaborative Ovarian Neoplasm Group : Paclitaxel plus carboplatine versus chimiothérapie standard avec soit du carboplatine mono-agent soit du cyclo-phosphamide, de la doxorubicine, et du cisplatine chez les femmes atteintes d’un cancer de l’ovaire : l’essai randomisé ICON3. Lancet 2002 ; 360 : 505-515.
- Katsumata N, et al : Dose de paclitaxel dense une fois par semaine en association avec du carboplatine toutes les 3 semaines pour le cancer de l’ovaire avancé : a phase 3, open label, randomised controlled trial. Lancet 2009 ; 374 : 1331-1338.
- Sehouli J, et al : Weekly paclitaxel and carboplatin for patients with advanced ovarian cancer : results of a multicentre phase II study of the NOGGO. Cancer Chemother Pharmacol 2008 ; 61 : 243-250.
- Armstrong DK, et al : Cisplatine et paclitaxel intrapéritonéaux dans le cancer de l’ovaire. N Engl J Med 2006 ; 354 : 34-43.
- Wright AA, et al : Utilisation et efficacité de la chimiothérapie intrapéritonéale pour le traitement du cancer de l’ovaire. J Clin Oncol 2015 ; 33 : 2841-2847.
- Poveda A, et al : Trabectedin plus doxorubicine liposomale pégylée dans le cancer de l’ovaire en rechute : résultats dans la sous-population partiellement sensible au platine (intervalle sans platine 6-12 mois) de l’essai randomisé OVA-301 phase III. Ann Oncol 2011 ; 22(1) : 39-48. doi.1093/annonc/mdq352.
- Aghajanian C, et al : OCEANS : un essai de phase III randomisé, en double aveugle, contrôlé par placebo, de chimiothérapie avec ou sans bevacizumab chez des patients atteints de cancer épithélial de l’ovaire récurrent sensible au platine, de cancer péritonéal primaire ou de cancer du tube fallopien. J Clin Oncol 2012 ; 30(17) : 2039-2045.
- Liu JF, et al : Rôle émergent du bevacizumab en association avec la chimiothérapie pour les patients atteints de cancer de l’ovaire résistant au platine. J Clin Oncol 2014 ; 32 : 1287-1289.
- Rubin SC, et al : Caractéristiques cliniques et pathologiques du cancer de l’ovaire chez les femmes présentant des mutations germ-line de BRCA1. N Engl J Med 1996 ; 335 : 1413-1416.
- Ledermann J, et al : Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer. N Engl J Med 2012 ; 366 : 1382-1392.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(2) : 25-28