Les tumeurs de la tête et du cou étaient le septième cancer le plus fréquent dans le monde en 2018. Parmi les principaux facteurs de risque figurent la consommation de nicotine et d’alcool. Le pronostic et les options thérapeutiques multimodales pour les patients atteints de tumeurs de la tête et du cou varient en fonction des facteurs épidémiologiques, de la localisation anatomique et du stade de la tumeur. Un aperçu.
Les tumeurs de la tête et du cou étaient le septième cancer le plus fréquent dans le monde en 2018 (890 000 nouveaux cas) [1]. Aux États-Unis, les tumeurs de la tête et du cou ont été responsables de 3% de tous les cancers (51 540 nouveaux cas) et d’un peu plus de 1,5% de tous les décès par cancer (10 030 décès) [2]. Ces tumeurs malignes sont généralement associées à la consommation de nicotine et d’alcool comme principaux facteurs de risque. Au cours des dernières décennies, on a constaté une diminution globale de l’incidence, notamment en raison de la baisse de la consommation de nicotine [3,4]. En revanche, une augmentation des cancers de l’oropharynx a été mise en évidence chez les personnes plus jeunes en Amérique du Nord et en Europe du Nord, principalement en raison d’une augmentation de la fréquence des tumeurs associées aux sous-types à haut risque du papillomavirus humain (HPV) (surtout le type 16 d’HPV) [4,5].
Le pronostic et les options thérapeutiques multimodales pour les patients* atteints de tumeurs de la tête et du cou varient en fonction des facteurs épidémiologiques, de la localisation anatomique et du stade de la tumeur. Les tumeurs de la tête et du cou constituent un groupe hétérogène de maladies. Cet article de synthèse se concentre sur les options de traitement des carcinomes épidermoïdes récidivants, métastatiques et localement avancés qui se développent à partir des muqueuses (principalement la cavité buccale, le pharynx et le larynx). Le traitement au stade précoce de ces tumeurs n’est pas abordé ici, car aucun changement significatif n’est intervenu dans la thérapie au cours des dernières années.
Le traitement des patients* atteints de tumeurs de la tête et du cou est complexe et comprend non seulement le traitement médical de la tumeur et des effets aigus de la chirurgie, de la chimiothérapie et de la radiothérapie, mais aussi l’orientation et le conseil pour faire face aux handicaps permanents et aux conséquences psychosociales qui en résultent. Des découvertes récentes ont heureusement permis d’améliorer considérablement les résultats du traitement. Les progrès de la chirurgie et de la radiothérapie ont permis d’améliorer la préservation de la fonction des organes concernés et de réduire la morbidité et la mortalité globales. Ainsi, les techniques récentes de chirurgie robotisée pour les cancers de l’oropharynx [6] et celles de microchirurgie au laser peu invasive pour les cancers du larynx et de l’hypopharynx [7] peuvent augmenter de manière significative la probabilité de préservation de la fonction. Les progrès de la radiothérapie conformationnelle, comme la radiothérapie avec modulation d’intensité (IMRT) et la radiothérapie guidée par l’image, peuvent également réduire la morbidité [8]. En particulier, l’introduction d’inhibiteurs de points de contrôle immunitaires pour le traitement des tumeurs de la tête et du cou récidivantes ou métastatiques a considérablement amélioré le pronostic de nombreux patients*, ce qui est abordé en premier lieu ci-dessous.
Tumeurs de la tête et du cou récidivantes et/ou métastasées
Les tumeurs de la tête et du cou récidivantes et/ou métastatiques sont associées à un mauvais pronostic. La plupart des patients* avec une récidive primaire localisée reçoivent – comme les patients* avec des tumeurs métastatiques de la tête et du cou – un traitement palliatif systémique, car seuls des patients* sélectionnés avec une récidive loco-régionale peuvent être traités par une opération ou une nouvelle radiothérapie [9]. En conséquence, une évaluation interdisciplinaire de la situation de la maladie, des éventuels traitements antérieurs et de la situation individuelle est toujours nécessaire pour choisir la meilleure stratégie thérapeutique individuelle. Pendant de nombreuses années, le traitement standard des tumeurs récidivantes et/ou métastatiques a été le “schéma EXTREME”, qui comprend une chimiothérapie à base de platine (cisplatine ou carboplatine) associée au fluorouracile (5-FU) et au cetuximab, un anticorps dirigé contre le récepteur du facteur de croissance épidermique (EGFR), suivie d’un traitement d’entretien par cetuximab [10]. Le traitement par le schéma EXTREME a montré une survie globale médiane d’environ dix mois dans l’étude pivot. Pour les patients qui n’étaient pas éligibles au schéma EXTREME, les taxanes et le méthotrexate étaient quelques-unes des rares options thérapeutiques disponibles. Avec ces substances, la survie globale médiane tombe à six mois [11]. Ces données montrent qu’il est urgent de trouver de nouvelles options de traitement pour les patients* atteints de tumeurs de la tête et du cou récidivantes/métastasées.
Ces dernières années, les traitements par inhibiteurs de points de contrôle sont devenus un nouveau standard pour de nombreuses entités tumorales. Les tumeurs de la tête et du cou sont associées à des déficits des défenses immunitaires, tels qu’une altération de la fonction des cellules tueuses naturelles et une altération des lymphocytes T infiltrant la tumeur, ce qui constitue la raison d’être de l’étude des inhibiteurs de points de contrôle immunitaire dans ces tumeurs [11]. Le nivolumab et le pembrolizumab, tous deux des anticorps monoclonaux IgG4 anti-PD-1, ont été évalués dans des études de phase III chez des patients* atteints de carcinome épidermoïde de la tête et du cou (cavité buccale, oropharynx, larynx ou hypopharynx) après l’échec d’une chimiothérapie à base de platine et comparés à un anticorps ou une chimiothérapie au choix du médecin responsable de l’étude (docétaxel, cétuximab ou méthotrexate). L'”échec du platine” a été défini comme la progression de la maladie dans les six mois suivant une chimiothérapie à base de platine administrée à titre curatif (en association avec une radiothérapie) ou palliatif. L’étude CheckMate 141 est la première étude de phase III à démontrer l’efficacité du nivolumab par rapport à la chimiothérapie (hazard ratio [HR] pour le décès 0,70 ; p=0,01). De plus, le nivolumab s’est avéré mieux toléré (effets secondaires G3/4 13,1% vs 35,1% pour le nivolumab ou la chimiothérapie) et a entraîné une amélioration de la qualité de vie [12,13]. Le nivolumab a donc été la toute première option thérapeutique à améliorer de manière significative la survie globale des patients* atteints d’une tumeur de la tête et du cou récidivante/métastasée chez qui une chimiothérapie à base de platine avait échoué [12]. Dans l’étude KEYNOTE-040, qui était similaire à l’étude CheckMate-141, le pembrolizumab a également augmenté la survie globale par rapport à la chimiothérapie [14]. Il convient de noter que dans les deux études, il n’était pas nécessaire de prouver l’expression de PD-L1 comme critère d’inclusion et que le critère d’évaluation principal ne dépendait pas du statut PD-L1. Aucune des études n’a montré de différence significative en termes de survie sans progression. Comme pour d’autres tumeurs solides, l’allongement de la survie globale était donc principalement dû au fait que l’immunothérapie a permis de contrôler la maladie à long terme chez certains patients*. Par exemple, bien que seulement 13% des patients* aient présenté une réponse radiologique au nivolumab, il a été observé que la durée médiane de la réponse était de 9,7 mois – deux fois plus longue que sous chimiothérapie [15]. Les anticorps anti-PD-L1 ont été étudiés en monothérapie et en combinaison avec des anticorps anti-CTLA-4 après l’échec d’un traitement à base de platine. Après les premières études de phase II avec durvalumab (anticorps anti-PD-L1) chez des patients* présentant une expression élevée de PD-L1 (≥25%) dans l’étude HAWK [16] et durvalumab, durvalumab plus tremelimumab (anticorps anti-CTLA-4) ou tremelimumab seul chez des patients* présentant une faible expression de PD-L1 (<25%) dans l’étude CONDOR [17], l’étude de phase III EAGLE a été lancée [18]. Dans cette dernière, des patients* atteints de tumeurs de la tête et du cou en récidive/métastasées ont été randomisés, après échec d’un traitement à base de platine, entre durvalumab plus tremelimumab, une monothérapie par durvalumab ou une chimiothérapie standard au choix du médecin de l’étude. L’étude n’a pas montré d’avantage de survie sous traitement par durvalumab (HR 0,88 ; p=0,20) ou sous traitement par durvalumab plus tremelimumab (HR 1,04 ; p=0,76) par rapport à la chimiothérapie. Compte tenu de la pertinence limitée des comparaisons entre différentes études, il convient de noter que la survie globale médiane dans le bras durvalumab était similaire à celle observée sous nivolumab dans l’étude CheckMate-141 (7,6 et 7,5 mois respectivement), mais que la survie globale médiane du bras contrôle était numériquement plus longue dans l’étude EAGLE par rapport à l’étude CheckMate-141 (8,3 mois et 5,1 mois respectivement). Une analyse exploratoire de l’étude EAGLE suggère que cette survie globale plus élevée que prévu dans le groupe témoin pourrait être due à des caractéristiques déséquilibrées à l’inclusion (pourcentage plus élevé de patients avec ECOG PS 0 et métastases à distance sans récidive locale/régionale dans le groupe témoin), à l’utilisation accrue du paclitaxel dans le groupe témoin et au traitement ultérieur avec des anticorps anti-PD-1. [18]. On ne sait pas actuellement dans quelle mesure la différence entre les anticorps anti-PD-1 et les anticorps anti-PD-L1 a une pertinence clinique.
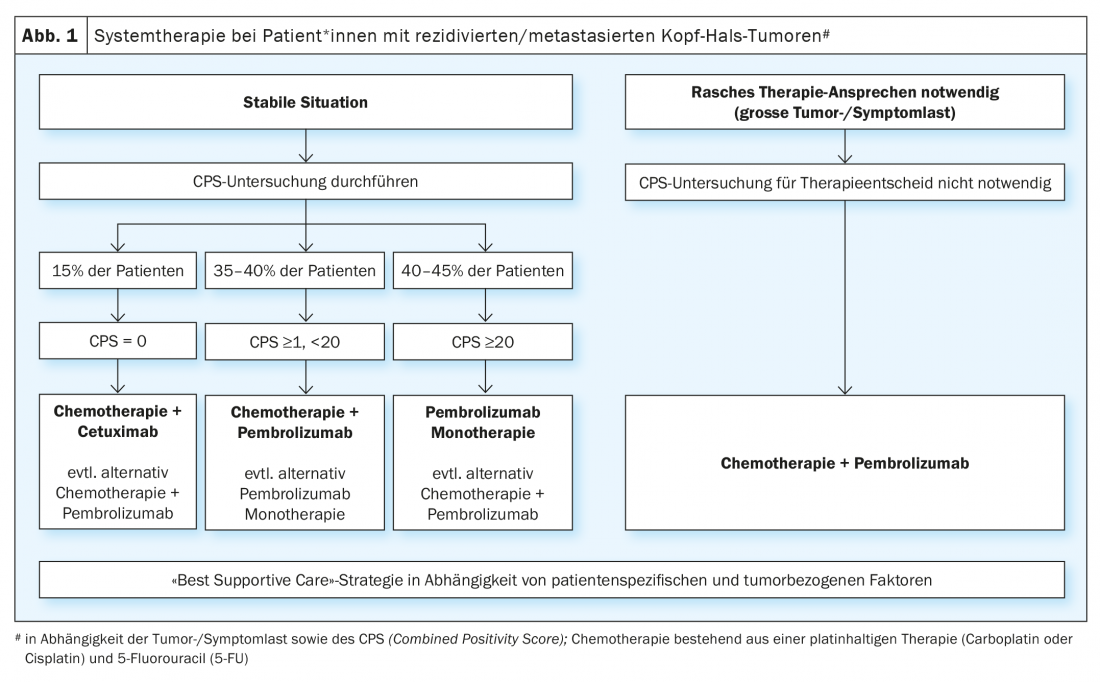
Le bénéfice démontré du traitement par les inhibiteurs de points de contrôle immunitaires chez les patients* atteints de tumeurs de la tête et du cou récidivantes/métastatiques après l’échec d’un traitement à base de platine a conduit à l’évaluation de ces substances dans le traitement palliatif de première ligne. L’étude randomisée de phase III KEYNOTE-048 a comparé une monothérapie par pembrolizumab et un traitement combiné par platine/5-FU et pembrolizumab avec le schéma EXTREME (platine/5-FU/cétuximab) [19]. Les analyses statistiques de la survie globale ont été effectuées dans la population totale et dans des sous-groupes définis, en fonction de l’expression de PD-L1. L’expression de PD-L1 a été classée selon un “indice de positivité combiné” ( Combined Positivity Score, CPS ) (CPS ≥1 et ≥20). Le CPS est défini comme le nombre de cellules PD-L1 positives (cellules tumorales, lymphocytes, macrophages), divisé par le nombre total de cellules tumorales et multiplié par 100. La monothérapie par pembrolizumab a amélioré de manière significative la survie globale chez les patients* présentant un CPS ≥1 et ≥20. Bien que le taux de réponse ait été inférieur à celui de la chimiothérapie (19-21% vs 36%), la durée médiane de la réponse a été multipliée par cinq avec le pembrolizumab en monothérapie (20,9 vs 4,5 mois). La chimiothérapie plus pembrolizumab a significativement amélioré la survie globale dans les trois populations. En ce qui concerne le taux de réponse et la période sans progression, il n’y a pas eu de différence significative entre le traitement combiné par chimiothérapie plus pembrolizumab et le schéma EXTREME. Comme prévu, la monothérapie par pembrolizumab a été associée à moins de toxicité, tandis que le platine/5-FU plus pembrolizumab a entraîné un taux d’événements indésirables similaire à celui du schéma EXTREME. L’étude de phase III KESTREL a randomisé les patients* selon un ratio de 2:1:1 pour Durvalumab seul, Durvalumab plus Tremelimumab ou le schéma EXTREME (NCT02551159). Le critère d’évaluation principal est la survie globale sous durvalumab en monothérapie par rapport à EXTREME chez les patients* présentant une expression élevée de PD-L1 (définie par une expression de > 50% dans les cellules tumorales ou >25% dans les lymphocytes infiltrant la tumeur). Le critère d’évaluation secondaire est la survie globale sous durvalumab plus trémélimumab par rapport à EXTREME pour tous les patients. Aucune donnée n’a été publiée à ce jour. Cependant, un communiqué de presse a annoncé que l’étude n’avait pas atteint ses critères d’évaluation.
En résumé, pour le traitement de première ligne, l’étude KEYNOTE-048 est la première étude positive depuis la publication de l’étude EXTREME en 2009 et a changé le standard de traitement. Il reste cependant quelques questions en suspens qui concernent la pratique quotidienne. L’une d’entre elles est de savoir si les patients* avec un CPS ≥20, qui représentaient 44% des patients* avec une expression PD-L1 détectée dans l’étude KEYNOTE-048, étaient la raison de l’utilité de la monothérapie par pembrolizumab dans le groupe CPS ≥1. La question de savoir si une monothérapie par pembrolizumab est suffisante pour les patients* atteints de CPS 1-19 ne peut pas être tranchée. Une analyse de sous-groupe de l’étude KEYNOTE-048 a montré que le pembrolizumab présentait toujours un bénéfice par rapport à EXTREME en cas de SCP 1-19 (HR 0,86), bien que plus faible que chez les patients* atteints de SCP ≥20 (HR 0,58) [20]. En pratique clinique quotidienne, le choix d’une monothérapie par pembrolizumab par rapport à un traitement combiné par platine/5-FU plus pembrolizumab pour les patients* atteints de CPS 1-19 dépend aussi en premier lieu de l’importance de la charge tumorale et des symptômes. En outre, les comorbidités et l’état général des personnes concernées doivent également être pris en compte. Chez les patients* atteints de CPS 1-19 et présentant une charge tumorale élevée et/ou des symptômes importants liés à la tumeur, une chimio-immunothérapie combinée est souvent préférée afin de maximiser la réponse potentielle. Une autre question porte sur la séquence de traitement des patients PD-L1 négatifs, qui représentent environ 15% des personnes concernées. Une analyse de sous-groupe pour les patients* PD-L1 négatifs dans l’étude KEYNOTE 048 a montré un avantage pour le schéma EXTREME par rapport au traitement combiné avec le pembrolizumab (HR 1,22) [20]. Cependant, compte tenu du petit nombre de patients dans cette cohorte et du fait qu’il s’agissait d’une analyse de sous-groupe non planifiée, on ne peut pas en conclure que les patients PD-L1 négatifs* ne doivent pas être traités par l’association platine/5-FU et pembrolizumab. En résumé, la monothérapie par pembrolizumab chez les patients* présentant une expression élevée de PD-L1 (CPS ≥20) et le traitement combiné par platine/5-FU et pembrolizumab représentent un nouveau standard thérapeutique, indépendamment de l’expression de PD-L1, mais surtout pour les tumeurs PD-L1-positives. (Fig. 1). Pour les patients qui présentent une progression de la tumeur sous ou après ce traitement de première ligne, les options de traitement disponibles sont les chimiothérapies mentionnées ci-dessus (docétaxel, méthotrexate) ou un traitement par cetuximab. De nombreuses études sont actuellement en cours pour évaluer de nouvelles approches immunothérapeutiques. Ainsi, l’étude INTERLINK-1 est ouverte au recrutement dans plusieurs centres en Suisse. Cette étude randomisée compare le cetuximab à l’association de cetuximab et de monalizumab, un inhibiteur de point de contrôle immunitaire ciblant NKG2A (NCT04590963).
Outre l’expression de PD-L1, le statut HPV pourrait également servir de biomarqueur clinique pour prédire la réponse à un traitement par inhibiteurs de points de contrôle immunitaires. L’infection à HPV entraîne la production de protéines liées au virus, qui peuvent déclencher une réaction de novo des cellules T et une infiltration plus importante de la tumeur par les cellules T CD8+ [21]. Dans l’étude de phase II KEYNOTE-055, le taux de réponse au pembrolizumab était de 22% chez les patients* atteints de tumeurs p16-positives et de 16% chez les patients atteints de tumeurs p16-négatives [22]. Une méta-analyse a également montré que le statut HPV semble être corrélé avec le taux de réponse au traitement anti-PD-1, indépendamment de l’expression de PD-L1 et de la charge mutationnelle de la tumeur [23]. Une autre méta-analyse a conclu que les patients* atteints de tumeurs HPV-positives obtenaient des résultats significativement meilleurs avec un traitement par inhibiteurs de points de contrôle immunitaires [24]. Il n’est pas encore possible d’évaluer définitivement si ces résultats ont une pertinence dans la pratique clinique quotidienne. Les directives actuelles sur l’immunothérapie des tumeurs de la tête et du cou ne recommandent pas encore l’utilisation du statut HPV pour la décision thérapeutique [25].
Tumeurs localement avancées de la tête et du cou
Plus de 60% des patients* atteints de carcinome épidermoïde de la tête et du cou présentent un stade III ou IV, caractérisé par de grosses tumeurs avec une invasion locale marquée, des signes de métastases dans les ganglions lymphatiques régionaux ou les deux. Une maladie localement avancée présente un risque élevé de récidive locale (15% à 40%) et de métastases à distance [26]. Les approches multimodales ont permis d’améliorer les taux de guérison tout en visant à préserver la fonction et la qualité de vie [27]. Les décisions thérapeutiques à ces stades nécessitent une évaluation complexe de la morbidité, des effets secondaires possibles et de la préservation de la fonction. Elles dépendent aussi fortement de la taille et de la localisation anatomique de la tumeur primaire, du stade de la maladie, de l’âge des personnes concernées, de leurs préférences ainsi que de leur état général et des maladies associées. Ces décisions thérapeutiques devraient donc toujours être prises de manière interdisciplinaire dans le cadre d’une tumor board.
Pour les tumeurs localement avancées et résécables, la résection est suivie – dans une intention curative – d’un traitement adjuvant consistant en une radiothérapie ou une radiochimiothérapie combinée (RCT). Ceci en fonction des facteurs de risque et des comorbidités des personnes concernées. Une détection microscopique de cellules tumorales sur la pièce de résection (R1) et une détection de croissance extracapsulaire dans les ganglions lymphatiques sont considérées comme des facteurs de risque “à haut risque”. Si elles sont présentes, une RCT combinée adjuvante est recommandée. Le cisplatine s’est imposé comme agent chimiothérapeutique dans ce cas [28,29].
Lorsque la résection chirurgicale n’est pas réalisable, techniquement ou en raison de comorbidités, ou qu’elle entraînerait des résultats fonctionnels potentiellement médiocres à long terme, la RCT définitive est la norme curative établie. Une grande méta-analyse (Meta-analysis of Chemotherapy in Head and Neck Cancer [MACH-NC]) a inclus près de 20 000 patients* atteints de tumeurs localement avancées de la tête et du cou. Il a été démontré que la RCT combinée réduisait la mortalité à 5 ans de 6,5 points de pourcentage par rapport à la radiothérapie seule (HR 0,83 ; p<0,001). L’ajout d’une chimiothérapie d’induction ou adjuvante n’a pas entraîné d’amélioration significative de la survie globale par rapport à la RCT seule [30]. Le cisplatine à haute dose (100 mg/m2 de surface corporelle, administré par voie intraveineuse tous les 21 jours pendant trois cycles), administré en même temps que la radiothérapie dans le cadre d’une RCT définitive, est le traitement standard actuel. Cependant, en raison des toxicités importantes à court et à long terme associées au cisplatine, son utilisation est principalement réservée aux jeunes patients* qui ne présentent pas de pathologies associées graves [30–32]. Il en a résulté plusieurs modifications et variations du schéma de cisplatine utilisé à l’origine (une fois toutes les trois semaines). Des revues systématiques ont comparé les données entre le cisplatine une fois par semaine et le cisplatine toutes les trois semaines (critère d’inclusion : dose cumulée de cisplatine ≥180 mg/m2). Les résultats sont similaires et les taux d’effets secondaires graves, notamment la néphrotoxicité et l’ototoxicité, sont plus faibles [33]. Nous avons également pu le confirmer dans notre propre analyse, bien que la dose cumulée de cisplatine ait été plus faible chez les patients* traités à intervalles hebdomadaires [34]. Le traitement hebdomadaire au cisplatine peut donc être utilisé comme une alternative acceptable, car la dose est mieux contrôlée et la néphro- et ototoxicité généralement moins grave. En outre, chez les patients* qui ne sont pas éligibles pour le cisplatine (par exemple, les patients atteints d’une maladie rénale chronique, d’une surdité chronique, d’un âge avancé ou d’un statut de performance ECOG limite), le carboplatine est souvent utilisé en combinaison avec un taxane, bien qu’il n’y ait pas de comparaison directe dans des essais contrôlés randomisés. Le cétuximab, administré en même temps que la radiothérapie, a été approuvé comme traitement standard dès 2006, après que des données ont montré que ce traitement améliorait le contrôle loco-régional et la survie globale par rapport à la radiothérapie seule [35]. Cependant, des études randomisées récentes indiquent que la radiothérapie combinée avec le cetuximab donne de moins bons résultats, y compris un taux de survie plus faible, chez les patients* atteints de cancers oropharyngés HPV-positifs, en comparaison directe avec le cisplatine à haute dose combiné à la radiothérapie [36,37]. Ainsi, la RCT combinée avec le cisplatine reste le traitement standard préféré.
Une autre approche prometteuse pour améliorer le pronostic est de combiner la RCT à base de cisplatine avec le xévinapant. Le xévinapant est un antagoniste des inhibiteurs de l’apoptose. Dans une étude randomisée de phase II, l’ajout de Xevinapant à la RCT a significativement amélioré le taux de contrôle tumoral locorégional comme critère d’évaluation principal à 18 mois, de 21% par rapport au placebo en association avec la RCT (54% vs 33% ; p=0,026) [38]. De plus, après un suivi de deux ans, un avantage significatif a été observé en termes de survie sans progression par rapport au bras contrôle (HR 0,37 ; p=0,0069). Après une période de suivi de trois ans, le xévinapant plus RCT a montré une réduction statistiquement significative du risque de décès de 51% par rapport au placebo plus RCT (HR 0,49 ; p=0,0261). Pour confirmer ces résultats, l’étude randomisée de phase III TrilynX (NCT04459715) est actuellement en cours.
En raison des données encourageantes obtenues dans les tumeurs de la tête et du cou en récidive/métastasées, de nombreuses études évaluent actuellement l’utilisation des inhibiteurs de points de contrôle immunitaires à des stades plus précoces, en particulier dans les tumeurs localement avancées, en combinaison avec une RCT. Ainsi, l’étude multinationale de phase III JAVELIN Head and Neck 100 [39] a déjà évalué l’efficacité de l’avelumab, un inhibiteur de PD-L1, en combinaison avec la RCT avec le cisplatine, par rapport au placebo en combinaison avec la RCT. L’étude a été interrompue prématurément après une analyse intérimaire, car elle n’a montré aucune amélioration de la période sans progression [40]. Une étude encore en cours examine la place d’un traitement d’entretien par atezolizumab après la fin de l’ECR (IMvoke010 ; NCT03452137). D’autres études testent la RCT combinée avec des inhibiteurs de points de contrôle immunitaires suivis d’un traitement d’entretien. La plus grande de ces études est KEYNOTE-412 (pembrolizumab vs. placebo ; NCT03040999).
Une autre approche intéressante, qui a été étudiée dans différentes tumeurs et a donné des résultats prometteurs, est l’utilisation néoadjuvante d’inhibiteurs de points de contrôle immunitaires [41,42]. Compte tenu de la situation de traitement naïf et de l’absence de cellules résistantes au traitement par rapport à la situation de récidive/métastase, une immunothérapie néoadjuvante peut être en mesure d’obtenir un effet thérapeutique plus important et durable. Par exemple, un traitement néoadjuvant anti-PD-1 dans un modèle murin de tumeur de la tête et du cou a entraîné une transformation de l’immunodominance fonctionnelle et a induit des réponses immunitaires robustes dirigées contre la tumeur [43]. Schoenfeld et al. ont étudié le nivolumab (N) en néoadjuvant dans une étude de phase II et la combinaison nivolumab plus ipilimumab (N+I) dans une seconde cohorte de 29 patients* non traités atteints de cancers de la cavité buccale [44]. Le nivolumab (3 mg/kg) a été administré aux semaines 1 et 3, tandis que l’ipilimumab (1 mg/kg) n’a été administré qu’à la semaine 1. Bien que 21 patients* au total aient présenté des effets indésirables, dont des degrés 3/4 chez 2 (N) et 5 (N+I) patients*, l’opération n’a pas été retardée. En outre, les deux cohortes ont montré des signes de réponse à ces traitements. En particulier, quatre patients* (N, n=1 ; N+I, n=3) ont eu une réponse complète ou presque complète (<10% de cellules tumorales vitales). Ces résultats plaident en faveur de la tolérance clinique et de l’efficacité de l’immunothérapie néoadjuvante. D’autres données intéressantes sur l’utilisation néoadjuvante des inhibiteurs de points de contrôle immunitaires ont été fournies par l’étude CAIO [45], l’étude IMCISION [46], l’étude CheckMate-358 [47] ainsi que d’autres études [48–50], qui ont toutes montré la faisabilité et l’efficacité de cette stratégie thérapeutique. Des études de plus grande envergure ont donc été lancées sur cette base (par exemple, l’étude randomisée de phase III KEYNOTE-689, NCT03765918). En outre, il est important d’étudier les prédicteurs possibles de la réponse afin de permettre une sélection des patients appropriés. Une analyse détaillée des échantillons tumoraux ainsi que des éventuelles modifications du microenvironnement tumoral et des cellules immunitaires infiltrant la tumeur est ici importante.
Résumé/Conclusion
L’introduction de l’immunothérapie dans le traitement des tumeurs de la tête et du cou récidivantes et/ou métastatiques a fondamentalement modifié la prise en charge de ces pathologies et a considérablement amélioré leur pronostic. Le traitement analogue à celui de l’étude KEYNOTE-048 (chimiothérapie à base de platine + 5-FU + pembrolizumab ou pembolizumab mono selon la CPS et la charge tumorale/symptomatique) s’est établi comme nouveau traitement palliatif de première ligne. En raison de résultats encourageants dans les stades avancés de la tumeur, la question de l’utilité de l’immunothérapie se pose également pour les stades plus précoces de la tumeur, en combinaison ou en séquence avec la radiothérapie et la chimiothérapie. Il est très probable que la séquence des différentes modalités de traitement influence considérablement les résultats. Surtout si l’on considère que la réponse des lymphocytes T dirigée contre la tumeur a différentes phases qui peuvent être ciblées par différentes immunothérapies, et que la radiothérapie et la chimiothérapie peuvent toutes deux moduler le système immunitaire tout en ayant des effets cytotoxiques contre les lymphocytes T [51]. D’autres approches combinées inédites sont à l’étude dans le cadre d’essais cliniques associant des immunothérapies à des vaccins contre le VPH, des vaccins anti-tumoraux spécifiques aux patients, des thérapies ciblant les cellules T, des virus oncolytiques et d’autres immunomodulateurs.
Messages Take-Home
- L’introduction de l’immunothérapie par les inhibiteurs de points de contrôle immunitaires dans le traitement des tumeurs de la tête et du cou récidivantes/métastasées a considérablement amélioré le pronostic de ces patients*.
- Une monothérapie avec l’anticorps anti-PD-1 pembrolizumab chez les patients* présentant une expression élevée de PD-L1 (CPS ≥20) et un traitement combiné par platine/5-FU et pembrolizumab (indépendamment de l’expression de PD-L1, mais en particulier en cas de CPS ≥1) constituent le nouveau standard thérapeutique pour les tumeurs de la tête et du cou récidivantes/métastatiques, sur la base de l’étude KEYNOTE-048.
- Pour les tumeurs localement avancées et inopérables, la radiochimiothérapie combinée (RCT) définitive avec du cisplatine reste le traitement de référence. Les alternatives médicamenteuses au cisplatine en combinaison avec la radiothérapie sont le carboplatine combiné à un taxane et le cetuximab. Le xévinapant (antagoniste des inhibiteurs de l’apoptose) en complément de la RCT semble prometteur (essai randomisé de phase III actuellement en cours).
- L’utilisation de l’immunothérapie à des stades tumoraux plus précoces, en combinaison avec une RCT, en traitement d’entretien ou dans un cadre néoadjuvant, fait l’objet d’études actuellement en cours.
Conflits d’intérêts
ED :
Pas de conflit d’intérêts.
SR : Honoraires pour activités de conseil (payés à l’Hôpital universitaire de Bâle) d’Astra-Zeneca, BMS, Boehringer-Ingelheim, Eisai, Eli Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche, Takeda. Financement de la recherche par AbbVie, Astra-Zeneca, BMS, Boehringer-Ingelheim, Merck. Soutien pour la participation à des congrès d’Amgen, AstraZeneca, BMS, Boehringer-Ingelheim, MSD, Roche, Takeda. Membre de la Commission fédérale des médicaments de l’Office fédéral de la santé publique.
Littérature :
- Bray F, et al : Global cancer statistics 2018 : GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018 ; 68 : 394-424.
- Siegel RL, et al : An assessment of progress in cancer control. CA Cancer J Clin 2018 ; 68 : 329-339.
- Mourad M, et al : Epidemiological Trends of Head and Neck Cancer in the United States : A SEER Population Study. J Oral Maxillofac Surg 2017 ; 75 : 2562-2572.
- Fitzmaurice C, et al. Global, regional, and national cancer incidence, mortality, years of life loaded, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015 : A Systematic Analysis for the Global Burden of Disease Study Global Burden of Disease Cancer Collaboration. JAMA Oncol. 2017 ; 3 : 524-548.
- Gillison ML, et al : Épidémiologie du carcinome épidermoïde de la tête et du cou à papillomavirus humain positif. J Clin Oncol 2015 ; 33 : 3235-3242.
- Moore EJ, Janus J, Kasperbauer J : Chirurgie robotique transorale de l’oropharynx : Considérations cliniques et anatomiques. Clin. Anat. 2012 ; 25 : 135-141.
- Weiss BG, et al. : Microchirurgie laser transorale pour le traitement du cancer hypopharyngé chez 211 patients. Head Neck 2017 ; 39 : 1631-1638.
- Gupta T, et al : Systematic review and meta-analyses of intensity-modulated radiation therapy versus conventional two-dimensional and/or three-dimensional radiotherapy in curative-intent management of head and neck squamous cell carcinoma. PLoS One. 2018 ; 13. DOI:10.1371/journal.pone.0200137.
- Vermorken JB, Specenier P : Traitement optimal pour les cancers récurrents/métastatiques de la tête et du cou. Annales d’oncologie. Oxford University Press, 2010. DOI:10.1093/annonc/mdq453.
- Vermorken JB, et al : Chimiothérapie à base de platine plus cetuximab dans le cancer de la tête et du cou. N Engl J Med 2008 ; 359 : 1116-1127.
- Saleh K, et al. : New developments in the management of head and neck cancer – Impact of pembrolizumab. Thérapie clinique. Risk Manag. 2018 ; 14 : 295-303.
- Ferris RL, et al : Nivolumab pour les carcinomes épidermoïdes récidivants de la tête et du cou. N Engl J Med 2016 ; 375 : 1856-1867.
- Harrington KJ, et al : Nivolumab versus traitement standard, mono-agent du choix de l’investigateur dans le carcinome épidermoïde récurrent ou métastatique de la tête et du cou (CheckMate 141) : résultats de qualité de vie liés à la santé issus d’un essai randomisé de phase 3. Lancet Oncol 2017 ; 18 : 1104-1115.
- Cohen EEW, et al : Pembrolizumab versus methotrexate, docetaxel, ou cetuximab pour le carcinome épidermoïde récidivant ou métastatique de la tête et du cou (KEYNOTE-040) : une étude randomisée, en ouvert, phase 3. Lancet 2019 ; 393 : 156-167.
- Ferris RL, et al : Nivolumab vs choix de l’investigateur dans le carcinome épidermoïde récurrent ou métastatique de la tête et du cou : mise à jour de la survie à long terme sur 2 ans de CheckMate 141 avec analyses par expression PD-L1 tumorale. Oral Oncol 2018 ; 81 : 45-51.
- Zandberg DP, et al : Durvalumab pour le carcinome épidermoïde récurrent ou métastatique de la tête et du cou : résultats d’une étude de phase II à un seul bras chez des patients présentant une expression PD-L1 des cellules tumorales ≥25% et qui ont progressé sous chimiothérapie à base de platine. Eur J Cancer 2019 ; 107 : 142-152.
- Siu LL, et al : Sécurité et efficacité du durvalumab avec ou sans tremelimumab chez les patients atteints de HNSCC PD-L1 faible/négatif récurrent ou métastatique : l’essai clinique randomisé CONDOR de phase 2. JAMA Oncol 2019 ; 5 : 195-203.
- Ferris RL, et al : Durvalumab avec ou sans tremelimumab chez les patients atteints de carcinome épidermoïde récurrent ou métastatique de la tête et du cou : EAGLE, une étude randomisée de phase III en ouvert. Ann Oncol 2020 ; 31 : 942-950.
- Burtness B, et al : Pembrolizumab seul ou avec chimiothérapie versus cetuximab avec chimiothérapie pour les carcinomes épidermoïdes récurrents ou métastatiques de la tête et du cou (KEYNOTE-048) : une étude randomisée, en ouvert, phase 3. Lancet 2019 ; 394 : 1915-1928.
- Burtness B, et al : Abstract LB-258 : Efficacité du pembrolizumab de première ligne (1L) par score positif combiné PD-L1 <1, 1-19, et ≥20 dans le carcinome épidermoïde de la tête et du cou (HNSCC) récurrent et/ou métastatique (R/M) : KEYNOTE-048 analyse de sous-groupe. Recherche sur le cancer. Association américaine pour la recherche sur le cancer (AACR), 2020.
- Matlung SE, et al. : Différences dans les infiltrats de cellules T et la survie entre les carcinomes épidermoïdes HPV+ et HPV- oropharyngés. Futur. Sci. OA. 2016 ; 2. DOI:10.4155/fso.15.88.
- Bauml J, et al : Pembrolizumab pour les cancers de la tête et du cou réfractaires au platine et au cetuximab : Résultats d’une étude de phase II à un seul bras. J Clin Oncol 2017 ; 35 : 1542-9.
- Wang J, et al : Statut HPV positif associé à un microenvironnement immunitaire infecté et à une meilleure réponse au traitement anti-PD-1 dans le carcinome spinocellulaire de la tête et du cou. Sci Rep 2019 ; 9. DOI:10.1038/s41598-019-49771-0.
- Xu Y, et al : Programmed Death-1/Programmed Death-Ligand 1-Axis Blockade in Recurrent or Metastatic Head and Neck Squamous Cell Carcinoma Stratified by Human Papillomavirus Status : A Systematic Review and Meta-Analysis. Front Immunol 2021 ; 12. DOI:10.3389/fimmu.2021.645170.
- Cohen EEW, et al : The Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of squamous cell carcinoma of the head and neck (HNSCC). J Immunother Cancer 2019 ; 7. DOI:10.1186/s40425-019-0662-5.
- Braakhuis BJM, Brakenhoff RH, René Leemans C : Choix du traitement pour les cancers localement avancés de la tête et du cou sur la base des facteurs de risque : facteurs de risque biologiques. Ann Oncol 2012 ; 23. DOI:10.1093/annonc/mds299.
- Brana I, Siu LL : Locally advanced head and neck squamous cell cancer : Treatment choice based on risk factors and optimizing drug prescription. Ann Oncol 2012 ; 23. DOI:10.1093/annonc/mds322.
- Cooper JS, et al : Radiothérapie et chimiothérapie concomitantes postopératoires pour le carcinome spinocellulaire à haut risque de la tête et du cou. N Engl J Med 2004 ; 350 : 1937-1944.
- Bernier J, et al : Irradiation postopératoire avec ou sans chimiothérapie concomitante pour les cancers localement avancés de la tête et du cou. N Engl J Med 2004 ; 350 : 1945-1952.
- Pignon JP, et al : Meta-analysis of chemotherapy in head and neck cancer (MACH-NC) : an update on 93 randomised trials and 17,346 patients. Radiother Oncol 2009 ; 92 : 4-14.
- Adelstein D, et al : NCCN guidelines® insights head and neck cancers, version 2.2017 featured updates to the NCCN guidelines. JNCCN J Natl Compr Cancer Netw 2017 ; 15 : 761-770.
- Adelstein DJ, et al : An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol 2003 ; 21 : 92-98.
- Mohamed A, et al : Chimioradiothérapie concomitante avec cisplatine hebdomadaire versus cisplatine tri-hebdomadaire dans le carcinome épidermoïde localement avancé de la tête et du cou : analyse comparative. Tête et cou. 2019 ; 41 : 1490-1498.
- Helfenstein S, et al : 3-weekly or weekly cisplatin concurrently with radiotherapy for patients with squamous cell carcinoma of the head and neck – A multicentre, retrospective analysis. Radiat Oncol 2019 ; 14. DOI:10.1186/s13014-019-1235-y.
- Bonner JA, et al : Radiothérapie plus cetuximab pour les cancers de la tête et du cou locorégionalement avancés : données de survie à 5 ans issues d’un essai randomisé de phase 3, et relation entre les rashs induits par le cetuximab et la survie. Lancet Oncol 2010 ; 11 : 21-28.
- Mehanna H, et al : Radiothérapie plus cisplatine ou cetuximab dans les cancers oropharyngés à papillomavirus humains positifs à faible risque (De-ESCALaTE HPV) : un essai randomisé contrôlé en phase 3 en ouvert. Lancet 2019 ; 393 : 51-60.
- Gillison ML, et al : Radiothérapie plus cetuximab ou cisplatine dans le cancer oropharyngé à papillomavirus humain positif (NRG Oncology RTOG 1016) : un essai randomisé, multicentrique, non inférentiel. Lancet 2019 ; 393 : 40-50.
- Bourhis J, et al : TrilynX : Une étude de phase 3 de l’xevinapant et de la chimioradiation concomitante pour les cancers localement avancés de la tête et du cou. J Clin Oncol 2021 ; 39 : TPS6091-TPS6091.
- Yu Y, Lee NY : JAVELIN Head and Neck 100 : Un essai de phase III d’avelumab et de chimioradiation pour les cancers localement avancés de la tête et du cou. Futur Oncol 2019 ; 15 : 687-694.
- Cohen EE, et al : Résultats primaires de la phase III de l’essai JAVELIN head & neck 100 : avelumab plus chimioradiothérapie (CRT) suivie d’une maintenance par avelumab vs CRT chez les patients atteints de carcinome épidermoïde localement avancé de la tête et du cou (LA SCCHN). Congrès ESMO 2020 : Annals of Oncology (2020) 31 (suppl_4) : S599-S628.
- Topalian SL, Taube JM, Pardoll DM : Blocage néoadjuvant des points de contrôle pour l’immunothérapie du cancer. Science 2020 ; 367. DOI:10.1126/science.aax0182.
- Rothschild SI, et al : SAKK 16/14 : Durvalumab en complément de la chimiothérapie néoadjuvante chez les patients atteints de cancer du poumon non à petites cellules de stade IIIA(N2) – Essai multicentrique à bras unique de phase II. J Clin Oncol 2021 ; 39 : 2872-2880.
- Friedman J, et al : Neoadjuvant PD-1 immune checkpoint block reverses functional immunodominance among tumor antigen-specific T cells. Clin Cancer Res 2020 ; 26 : 679-689.
- Schoenfeld JD, et al : Nivolumab en néoadjuvant ou nivolumab plus ipilimumab dans le carcinome spinocellulaire à cavité orale non disséqué : un essai clinique randomisé de phase 2 en ouvert. JAMA Oncol 2020 ; 6 : 1563-1570.
- Ferrarotto R, et al : Impact du durvalumab néoadjuvant avec ou sans tremelimumab sur la densité des lymphocytes tumoraux CD8+, la sécurité, et l’efficacité chez les patients atteints de cancer de l’oropharynx : résultats du CIAO trial. Clin Cancer Res 2020 ; 26 : 3211-3219.
- Vos JL, et al : L’immunothérapie néoadjuvante par nivolumab et ipilimumab induit des réponses pathologiques majeures chez les patients atteints de carcinome spinocellulaire de la tête et du cou. Nat Commun 2021 ; 12. DOI:10.1038/s41467-021-26472-9.
- Ferris RL, et al : Néoadjuvant nivolumab pour les patients atteints de carcinomes épidermoïdes résécables HPV-positifs et HPV-négatifs de la tête et du cou dans l’essai CheckMate 358. J Immunother Cancer 2021 ; 9. DOI:10.1136/jitc-2021-002568.
- Merlino DJ, et al : Discordant Responses Between Primary Head and Neck Tumors and Nodal Metastases Treated With Neoadjuvant Nivolumab : Correlation of Radiographic and Pathologic Treatment Effect. Front Oncol 2020 ; 10. DOI:10.3389/fonc.2020.566315.
- Xiong Y, et al : Effets immunologiques de l’immunothérapie par nivolumab chez les patients atteints de carcinome épidermoïde de la cavité orale. BMC Cancer 2020 ; 20. DOI : 10.1186/s12885-020-06726-3.
- Uppaluri R, et al : Néoadjuvant et adjuvant pembrolizumab dans le cancer de la tête et du cou localement avancé et résécable, non lié au papillomavirus humain : un essai multicentrique de phase II. Clin Cancer Res 2020 ; 26 : 5140-52.
- Yan Y, et al : Combining Immune Checkpoint Inhibitors With Conventional Cancer Therapy. Front. Immunol. 2018 ; 9. DOI:10.3389/fimmu.2018.01739.
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(1) : 5-11