La chirurgie est le premier choix pour le carcinome gastrique localisé. La thérapie systémique en péri- ou postopératoire peut améliorer les taux de guérison. Palliativement, elle prolonge la survie et améliore la qualité de vie.
Les déclarations faites dans cet article s’appliquent à la fois au carcinome gastrique classique et aux carcinomes de transition gastro-œsophagiens (tumeurs GEJ), car ces deux entités ont généralement été étudiées ensemble dans les études récentes.
Thérapie systémique à visée curative
Le taux de guérison du cancer de l’estomac de stade 1 est d’environ 70% en cas de résection R0. Elle tombe déjà à un peu plus de 35% pour une maladie de stade 2 avec une opération seule. Afin d’augmenter les taux de guérison, l’utilisation de thérapies systémiques pré- et/ou postopératoires a été évaluée dans le cadre d’études cliniques. Pour le traitement systémique à visée curative, il existe le modèle américain (radiochimiothérapie postopératoire [adjuvante] ) [1] et le modèle européen (chimiothérapie périopératoire [neoadjuvante und adjuvante] ) [2].
L’étude américaine INT0116 a traité des patients ayant subi une résection d’un carcinome gastrique par une radiochimiothérapie au 5FU pendant cinq semaines et par deux administrations de 5FU à intervalles mensuels [1]. La survie moyenne était de 36 mois dans le groupe avec radiochimiothérapie adjuvante et de 27 mois avec le traitement chirurgical seul (l’étude ayant été critiquée en raison de l’étalement chirurgical insuffisant des stations ganglionnaires et de la surestimation potentielle des bénéfices du traitement qui en résulte). Indépendamment du débat sur l’étendue adéquate du curage ganglionnaire, la radiochimiothérapie adjuvante, par analogie avec l’étude INT0116, reste très répandue dans la région américaine – en particulier lorsque la discussion interdisciplinaire n’a lieu qu’après l’opération. Les études ARTIST et CLASSIC ont démontré que la chimiothérapie exclusive par cisplatine/capécitabine ou chimiothérapie par cellules souches était une alternative à la radiochimiothérapie adjuvante. Oxaliplatine/Capécitabine établi [3,4]. Ces deux études présentent certains inconvénients, de sorte que les stratégies qu’elles mettent en œuvre ne sont pas largement appliquées en Europe. L’étude ARTIST a comparé la chimiothérapie seule à la radiochimiothérapie (au lieu de l’observation seule) et l’étude CLASSIC a été menée exclusivement sur des patients asiatiques.
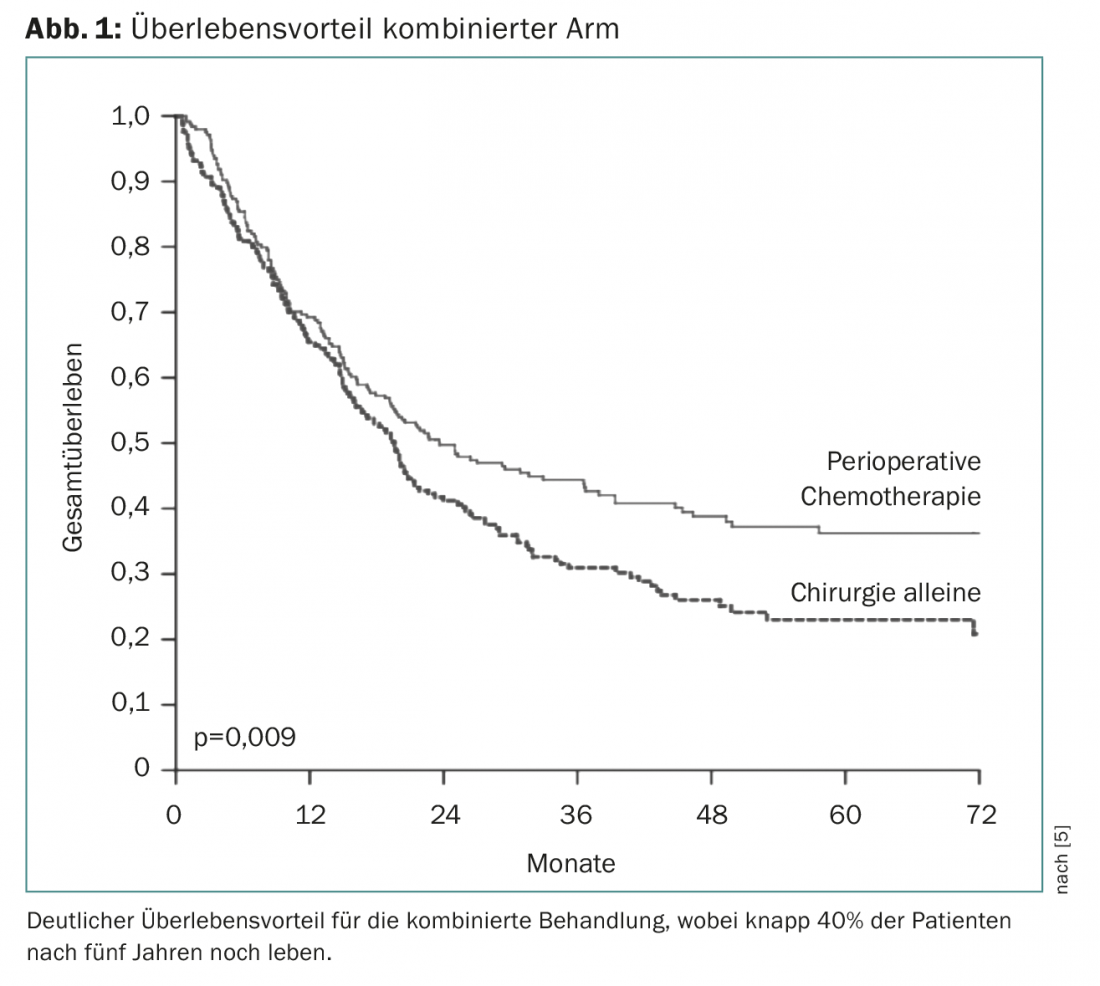
La chimiothérapie périopératoire s’est établie pour la première fois avec l’étude européenne MAGIC. Celle-ci a étudié une chimiothérapie comprenant trois cycles d’épirubicine, de cisplatine et de 5FU (ECF) avant et trois cycles d’ECF après la chirurgie vs la chirurgie seule [5]. Il en est ressorti un net avantage de survie pour le bras combiné, de sorte que ce traitement est devenu la norme à partir de 2006 (fig. 1). Le traitement périopératoire a encore été confirmé comme principe (vs. chimiothérapie seule) dans l’étude FNLCC/FFCD ou l’étude EORTC-40954. Ces études diffèrent par la durée de la chimiothérapie périopératoire et par la composition des substances. Le type de chimiothérapie périopératoire a été développé principalement dans l’étude AIO-FLOT4, dans laquelle trois substances efficaces (5FU, oxaliplatine, docétaxel) ont été comparées sur quatre cycles avant et après l’opération contre le standard actuel de l’étude Magic (ECF/ECX) avant et après l’opération. La chimiothérapie FLOT périopératoire a été étonnamment bien tolérée et a montré un net avantage en termes de survie, passant de 35 à 50 mois, de sorte que ce schéma est devenu un standard incontesté jusqu’à présent [6].
Le modèle américain est historiquement né du fait que les patients n’étaient présentés à l’équipe interdisciplinaire qu’après l’opération. Aujourd’hui, les cas sont généralement discutés en préopératoire au sein du tumorboard interdisciplinaire. Sur la base des données disponibles, il convient aujourd’hui d’envisager une thérapie systémique périopératoire dès le stade cT2cN0. Les raisons suivantes plaident en faveur de cette approche :
- Il n’est pas rare que le stade soit plus avancé que celui déterminé par les examens de staging.
- Le pronostic est généralement déterminé par les métastases à distance et beaucoup plus rarement par les récidives locales.
- En postopératoire, les chimiothérapies peuvent ne pas être appliquées ou ne l’être que partiellement (récupération postopératoire retardée).
- Les principales études qui ont testé les chimiothérapies périopératoires ont inclus des patients à partir du stade cT2cN0.
Une grande étude de phase III (étude FLOT5) est actuellement en cours pour déterminer si les patients atteints d’une tumeur gastrique/GEJ avec des métastases limitées doivent bénéficier d’une opération (chimiothérapie périopératoire) ou être traités uniquement par chimiothérapie FLOT [7]. Compte tenu de l’amélioration des techniques chirurgicales et de l’étude préliminaire FLOT4 très prometteuse [8], la problématique de cette étude est très intéressante. Malheureusement, les premiers résultats de l’étude ne sont pas attendus avant 2022.
Thérapie palliative systémique
L’équilibre entre les bénéfices du traitement et les effets secondaires associés au traitement est, comme toujours, crucial dans les situations palliatives. Le traitement palliatif systémique entraîne en principe une prolongation de la survie et une amélioration de la qualité de vie. Il n’existe pas de norme claire pour le traitement de première ligne. En général, on utilise une combinaison de deux traitements (par exemple 5FU/oxaliplatine) ou, si l’état général est bon et la motivation thérapeutique élevée, une combinaison de trois traitements, comme la thérapie FLOT mentionnée ci-dessus. Dans les études, le traitement était généralement administré sans pause jusqu’à la progression, des effets secondaires importants ou l’arrêt du traitement par le patient. Dans la pratique, il est très rare que le traitement dure plus de douze mois, mais la plupart du temps, il ne dure que six mois.
Environ 20 à 25% des cancers gastriques sont HER2-positifs. Conformément à l’étude TOGA, ces patients continuent de recevoir un traitement standard de première ligne à base de cisplatine, de 5FU (ou de capécitabine) et de trastuzumab [9]. Le degré d’amplification de HER2 a une certaine valeur prédictive pour la réponse au traitement et la survie. Le trastuzumab prolonge la survie de près de trois mois par rapport au cisplatine et à la combinaison 5FU/capécitabine plus placebo. Malheureusement, contrairement au cancer du sein, les nouvelles thérapies ciblant HER2 (comme le lapatinib ou le T-DM1) n’ont pas eu de succès, probablement en raison de l’expression fondamentalement plus faible de HER2 dans le cancer gastrique par rapport au cancer du sein.
La chimiothérapie a également sa place en deuxième ligne, car les taxanes et l’irinotécan ont tous deux montré un avantage en termes de survie globale dans des études de phase III (avec un nombre insuffisant de patients, toutefois). L’anticorps anti-VEGFR2 ramucirumab, administré en monothérapie par rapport à un placebo, prolonge également la survie des patients ayant progressé après un traitement de première ligne [10]. Ce résultat était surprenant, car les autres anticorps anti-VEGF n’ont eu aucun effet en monothérapie. Le ramucirumab a également prolongé la survie globale (de 7,4 à 9,6 mois, HR=0,807) en combinaison avec le paclitaxel (contre paclitaxel plus placebo) dans une étude de phase III, de sorte que cette substance est désormais autorisée en Suisse, seule et en combinaison avec le paclitaxel, après prétraitement [11].
Immunothérapie
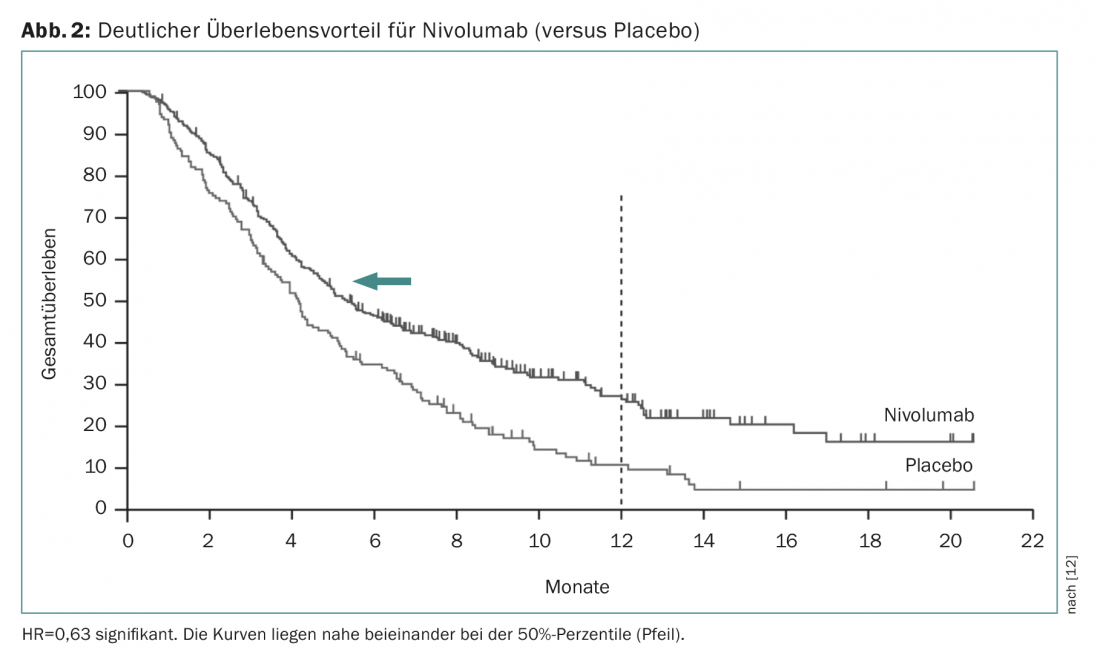
Le nivolumab est un anticorps monoclonal humain (inhibiteur de point de contrôle) qui se lie spécifiquement au récepteur PD1 sur les cellules T activées. Dans une étude de phase III (étude Attraction), ce traitement a démontré un gain de survie de 4,1 à 5,3 mois par rapport au placebo chez des patients prétraités [12]. Le rapport de risque était beaucoup plus net (0,63, significatif), ce qui montre que les durées moyennes de survie dépendent fortement de l’évolution des courbes de survie (Fig. 2). Le nivolumab est déjà autorisé au Japon dans cette indication. Comme les études ont été menées sur des patients asiatiques et que l’effet repose essentiellement sur un petit nombre de patients ayant bien répondu, il n’est actuellement pas encore certain que l’autorisation de mise sur le marché sera également accordée en Suisse. Le prembrolizumab est un autre inhibiteur de point de contrôle déjà largement utilisé en clinique. Ce dernier a désormais obtenu l’autorisation de mise sur le marché aux États-Unis sur la base d’une étude de phase II de plus grande envergure (étude KEYNOTE-059) si l’expression de PD-L1 est détectée dans le tissu tumoral (au moins dans 1% des cellules tumorales ou stromales). En règle générale, on peut s’attendre à une réponse chez 20% des patients avec une inhibition du point de contrôle. Bien qu’il existe des effets secondaires mortels, ces immunothérapies sont généralement très bien tolérées et apportent une amélioration clinique sensible et durable chez les quelque 20% de patients chez qui le traitement entraîne une réponse.
Test moléculaire
A l’ère des thérapies ciblées, la question se pose de savoir quel test spécifique est actuellement pertinent pour les tumeurs gastriques/GEJ. En dehors du test HER2, il faut certainement mentionner ici le test de l’instabilité des microsatellites en vue d’une inhibition des points de contrôle. Bien qu’il s’agisse d’un marqueur moins prédictif que l’instabilité des microsatellites, il est utile de tester l’expression de PD-L1 en vue d’une inhibition des points de contrôle, notamment en vue d’un traitement par pembrolizumab, comme nous l’avons déjà mentionné plus haut. Malgré des recherches intensives, d’autres changements moléculaires sont trop rares ou n’ont pas de conséquences thérapeutiques en pratique clinique pour le moment.
Résumé
La chirurgie est le premier choix pour le carcinome gastrique localisé. Dans ce contexte, l’utilisation de la thérapie systémique en péri- ou postopératoire peut améliorer les taux de guérison. La thérapie palliative systémique peut prolonger la vie et également améliorer la qualité de vie.
Messages Take-Home
- En situation curative, le traitement périopératoire par docetaxel, oxaliplatine et fluorouracil/leucovorine (FLOT) à partir du stade cT2 doit être discuté avec le patient.
- Traitement palliatif systémique : ces dernières années, seul le ramucirumab a reçu une autorisation de mise sur le marché en monothérapie ou en association. L’inhibition des points de contrôle est clairement efficace chez un petit nombre de patients. L’instabilité des microsatellites est de loin le meilleur facteur prédictif que l’expression de PD-L1.
Littérature :
- Macdonald JS, et al : Chimioradiothérapie après chirurgie comparée à la chirurgie seule pour l’adénocarcinome de l’estomac ou de la jonction gastro-œsophagienne. N Engl J Med 2001 ; 345 : 725-730.
- Al-Batran SE, et al. : Effet de la chimiothérapie néoadjuvante suivie d’une résection chirurgicale sur la survie des patients atteints de cancer gastrique ou de la jonction gastro-œsophagienne avec métastases limitées. L’essai AIO-FLOT3. JAMAOncology 2017 ; 3 : 1237-1244.
- Noh SH, et al : Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC) : 5-year follow-up of an open-label, randomised phase 3 trial. Lancet Oncol 2014 ; 15 : 1389-1396.
- Lee J, et al : Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection : the ARTIST trial. J Clin Oncol 2012 ; 30 : 268-273.
- Cunningham D, et al : Chimiothérapie périopératoire versus chirurgie seule pour les cancers gastro-oesophagiens résécables. N Engl J Med 2006 ; 355 : 11-20.
- Al-Batran SE, et al. : Chimiothérapie périopératoire par docétaxel, oxaliplatine et fluorouracil/leucovorine (FLOT) versus épirubicine, cisplatine et fluorouracil ou capécitabine (ECF/ECX) pour un adénocarcinome gastrique ou de la jonction gastro-œsophagienne (GEJ) résécable (FLOT4-AIO) : A multicenter, randomized phase 3 trial. ASCO Annual Meeting 2017 ; Oral Abstract Session 1.
- Al-Batran SE, et al. : The RENAISSANCE (AIO-FLOT5) trial : effect of chemotherapy alone vs. chemotherapy followed by ongical resection on survival and quality of life in patients with limited- metastatic adenocarcinoma of the stomach or esophagogastric junction – a phase III trial of the German AIO/CAO-V/CAOGI. BMC Cancer 2017 ; 17 : 893.
- Al-Batran SE, et al : Histopathological regression after neoadjuvant docetaxel, oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, and fluorouracil or capecitabine in patients with resectable gastric or gastro-oesophageal junction adénocarcinoma (FLOT4-AIO) : results from the phase 2 part of a multicentre, open-label, randomised phase 2/3 trial. Lancet Oncology 2016 ; 17 : 1697-1708.
- Bang YJ, et al : Trastuzumab en association avec la chimiothérapie versus chimiothérapie seule pour le traitement du cancer de la jonction gastrique ou gastro-œsophagienne avancé (ToGA) HER2-positif : une phase 3, open-label, randomisée contrôlée. Lancet 2010 ; 376 : 687-697.
- Fuchs CS, et al : Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD) : an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2014 Jan 4 ; 383(9911) : 31-39.
- Wilke H, et al : Ramucirumab plus paclitaxel versus placebo plus paclitaxel chez les patients atteints d’adénocarcinome avancé de la jonction gastrique ou gastro-oesophagienne précédemment traité (RAINBOW) : un essai de phase 3 randomisé en double aveugle. Lancet 2014 ; 15 : 1224-1235.
- Kang YK, et al : Nivolumab chez les patients atteints de cancer avancé de la jonction gastrique ou gastro-oesophagienne réfractaire à, ou intolérant à, au moins deux régimes de chimiothérapie antérieurs (ONO-4538-12, ATTRACTION-2) : un essai randomisé, en double aveugle, contrôlé par placebo, de phase 3. Lancet 2017 ; 390 : 2461-2471.
InFo ONKOLOGIE & HÉMATOLOGIE 2018 ; 6(3) : 14-17