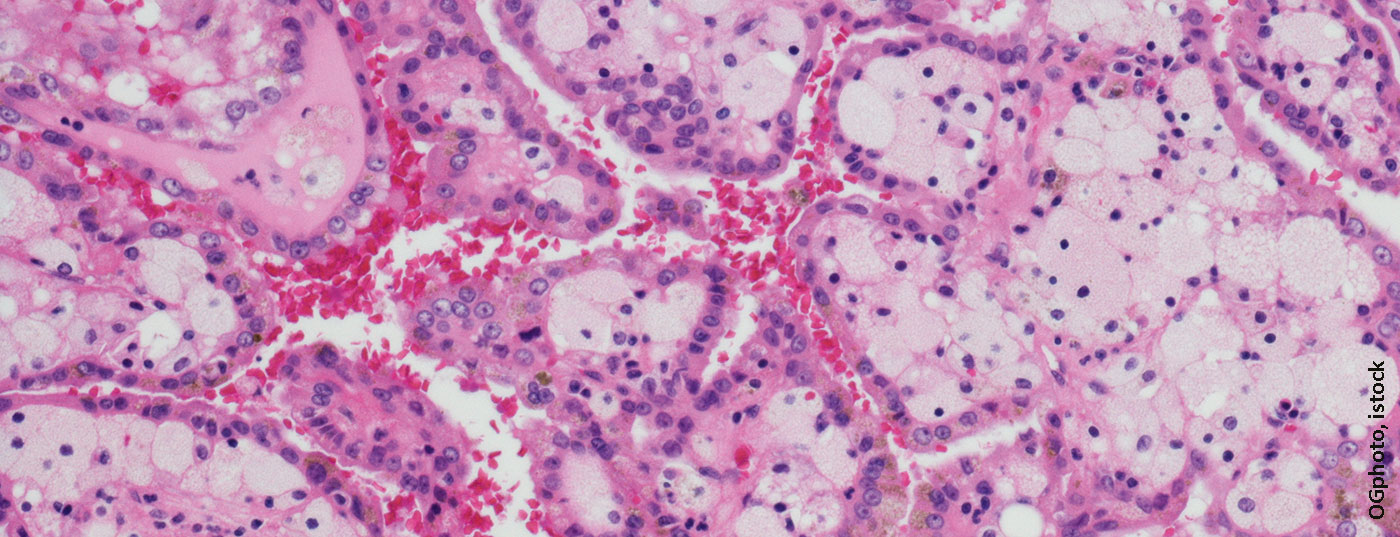
Le carcinome des cellules rénales est l’une des entités tumorales les plus rares. Par conséquent, pendant des années, les options de traitement étaient très limitées et la thérapie difficile. Entre-temps, les options ont pu être élargies grâce aux inhibiteurs de tyrosine kinase. Un traitement par des inhibiteurs de points de contrôle est également envisageable.
Le carcinome des cellules rénales est l’une des entités tumorales les plus rares en Suisse, représentant 2,4% des nouveaux cas de cancer annuels [1]. Le carcinome rénal à cellules claires est le plus grand sous-groupe de tous les carcinomes rénaux, avec environ 75% [2]. Les principaux facteurs de risque de développer une tumeur rénale sont la consommation de tabac, l’obésité, l’exposition professionnelle à des solvants, des produits pétroliers et des herbicides [3,4]. Environ 2% de tous les cancers des cellules rénales sont associés à des syndromes de prédisposition tumorale, comme la maladie de von Hippel-Lindau [5].
Dans environ 12% des nouveaux diagnostics, il s’agit d’une situation tumorale primitivement métastatique en raison de la présence de métastases à distance [6]. Pendant de nombreuses années, les options thérapeutiques du carcinome rénal métastatique étaient très limitées et le traitement difficile. En 2007, le sunitinib, une molécule du groupe des inhibiteurs de tyrosine kinase (ITK), a été utilisé pour la première fois en première ligne dans le traitement des métastases et a montré une augmentation de la survie sans progression (“progression-free survival”, PFS) et du taux de réponse par rapport à l’interféron alpha [7]. Un peu plus de 10 ans plus tard, l’étude de phase III CheckMate-214 a montré la supériorité de l’inhibiteur de point de contrôle (IPC) nivolumab associé à l’inhibiteur CTLA-4 ipilimumab par rapport au sunitinib, le traitement de référence en vigueur jusqu’alors [8]. Cette étude a été suivie par d’autres études, certaines portant sur l’IPC seul, d’autres sur des thérapies combinant l’IPC et l’ITK (figure 1). Dans cet article de FMC, nous nous concentrerons exclusivement sur le traitement du carcinome rénal à cellules claires en situation métastatique.
Classification des risques
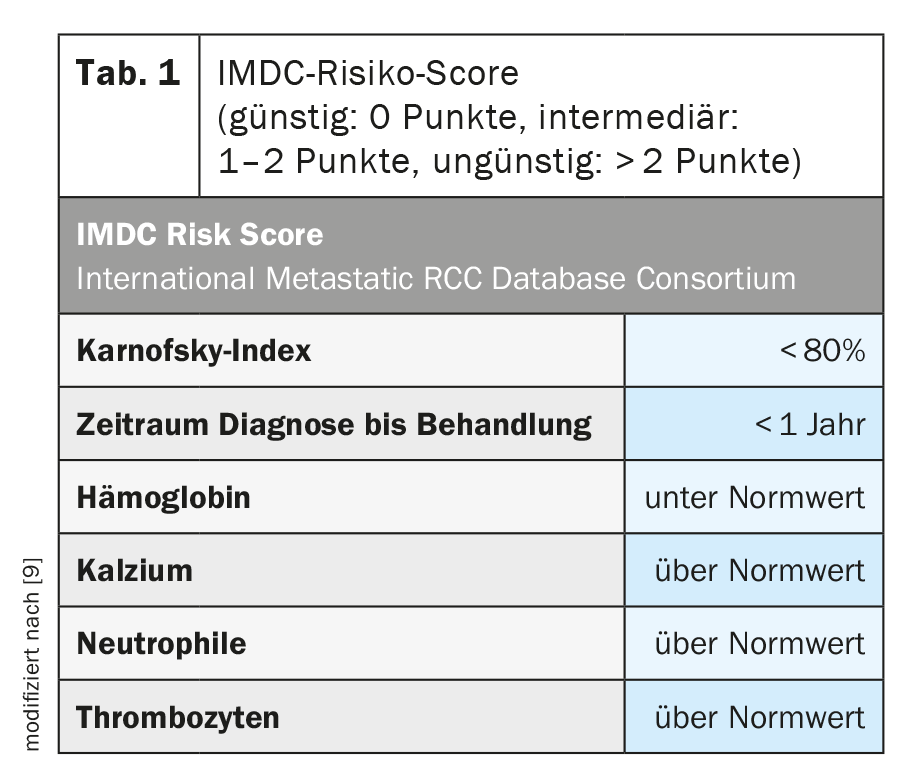
Une classification des risques a été développée pour mieux évaluer la situation tumorale ainsi que son pronostic (tableau 1). Selon le nombre de points obtenus dans le score de risque IMDC, la maladie peut être classée dans les groupes de risque suivants : favorable, intermédiaire ou défavorable. Cette classification n’est pas seulement importante pour l’évaluation du pronostic, elle a également été et est toujours utilisée dans les études cliniques de stratification et s’est avérée prédictive pour les interventions thérapeutiques. [10].
Traitement de première ligne
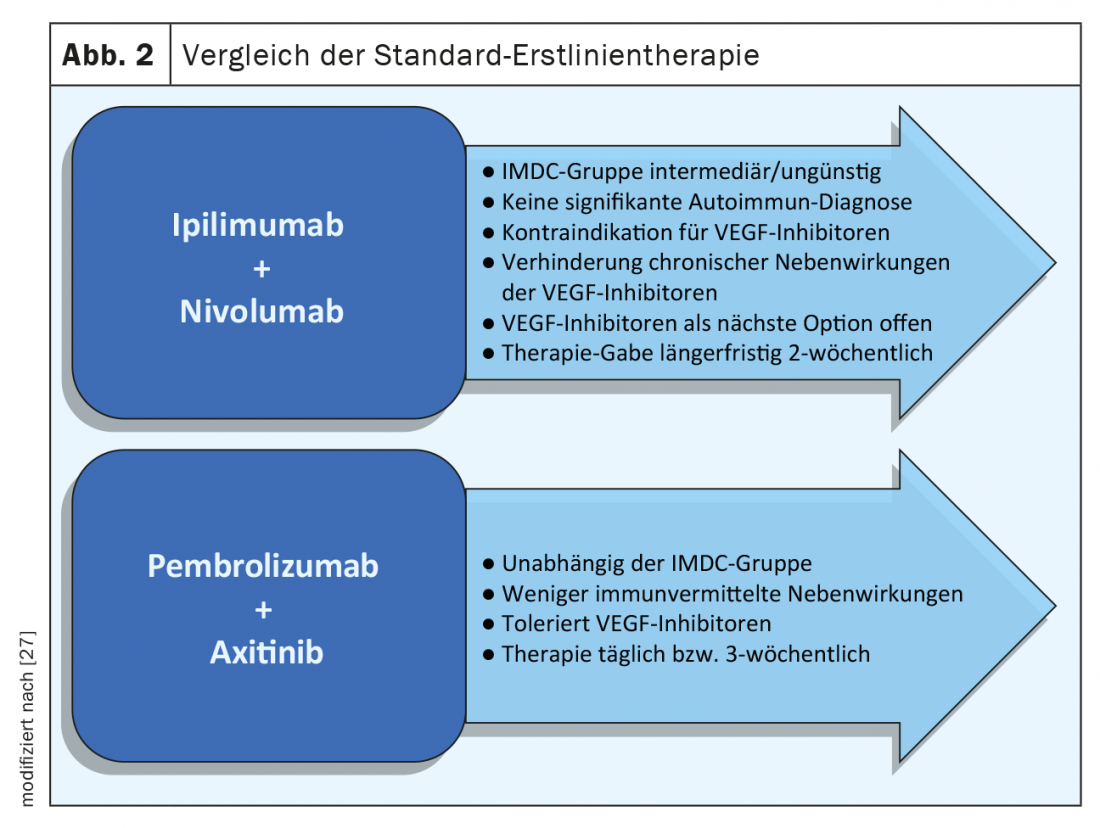
Le traitement du carcinome métastatique des cellules rénales a considérablement évolué ces dernières années grâce à l’utilisation de nouveaux médicaments issus de groupes de substances connues (par ex. les TKI), mais aussi grâce à l’application de nouvelles options thérapeutiques, comme l’immunothérapie. En 2018, l’étude CheckMate-214 a démontré une amélioration du taux de réponse objective et de la survie globale (“overall survival”, OS) avec l’ipilimumab en association avec le nivolumab par rapport au sunitinib. L’OS était de 47 mois dans le bras ipilimumab/nivolumab contre 26,6 mois dans le bras sunitinib, avec un hazard ratio (HR) de 0,66 (p<0,0001) [11]. Dans les analyses, cet effet thérapeutique se limite aux patients présentant un risque IMDC intermédiaire ou défavorable. Dans un contexte de risque favorable, le sunitinib présente un meilleur taux de réponse global et également un meilleur SG par rapport à l’immunothérapie.
D’autres études ont suivi dans le traitement de première ligne du carcinome métastatique des cellules rénales. L’étude Keynote-426 a comparé l’association de l’inhibiteur de PD-1 pembrolizumab et de l’ITK axitinib au sunitinib seul. L’association thérapeutique a permis d’améliorer de manière significative à la fois l’OS et la PFS par rapport au sunitinib (p<0,001) [12]. Ces résultats ont été observés dans les trois groupes de risque IMDC – favorable, intermédiaire et défavorable .
Dans les études Checkmate-214 et Keynote-426, une rémission complète (RC) a été observée à environ 9% dans les approches thérapeutiques avec immunothérapie.
Lors du congrès ESMO de cette année, les données de l’étude CheckMate 9ER ont été présentées, comparant le traitement combiné nivolumab et cabozantinib au sunitinib, également en première ligne de traitement [13]. Dans ce contexte, Choueiri et al. a montré que ce traitement combiné permettait d’obtenir une amélioration significative de la PFS, qui est passée de 8,3 mois (sunitinib en monothérapie) à 16,6 mois (nivolumab + cabozantinib). On a également constaté un allongement de l’OS avec un HR de 0,60. Le taux de réponse objective (“objective response rate”, ORR) a été particulièrement impressionnant, avec 55,7% dans le bras combiné contre 27,1% sous sunitinib. La période d’observation actuelle de 18 mois est encore relativement courte, de sorte qu’à l’heure actuelle, on ne sait pas encore dans quelle mesure la réponse au traitement est durable.
Les comparaisons entre ces trois études sont difficiles, car différents groupes pronostiques ont été inclus et la répartition des patients dans ces derniers était différente. Les temps d’observation diffèrent également considérablement. Les régimes combinés d’IPC et d’ITK (Keynote-426 et CheckMate 9ER) ont montré une différence de survie globale dès le premier mois, alors que la combinaison d’ipilimumab et de nivolumab n’a montré une différence qu’au bout de 6 mois. Par conséquent, en cas de pression thérapeutique élevée, la décision de traitement pourrait être prise en faveur d’un traitement combiné par ITK plutôt que d’une immunothérapie seule.
Pour le traitement de première ligne du carcinome rénal métastatique, il existe également des données d’étude sur le traitement par avelumab en combinaison avec axitinib (étude JAVELIN-Renal-101) [14]. Les résultats de l’étude ont montré que la PFS était plus longue que celle du sunitinib, mais que les données relatives à l’OS ne montraient pas cet avantage. Aucune autorisation de mise sur le marché n’est envisagée en Suisse pour la combinaison Avelumab + Axitinib.
Le traitement par un inhibiteur de tyrosine kinase seul reste une option en cas d’indisponibilité ou de contre-indication à l’une des nouvelles associations thérapeutiques de référence, en particulier pour les patients présentant un risque favorable et une dynamique très lente de la maladie.
Chez les patients bien sélectionnés, la surveillance active est également possible, comme le montre une publication de Rini et al. a été démontré : en médiane, les patients ont pu être suivis pendant 14,9 mois avant le début d’un traitement systémique [15].
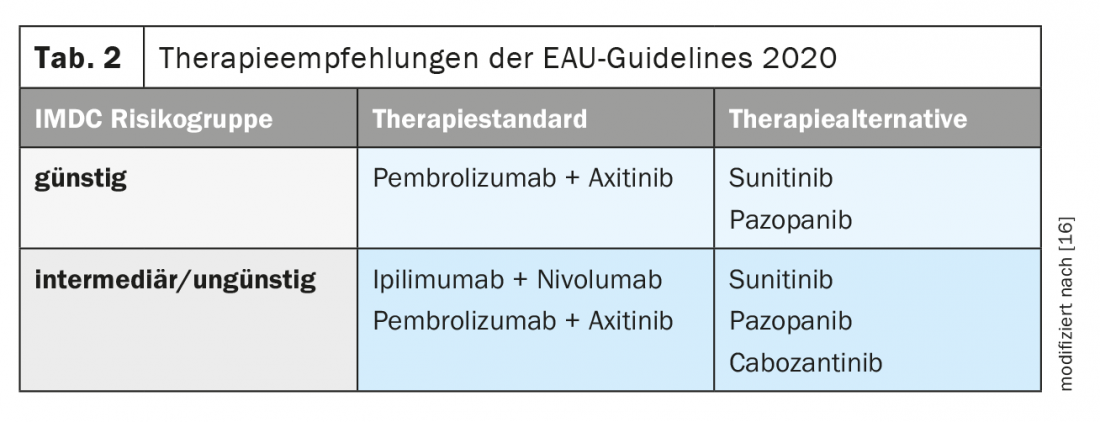
Des recommandations thérapeutiques ont été établies dans le guide actuel sur le carcinome rénal de l’Association européenne d’urologie (EAU) (tableau 2) [16].
Les résultats de l’étude de phase III CLEAR, qui compare l’association lenvatinib + évérolimus ou lenvatinib + pembrolizumab avec le sunitinib seul dans le traitement de première ligne du carcinome rénal métastatique, sont actuellement attendus. Le lenvatinib et l’inhibiteur de PD-1 ont montré des résultats prometteurs dans le cancer avancé de l’endomètre dans une étude publiée cette année [17].
Traitement de deuxième intention
Le choix de la classe de substances pour la thérapie en deux lignes dépend directement du traitement de première ligne déjà administré. L’étude de phase III Checkmate-025 a comparé le nivolumab à l’évérolimus après 1 ou 2 traitements ciblés par VEGF antérieurs. L’immunothérapie a permis d’améliorer à la fois l’OS et la qualité de vie. En outre, le traitement par nivolumab a entraîné moins de toxicité de grade 3/4 que l’évérolimus (19% contre 37%). Aucune amélioration de la PFS n’a été observée [18]. Une amélioration comparable de l’OS, c’est-à-dire d’environ 5 mois, a également été démontrée avec le cabozantinib par rapport au traitement par évérolimus (étude Meteor) [19].
L’influence d’un traitement de première ligne par des inhibiteurs de points de contrôle sur les traitements systémiques ultérieurs n’est pas claire, car il n’existe pas encore de données d’études randomisées à ce sujet. Cependant, une étude de phase II (CaboPoint) est actuellement en cours de recrutement en Suisse, dans laquelle le cabozantinib est étudié en tant que traitement de deuxième ligne – dans la cohorte A après le traitement de première ligne par ipiliumumab et nivolumab, et dans la cohorte B en cas de progression vers un traitement combiné IPC et thérapie ciblée sur le VEGF.
De même, dans une étude de phase III également accessible en Suisse, la molécule MK-6482 PN011 – un inhibiteur de HIF-2α – est comparée au cabozantinib en combinaison avec le lenvatinib en tant que traitement en deux lignes. Le HIF, en tant que facteur induit par l’hypoxie, est impliqué dans l’expression des facteurs de croissance du VEGF.
Des données d’une étude de phase II sur le lenvatinib + pembrolizumb après progression sous traitement par IPC PD-1/PD-L1 ont été présentées à l’ASCO 2020. L’ORR à 24 semaines était de 55% (irRECIST selon l’évaluation de l’investigateur) et la PFS de 11,7 mois. Ce traitement semble donc prometteur même après une immunothérapie préalable [20].
Profil des effets secondaires
En raison des différents mécanismes d’action des classes de substances utilisées dans le carcinome métastatique des cellules rénales, les profils d’effets secondaires sont également différents. Dans le cas des immunothérapies, il s’agit d’effets secondaires dits à médiation immunitaire, des réactions étant possibles dans les organes les plus divers et les effets secondaires pouvant parfois être graves. Il est essentiel de les connaître, de les reconnaître et de les traiter rapidement. Les effets secondaires rares, tels que la myocardite et la neurotoxicité, doivent être pris en compte [21,22]. L’administration d’immunothérapies et le suivi des patients doivent donc être effectués par une équipe de médecins expérimentés, une approche interdisciplinaire étant généralement la plus efficace. L’étude CheckMate-214 a montré que la qualité de vie liée à la santé était meilleure chez les patients traités par ipilimumab + nivolumab par rapport au sunitinib seul [23]. En conséquence, l’incidence des effets secondaires de grade 3/4 était plus élevée avec le sunitinib. Les effets secondaires les plus fréquents des ITK sont la diarrhée, la toxicité cutanée, la fatigue et d’éventuelles modifications hématologiques et cardiaques.
Outre les différentes classes de substances, il existe également des différences dans l’application et les intervalles de traitement. Alors que pour l’ipilimumab/nivolumab, on passe à une administration de nivolumab seul au bout de trois mois, les traitements combinés IPC et ITK impliquent une prise continue de comprimés avec un traitement supplémentaire par perfusion, dont les toxicités à long terme doivent être prises en compte. Le traitement par comprimés est facile à contrôler et les effets secondaires sont généralement rapidement réversibles après l’arrêt du traitement (figure 2). Pour aider les patients et améliorer l’adhérence et la sécurité, des fiches d’information de la Société suisse d’oncologie médicale (SSOM) et de Soins en oncologie Suisse (SOS) peuvent être utilisées [24].
Marqueurs moléculaires
Les marqueurs moléculaires pourraient aider à faire le meilleur choix thérapeutique face à la diversité des options de traitement. Cependant, à part le score de risque IMDC, il n’existe pas encore de marqueur prédictif reconnu qui puisse être utilisé dans la prise de décision.
Selon les données de Checkmate-214, l’expression de PD-L1 semble être un facteur déterminant pour la réponse au traitement par ipilimumab/nivolumab (expression de PD-L1 <1% : ORR 37% ; expression de PD-L1 ≥1% : ORR 54%) et pour la PFS (expression de PD-L1 <1% : PFS 11 mois ; expression PD-L1 ≥1% : PFS 22,8 mois est prédictive [10]. Cependant, aucune différence n’a été constatée en ce qui concerne le système d’exploitation. Ainsi, la place de -PD-L1 continue de faire l’objet de controverses. Dans l’étude Keynote 426 comme dans l’étude CheckMate 9ER, aucun lien n’a été observé jusqu’à présent entre le niveau d’expression de PD-L1 et la réponse au traitement.
L’étude IMmotion151 a comparé l’atezolizumab/bevacizumab au sunitinib [25]. Les analyses de biomarqueurs ont également été effectuées, mais aucun lien n’a pu être établi entre la PFS et le “Tumor mutational burden” (TMB). Cependant, il a été démontré que des signatures d’expression génique spécifiques sont associées à des effets thérapeutiques. Par exemple, la détection d’une signature d’angiogenèse était corrélée à la réponse au sunitinib. En revanche, en cas de signature de l’effecteur T, l’immunothérapie par atezolizumab a montré un bénéfice [26]. L’étude BIONIKK, une étude prospective randomisée de phase II présentée à l’ESMO cette année, a examiné différents groupes moléculaires en ce qui concerne la réponse thérapeutique aux différentes substances thérapeutiques. Les résultats ont montré une meilleure réponse des tumeurs “immuno-haute” à l’immunothérapie par nivolumab et des tumeurs “angio-haute” au traitement par ITK. Ces études moléculaires semblent prometteuses et seront probablement disponibles à l’avenir pour aider au choix du traitement.
En plus de ces marqueurs moléculaires de la tumeur, la décision de traitement prend actuellement en compte des facteurs liés au patient, tels que l’âge, les comorbidités et les préférences.
Messages Take-Home
- Le standard thérapeutique actuel dans le traitement de première ligne du carcinome rénal à cellules claires métastatique est pembrolizumab/axitinib pour tous les groupes à risque et ipilimumab/nivolumab pour les patients à risque intermédiaire ou défavorable (IMDC).
- Une surveillance active peut être mise en place chez des patients sélectionnés et une monothérapie par un inhibiteur de tyrosine kinase peut être envisagée si le risque est favorable.
- De nouvelles données sont disponibles pour le nivolumab en combinaison avec le cabozantinib, bien qu’une autorisation de mise sur le marché en Suisse fasse encore défaut.
- Le profil d’effets secondaires des différents médicaments diffère et peut être déterminant pour le choix du traitement.
- Les études sur les signatures d’expression génique montrent des réponses thérapeutiques différentes et sont prometteuses.
Littérature :
- Ligue suisse contre le cancer : Le cancer en Suisse : chiffres clés. Situation en mars 2020. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- Linehan WM, et al. Clin Cancer Res. 2007;13 : 671s-679s.
- Gelfond J, et al : Modifiable risk factors to reduce renal cell carcinoma incidence : Insight from the PLCO trial. Urol Oncol, 2018. 36(7) : 340.e1-340.e6.
- McLaughlin JK, Lipworth L : Aspects épidémiologiques du cancer des cellules rénales. Semin Oncol, 2000. 27(2) : 115-123.
- Shuch B, Zhang J : Prédisposition génétique au carcinome des cellules rénales : implications pour le conseil, le test, le dépistage et la prise en charge. J Clin Oncol, 2018 : Jco2018792523.
- Siegel RL, Miller KD, Jemal A : Cancer statistics, 2020. CA Cancer J Clin, 2020. 70(1) : 7-30.
- Motzer RJ, et al : Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med, 2007. 356(2) : 115-124.
- Motzer RJ, et al : Nivolumab plus ipilimumab versus sunitinib dans le carcinome avancé des cellules rénales. N Engl J Med, 2018. 378(14) : 1277-1290.
- Heng DY, et al : Facteurs pronostiques pour la survie globale chez les patients atteints de carcinome rénal métastatique traités par des agents ciblant le facteur de croissance de l’endothélium vasculaire : résultats d’une grande étude multicentrique. J Clin Oncol, 2009. 27(34) : 5794-5799.
- Méjean A, et al : Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. N Engl J Med, 2018. 379(5) : 417-427.
- Motzer RJ, et al : Nivolumab plus ipilimumab versus sunitinib en traitement de première ligne du carcinome rénal avancé : suivi étendu de l’efficacité et de la sécurité des résultats d’un essai randomisé, contrôlé, de phase 3. Lancet Oncol, 2019. 20(10) : 1370-1385.
- Rini BI, et al : Pembrolizumab plus Axitinib versus Sunitinib pour le carcinome avancé des cellules rénales. N Engl J Med, 2019. 380(12) : 1116-1127.
- Choueiri TK : 696O_PR- Nivolumab + cabozantinib vs sunitinib en traitement de première ligne du carcinome rénal avancé : premiers résultats de l’essai randomisé de phase 3 CheckMate 9ER. 2020 : ESMO.
- Motzer RJ, et al : Avelumab plus Axitinib versus Sunitinib pour le carcinome avancé des cellules rénales. N Engl J Med, 2019. 380(12) : 1103-1115.
- Rini BI, et al : Active surveillance in metastatic renal-cell carcinoma : a prospective, phase 2 trial. Lancet Oncol, 2016. 17(9) : 1317-1324.
- Ljungberg, EAU-Guidelines on Renal Cell Carcinoma. 2020 : https://uroweb.org/guideline/renal-cell-carcinoma.
- Makker V, et al : Lenvatinib Plus Pembrolizumab in Patients With Advanced Endometrial Cancer. J Clin Oncol, 2020. 38(26) : 2981-2992.
- Motzer RJ, et al : Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med, 2015. 373(19) : 1803-1813.
- Choueiri TK, et al : Cabozantinib versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med, 2015. 373(19) : 1814-1823.
- Chung-Han L : Phase II trial of lenvatinib (LEN) plus pembrolizumab (PEMBRO) for disease progression after PD-1/PD-L1 immune checkpoint inhibitor (ICI) in metastatic clear cell renal cell carcinoma (mccRCC). 2020 : Journal of Clinical Oncology.
- Bonaca MP, et al : Myocarditis in the Setting of Cancer Therapeutics : Proposed Case Definitions for Emerging Clinical Syndromes in Cardio-Oncology. Circulation, 2019. 140(2) : 80-91.
- Astaras C, et al : Neurological Adverse Events Associated with Immune Checkpoint Inhibitors : Diagnosis and Management. Curr Neurol Neurosci Rep, 2018. 18(1) : 3.
- Cella D, et al : Patient-reported outcomes of patients with advanced renal cell carcinoma treated with nivolumab plus ipilimumab versus sunitinib (CheckMate 214) : a randomised, phase 3 trial. Lancet Oncol, 2019. 20(2) : 297-310.
- https://oraletumortherapie.ch.
- Rini BI, et al : Atezolizumab plus bevacizumab versus sunitinib chez les patients atteints de carcinome rénal métastatique précédemment non atteint (IMmotion151) : un essai contrôlé multicentrique, en ouvert, phase 3, randomisé. Lancet, 2019. 393(10189) : 2404-2415.
- McDermott DF, et al. : Activité clinique et corrélations moléculaires de la réponse à l’atezolizumab seul ou en combinaison avec le bevacizumab versus sunitinib dans le carcinome cellulaire rénal. Nat Med, 2018. 24(6) : 749-757.
- Heng DY : ASCO 2020.
InFo ONKOLOGIE & HÉMATOLOGIE 2020 ; 8(6) : 6-9