L’histologie (résection de la tumeur ou biopsie) est essentielle pour établir le diagnostic et évaluer le pronostic et le traitement des gliomes de haut grade. Les marqueurs moléculaires servent de complément à la classification de l’OMS concernant l’évolution attendue de la maladie et la réponse thérapeutique à la chimiothérapie alkylante. Le traitement standard pour les patients de moins de 65 ou 70 ans consiste en une radiothérapie et une chimiothérapie combinées avec du temozolomide concomitant et adjuvant (TMZ). Les patients de plus de 65 ou 70 ans ont un avantage de survie avec une chimiothérapie avec TMZ en cas de promoteur MGMT méthylé ; sans promoteur MGMT méthylé, une radiothérapie seule est recommandée. Pour les oligodendrogliomes anaplasiques et les oligoastrocytomes avec codélétion 1p/19q, il existe un avantage de survie en cas de chimiothérapie alkylante précoce (PCV ou TMZ).
Les gliomes anaplasiques et les glioblastomes font partie des tumeurs cérébrales malignes les plus courantes. Ils se caractérisent par un pronostic défavorable. Pour établir le diagnostic, il est nécessaire de procéder à une confirmation histologique via un prélèvement de tissu chirurgical. Pour tous les gliomes malins, en raison d’un pronostic plus favorable, il convient de viser un taux d’exérèse élevé, dans la mesure du possible, sans pour autant accepter un déficit neurologique permanent. Selon la classification de l’OMS (2007), les tumeurs cérébrales sont classées de grade I à IV selon des critères anatomopathologiques. L’objectif de cette classification est de fournir un guide sur le pronostic, l’évolution clinique et les options thérapeutiques fondées sur des preuves en fonction du degré de malignité.
Marqueurs moléculaires
Ces dernières années, des marqueurs moléculaires ont été identifiés pour caractériser des sous-types de gliomes ayant un pronostic et une réponse aux traitements différents. Un marqueur ayant une valeur pronostique informe sur le pronostic de la maladie, indépendamment de la thérapie mise en œuvre. Un marqueur à valeur prédictive, qui prédit la réponse à un traitement donné, est particulièrement pertinent pour les décisions cliniques.
- Codélation 1p/19q : un marqueur moléculaire étroitement associé aux tumeurs oligodendrogliales est la perte combinée des bras chromosomiques 1p et 19q (“perte d’hétérozygosité”, LOH-1p/19q, codélétion 1p/19q).
- Promoteur de la MGMT : un autre marqueur important est le statut de méthylation du promoteur de l’O6-méthylguanine-ADN-méthyltransférase (MGMT). MGMT est une protéine de réparation de l’ADN qui réduit les effets de la chimiothérapie alkylante. En cas de méthylation du promoteur, le gène MGMT est exprimé de manière réduite, ce qui améliore relativement l’efficacité de la chimiothérapie alkylante. Un promoteur MGMT méthylé a une valeur pronostique favorable pour les gliomes de grade III et IV de l’OMS et, selon le sous-groupe, est également prédictif d’un avantage de survie en cas de chimiothérapie alkylante.
- Mutation IDH : une mutation dans le gène de l’isocitrate déshygénase (IDH)-1 ou -2 est un marqueur pronostique favorable pour toutes les entités gliales. Les patients atteints d’astrocytome anaplasique sans mutation IDH (IDH sauvage) ont un pronostic moins favorable que les patients atteints de glioblastome avec mutation IDH [1]. On pense que les glioblastomes mutés par l’IDH sont issus d’une progression maligne à partir de tumeurs de grade II ou III (glioblastomes secondaires), par opposition aux glioblastomes primaires, qui sont caractérisés par le type sauvage de l’IDH et constituent probablement une entité biologiquement différente.
Nous allons maintenant donner un aperçu des options thérapeutiques actuelles en tenant compte de la classification de l’OMS, des marqueurs moléculaires ainsi que de l’âge des patients ; une proposition de parcours décisionnel clinique est résumée dans les figures 1 et 2 .


Oligodendrogliomes et oligoastrogliomes anaplasiques de grade III de l’OMS
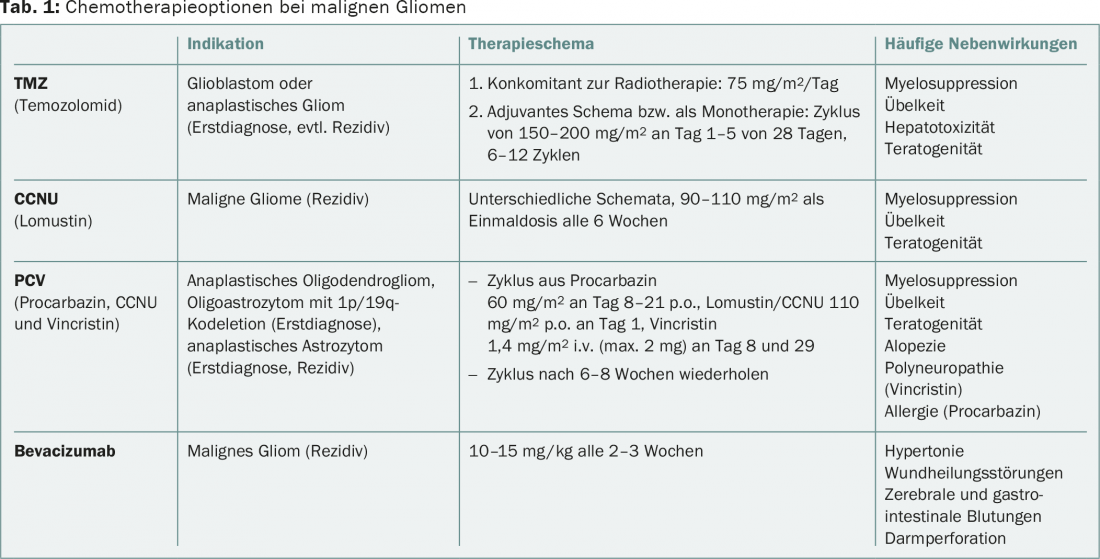
La présence d’une codélétion 1p/19q, strictement associée à la mutation IDH, est déterminante pour la décision thérapeutique dans les gliomes anaplasiques d’origine oligodendrogliale. Ces patients bénéficient, selon les suivis à long terme des études RTOG-9402 et EORTC-26951, d’une combinaison de radiothérapie et de chimiothérapie avec procarbazine, lomustine (CCNU) et vincristine (schéma PCV) au moment du diagnostic initial, par rapport à la radiothérapie seule [2,3]. Les données de l’étude NOA-04 montrent une efficacité égale des régimes contenant respectivement le PCV et le PCV. avec le temozolomide (TMZ) dans les gliomes anaplasiques dans leur ensemble. En raison de la toxicité du schéma PCV, le TMZ, mieux toléré, est souvent préféré. Il est peu probable, au vu des données disponibles, qu’une chimiothérapie alkylante seule soit équivalente à une combinaison directe de chimiothérapie et de radiothérapie en première ligne. En cas de chimiothérapie seule lors du diagnostic initial, une radiothérapie doit être administrée en cas de progression de la tumeur. En outre, il n’existe pas de recommandations thérapeutiques standardisées pour la récidive tumorale. Les options pour le glioblastome peuvent également être appliquées (tableau 1).
Astrocytomes anaplasiques, grade III de l’OMS
Selon l’étude NOA-04, pour le traitement de première ligne, une chimiothérapie avec TMZ ou PCV suivie d’une radiothérapie en cas de récidive est équivalente à une radiothérapie primaire suivie de TMZ ou PCV en cas de récidive. Pour les patients atteints de gliome anaplasique sans codélétion 1p/19q, une étude de phase III évalue actuellement le rôle de la chimiothérapie par TMZ en plus de la radiothérapie en première ligne (étude CATNON). La codélétion 1p/19q, la méthylation du promoteur MGMT et la mutation IDH sont des biomarqueurs pronostiques et peuvent être utiles pour distinguer les tumeurs oligodendrogliales (1p/19q) et les glioblastomes (IDH). De plus, dans les gliomes anaplasiques sans mutation IDH, un promoteur MGMT méthylé est prédictif d’une survie sans progression prolongée en cas de chimiothérapie alkylante avec ou sans radiothérapie. Il n’y a pas de recommandations précises concernant la récidive de la tumeur après radiothérapie et chimiothérapie par TMZ ou PCV, les options sont les mêmes que pour la récidive du glioblastome.
Glioblastomes, grade IV de l’OMS
Les facteurs pronostiques défavorables dans le cas des glioblastomes sont un âge avancé, un mauvais statut de performance de Karnofsky, un faible degré d’exérèse, l’absence de mutation IDH et un promoteur MGMT non méthylé. Le traitement de première ligne reste la radiothérapie établie depuis l’étude EORTC-NCIC avec une chimiothérapie concomitante et adjuvante avec TMZ [4]. Une méthylation du promoteur MGMT est en outre prédictive d’une bonne réponse à la radiochimiothérapie. Pour les patients âgés de plus de 65 ou 70 ans sans stratification selon le profil moléculaire, aucun avantage cliniquement pertinent de la radiochimiothérapie combinée n’a été démontré à ce jour, compte tenu de la toxicité élevée du régime chez les patients âgés. Pour les patients âgés ayant un promoteur MGMT méthylé, un avantage de survie a été démontré avec une monothérapie par TMZ par rapport à la radiothérapie [5,6]. En l’absence de connaissance du statut MGMT ou en cas de promoteur MGMT non méthylé, le traitement de choix chez les patients âgés est la radiothérapie exclusive avec un protocole hypofractionné (10× 3,4 Gy), qui est équivalent ou éventuellement supérieur à la radiothérapie fractionnée conventionnelle [6].
Le bevacizumab, un anticorps dirigé contre le “Vascular endothelial growth factor” (VEGF), n’a pas montré d’effet sur la survie globale dans deux études randomisées de phase III [7,8].
Fin 2014, les résultats de l’étude de phase III EF-14 ont été présentés. Elle a montré un avantage de survie de 19,6 vs. 16,6 mois en ajoutant NovoTTF-100A (Tumor Treating Fields) au traitement standard [9]. La thérapie consiste en des champs électriques alternatifs appliqués à l’aide d’un masque sur la tête pendant au moins 18 heures par jour. La place de NovoTTF dans le traitement de première ligne du glioblastome en pratique clinique quotidienne fait actuellement l’objet d’un débat au sein de la communauté scientifique et des autorités réglementaires.
En cas de progression de la tumeur, les options thérapeutiques sont limitées, non standardisées et peu fondées sur des preuves. Une nouvelle résection peut être utile chez les patients jeunes, en bon état général et avec une localisation tumorale favorable. Les chimiothérapies utilisées sont les nitroso-urées comme la lomustine/CCNU, à nouveau le TMZ ou le bevacizumab (tableau 1). Pour plus d’informations, consultez les lignes directrices de l’Association européenne de neuro-oncologie (EANO) [10].
Thérapies de soutien
Pour la prise en charge des gliomes, outre le traitement spécifique de la tumeur, l’utilisation optimale de corticostéroïdes, de médicaments anticonvulsivants et d’un accompagnement psycho-oncologique est très importante. Les stéroïdes (dexaméthasone jusqu’à 16 mg maximum en dose unique le matin) peuvent être utiles en cas d’aggravation clinique ou de pression intracrânienne ainsi que pendant la radiothérapie. Pour éviter les effets secondaires, il est préférable de limiter l’utilisation dans le temps en fonction de la clinique. En ce qui concerne le traitement anticonvulsivant, les substances non inductrices d’enzymes telles que le lévétiracétam ou la lamotrigine sont à privilégier. L’acide valproïque, un inhibiteur enzymatique, est également très puissant dans la prévention des crises et des effets antitumoraux directs sont également discutés.
Perspectives
Dans les études cliniques actuelles, ce sont surtout les approches immunothérapeutiques qui sont prometteuses. Les études de vaccination utilisent des vaccins avec des cibles spécifiques aux tumeurs, par exemple le variant du récepteur EGFR EGFRvIII (étude ACT-IV, phase III) ou avec des combinaisons d’antigènes associés aux tumeurs (étude ICT-107 phase II), ou des approches basées sur les cellules, y compris les cellules dendritiques activées. Parmi les thérapies immunomodulatrices, il convient de mentionner les inhibiteurs de la voie de signalisation Programmed death-1 ou du ligand. Malgré les progrès réalisés dans la compréhension de la biologie moléculaire du glioblastome, il est nécessaire de poursuivre le développement de thérapies translationnelles efficaces afin d’améliorer les options thérapeutiques qui restent limitées.
Littérature :
- Hartmann C, et al : Long-term survival in primary glioblastoma with versus without isocitrate dehydrogenase mutations. Clin Cancer Res 2013 ; 19(18) : 5146-5157.
- van den Bent MJ, et al : Adjuvant Procarbazine, Lomustine, and Vincristine Chemotherapy in Newly Diagnosed Anaplastic Oligodendroglioma : Long-Term Follow-Up of EORTC Brain Tumor Group Study 26951. Journal of Clinical Oncology 2013 ; 31(3) : 344-350.
- Cairncross G, et al : Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma : long-term results of RTOG 9402. J Clin Oncol 2013 ; 31(3) : 337-343.
- Stupp R, et al : Radiothérapie plus concomitant et adjuvant temozolomide pour le glioblastome. N Engl J Med 2005 ; 352(10) : 987-996.
- Wick W, et al : Temozolomide chimiotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly : the NOA-08 randomised, phase 3 trial. Lancet Oncol 2012 ; 13(7) : 707-715.
- Malmström A, et al : Temozolomide versus radiothérapie standard de 6 semaines versus radiothérapie hypofractionnée chez les patients âgés de plus de 60 ans atteints de glioblastome : l’essai randomisé nordique de phase 3. Lancet Oncol 2012 ; 13(9) : 916-926.
- Chinot OL, et al : Bevacizumab plus radiotherapy- temozolomide for newly diagnosed glioblastoma. N Engl J Med 2014 ; 370(8) : 709-722.
- Gilbert MR, et al : A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med 2014 ; 370(8) : 699-708.
- Stupp R, et al : NT-40 Interim Analysis of the EF-14 Trial : A Prospective, Multi-center Trial of NovoTTF-100A Together With Temozolomide Compared to Temozolomide Alone in Patients with Newly Diagnosised GBM. Neuro-Oncology 2014 ; 16 (suppl 5) : v167.
- Weller M, et al : EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol 2014 ; 15(9) : e395-403.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(3-4) : 24-27