Lors du premier symposium suisse sur les tumeurs malignes péritonéales et les HIPEC à Saint-Gall, des experts ont abordé les thèmes du cancer de l’ovaire et du cancer colorectal métastasé. Il s’agissait des options de traitement actuelles et potentiellement futures. Quelle est la valeur de positionnement du bevacizumab ? Quelles sont les possibilités de thérapie individualisée ? Et quels sont les marqueurs prédictifs confirmés qui doivent guider la décision thérapeutique ?
Le traitement oncologique du cancer de l’ovaire est régi par les mêmes principes que ceux appliqués aux cancers de la trompe et du péritoine. Selon le professeur Beat Thürlimann de l’hôpital cantonal de Saint-Gall, il existe des normes bien établies, mais peu de normes d’or. Ce sont de tels :
- Chirurgie optimale avec débullage
- Chimiothérapie de première ligne : à base de platine
- Chimiothérapie de deuxième ligne : traitement combiné à base de platine
- Chirurgie palliative.
Les tendances relativement nouvelles sont le bevacizumab après débulking primaire en complément de la chimiothérapie (disponible), ainsi que le cediranib et l’olaparib (bientôt disponibles) dans les formes progressives sensibles au platine.

Bevacizumab (anti-VEGF) : l’étude ICON7 (phase III) a évalué l’innocuité et l’efficacité du bevacizumab en complément de la chimiothérapie standard par carboplatine et paclitaxel chez 1 528 femmes atteintes d’un cancer de l’ovaire récemment diagnostiqué (stade FIGO I-IIA [klarzellig oder Grad 3] ou stade FIGO IIB-IV). Après que l’analyse primaire [1] de la survie sans progression ait démontré le bénéfice de l’adjonction, en particulier chez les femmes à haut risque de progression, les résultats finaux concernant la survie globale ont été présentés au congrès ECC 2013 : Alors que dans l’ensemble de la population, aucune différence significative n’a pu être démontrée entre le groupe de contrôle et le groupe d’étude, le sous-groupe à haut risque de progression (stade III “debulked” suboptimal, stade IV et patientes non opérées) a de nouveau été particulièrement bénéfique : la survie globale s’y est améliorée de manière significative.
L’étude AURELIA a été la première étude randomisée à analyser l’ajout de bevacizumab à la chimiothérapie dans une population de cancers de l’ovaire résistants au platine. Les participantes avaient déjà suivi deux ou plusieurs traitements contre le cancer. Ils ont été randomisés pour recevoir soit une chimiothérapie (paclitaxel, topotécan, “pégylé liposomal doxorubicine” [PLD]), soit du bevacizumab plus chimiothérapie, jusqu’à progression ou toxicité insoutenable. Le résultat a été que l’ajout de bevacizumab a significativement prolongé la survie sans progression d’environ trois mois. En revanche, le bénéfice en termes de survie globale (également d’environ trois mois) n’a pas atteint la significativité statistique, comme l’a souligné une autre présentation au congrès ECC 2013.
Cédiranib (anti-VEGF) : l’étude ICON6 (phase III) a évalué le cédiranib dans le traitement du cancer de l’ovaire sensible au platine et en rechute. Les participants avaient donc déjà reçu une chimiothérapie de première ligne à base de platine et, après une nouvelle récidive, ils prenaient soit une chimiothérapie seule (bras A) ou chimiothérapie plus cediranib (bras B et C). De plus, une phase de maintenance avec le cediranib a été mise en place dans le troisième groupe d’étude (bras C) et dans les deux autres (bras A et bras B). B) une initiée avec un placebo.
Il s’est avéré que la chimiothérapie plus cediranib suivie d’un maintien du cediranib offrait un bénéfice significatif en termes de survie pour cette population (par rapport à la chimiothérapie seule). En outre, il existe de fortes preuves d’un effet du cediranib sur la survie sans progression pendant et après la chimiothérapie.
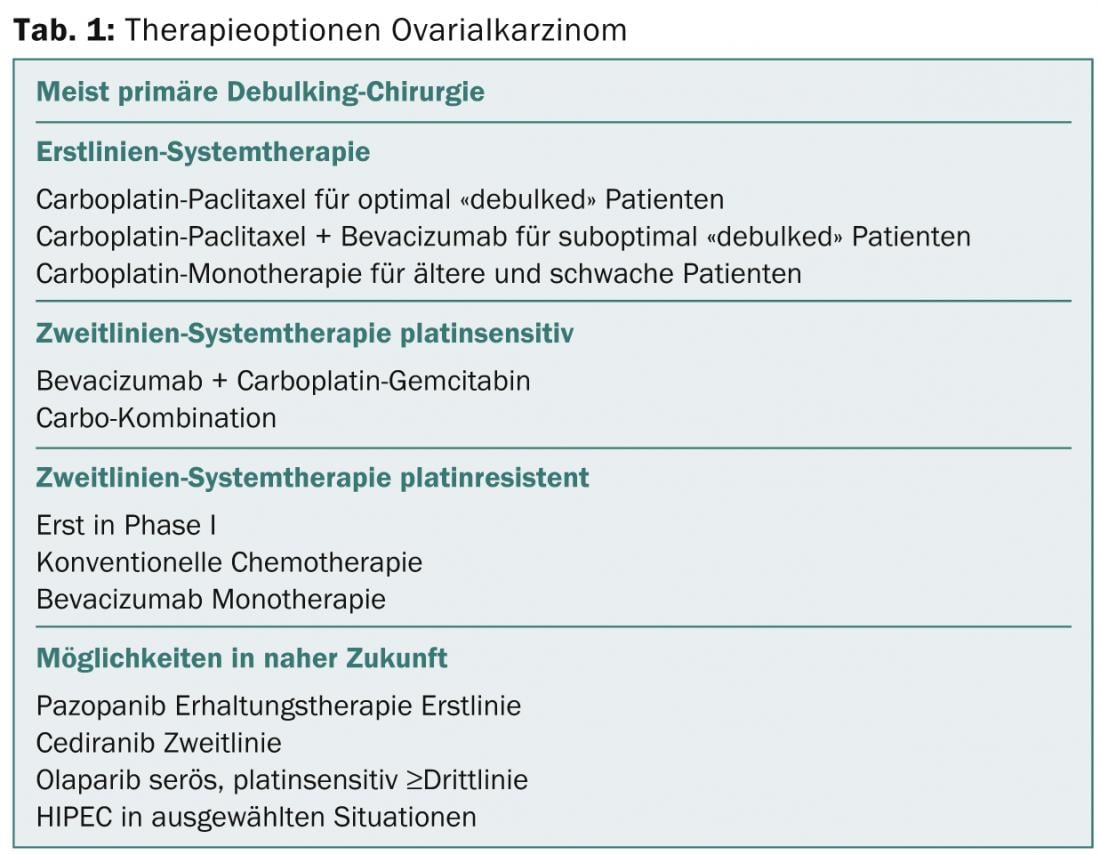
“Il existe donc de nombreuses possibilités de traitement du cancer primaire de l’ovaire. Les options thérapeutiques sont de plus en plus nombreuses, mais en fin de compte, c’est toujours une question de coût”, conclut le professeur Thürlimann. Le tableau 1 en donne un aperçu.
CRC péritonéal métastasé
Les progrès dans le cancer colorectal métastatique (mCRC) sont principalement dus à une chirurgie plus agressive, à un meilleur traitement systémique et à une collaboration plus étroite entre l’oncologie et la chirurgie.
Le professeur Ulrich Güller, de l’hôpital cantonal de Saint-Gall, a tout d’abord abordé le traitement systémique : “La chimiothérapie conventionnelle est aujourd’hui réalisée avec succès en monothérapie ou en traitement combiné à l’aide des substances actives 5-fluorouracile (5-FU), capécitabine (préparation orale de 5-FU), irinotécan et oxaliplatine. Mais nous avons toujours besoin de nouvelles cibles, et nous ne les trouverons que si nous comprenons mieux et de manière plus détaillée la prolifération des cellules tumorales”.
L’aflibercept, par exemple, est un nouveau médicament qui a montré un bénéfice en termes de survie dans une étude de phase III en tant que traitement de deuxième ligne [2]. Il bloque l’activité de trois facteurs de croissance pro-angiogéniques : le VEGF-A, le VEGF-B et le “placental growth factor” (PIGF). Il empêche ces facteurs de croissance de se lier aux récepteurs des cellules cancéreuses, supprimant ainsi la croissance de nouveaux vaisseaux sanguins.
Les anticorps actuellement utilisés dans le mCRC sont le bevacizumab (anti-VEGF-A), le cetuximab (anti-EGFR) et le panitumumab (anti-EGFR). Plusieurs études ont montré que ces agents pouvaient améliorer le taux de réponse et la survie.

En outre, le regorafenib [3], un inhibiteur de multikinase par voie orale avec une activité intracellulaire, est autorisé. Concrètement, il bloque différentes kinases impliquées dans l’angiogenèse/l’oncogenèse tumorale (entre autres VEGFR1, VEGFR2, VEGFR3, KIT, RET, PDGF).
“Voilà donc à quoi ressemble notre situation actuelle : Nous avons la chimiothérapie conventionnelle, l’aflibercept, trois anticorps et un inhibiteur de tyrosine kinase”, a expliqué le professeur Güller. “Dans les années à venir, les inhibiteurs de BRAF, PIK3, MEK et mTOR devraient gagner en importance dans le traitement du mCRC. En outre, l’objectif à l’avenir est d’administrer un traitement adapté à chaque patient”, a déclaré le professeur Güller. “La détermination du statut RAS (KRAS/NRAS) est une première étape vers un tel traitement individualisé : il a été démontré que seuls les patients présentant un RAS de type sauvage bénéficient des anticorps anti-EGFR [4, 5]. Une détermination du statut RAS est donc nécessaire dans tous les cas avant de commencer un traitement avec un anticorps anti-EGFR, car le statut RAS a une valeur prédictive claire”.
Cela a été confirmé récemment par l’étude FIRE-3, dans laquelle, dans une analyse post-hoc, le bénéfice en termes de survie globale obtenu en ajoutant le cétuximab au FOLFIRI (par opposition au bévacizumab/FOLFIRI) était encore nettement plus important pour les patients de type sauvage RAS par rapport à la population sauvage KRAS initiale.
Source : 1er Symposium suisse sur les tumeurs malignes péritonéales et les HIPEC, 23 janvier 2014, Saint-Gall
Littérature :
- Perren TJ, et al : A phase 3 trial of bevacizumab in ovarian cancer. N Engl J Med 2011 Dec 29 ; 365(26) : 2484-2496. doi : 10.1056/NEJMoa1103799.
- Van Cutsem E, et al : Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regime. J Clin Oncol 2012 Oct 1 ; 30(28) : 3499-3506. Epub 2012 Sep 4.
- Grothey A, et al : Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT) : an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013 Jan 26 ; 381(9863) : 303-312. doi : 10.1016/S0140-6736(12)61900-X. Epub 2012 Nov 22.
- Van Cutsem E, et al : Cetuximab plus irinotecan, fluorouracil, et leucovorin en tant que traitement de première ligne du cancer colorectal métastatique : analyse mise à jour de la survie globale selon le KRAS tumoral et le statut de la mutation BRAF. J Clin Oncol 2011 mai 20 ; 29(15) : 2011-2019. doi : 10.1200/JCO.2010.33.5091. Epub 2011 Apr 18.
- Douillard JY, et al : Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013 Sep 12 ; 369(11) : 1023-1034. doi : 10.1056/NEJMoa1305275.
InFo Oncologie & Hématologie 2014 ; 2(2) : 18-21