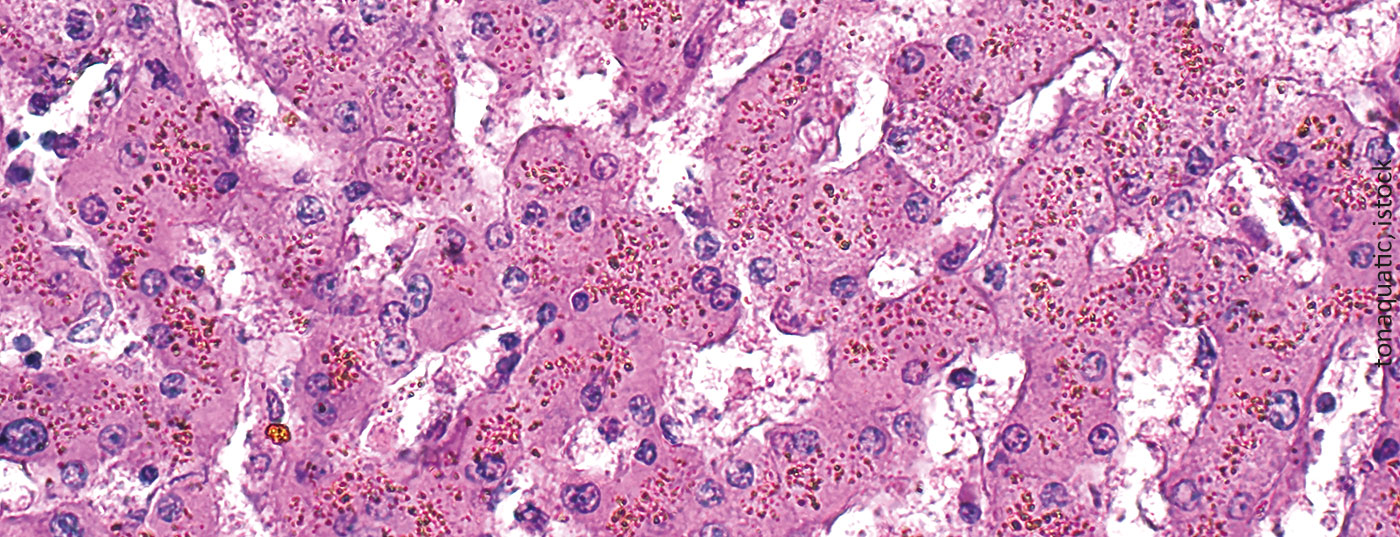
La surcharge en fer est une conséquence inévitable et potentiellement mortelle des transfusions multiples de concentrés érythrocytaires. Comme les manifestations cliniques ne sont pas spécifiques et se développent généralement lentement, cette complication est souvent négligée.
La surcharge en fer est une conséquence inévitable et potentiellement mortelle des transfusions multiples de concentrés érythrocytaires. Comme les manifestations cliniques ne sont pas spécifiques et se développent généralement lentement, cette complication est souvent négligée.
En général, on ne fait plus aujourd’hui de distinction entre surcharge en fer primaire et secondaire, car une telle définition dépend entre autres de la sensibilité des méthodes d’examen. Le terme “sidérose” désigne généralement un dépôt de fer sans lésion tissulaire, comme c’est le cas pour les dépôts de fer localisés dus à une hémorragie (par exemple, la sidérose pulmonaire).
Origine de la surcharge en fer
Un régime occidental typique contient environ 6 mg de fer/1000 kcal, dont seulement 1-2 mg/jour (environ 10%) sont normalement absorbés et, en cas de régulation élevée de l’absorption intestinale du fer, au maximum 3-5 mg/jour. Le fer de réserve normal est de 500 à 1000 mg chez les hommes et de 300 à 400 mg chez les femmes préménopausées et se trouve en grande partie dans le foie. L’organisme ne possède pas de mécanismes physiologiques actifs pour éliminer le fer en excès. Les adultes en bonne santé excrètent environ 1 mg de fer/jour par la peau et les cellules gastro-intestinales, les femmes préménopausées perdent en moyenne 0,5 à 1 mg/jour supplémentaire par les menstruations.
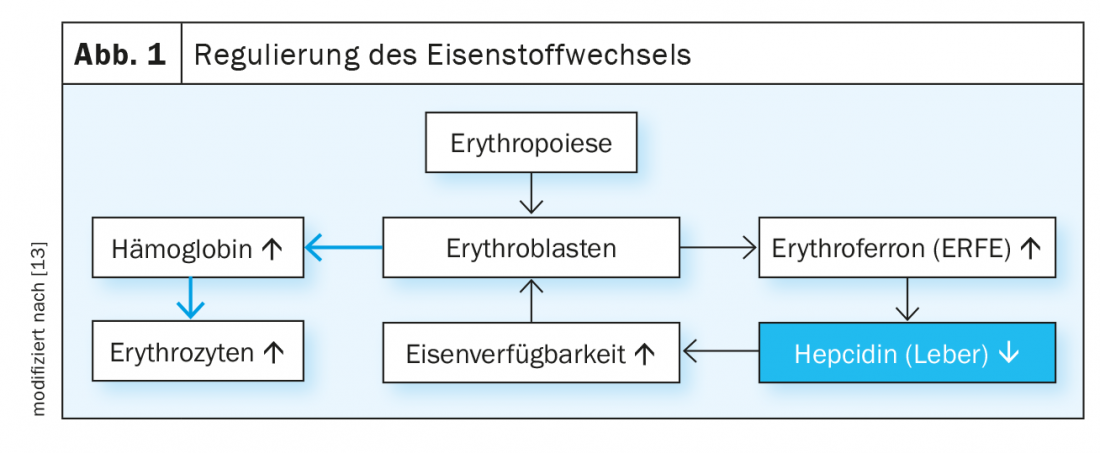
Le taux de fer plasmatique est régulé par le système hepcidine/ferroportine (figure 1). L’hormone peptidique hepcidine induit la dégradation de la ferroportine, la protéine exportatrice de fer. La ferroportine est principalement exprimée dans les cellules de la muqueuse duodénale, les hépatocytes et les macrophages et sert de médiateur pour la régulation de l’absorption du fer à partir de l’alimentation, la libération de fer par le foie en fonction des besoins et le recyclage du fer dans les macrophages. Lorsque la disponibilité du fer est suffisante, la synthèse hépatique de l’hepcidine augmente, ce qui bloque la poursuite de l’absorption gastro-intestinale du fer. L’anémie chronique et l’érythropoïèse inefficace, d’autre part, entraînent une inhibition de la synthèse de l’hepcidine dans le foie et, par conséquent, une augmentation de l’absorption du fer dans le duodénum. L’hormone érythroferrone, produite dans les érythroblastes sous l’influence de l’érythropoïétine, supprime également la production d’hepcidine et stimule ainsi l’absorption et la mobilisation du fer à partir des réserves en situation de stress érythropoïétique.
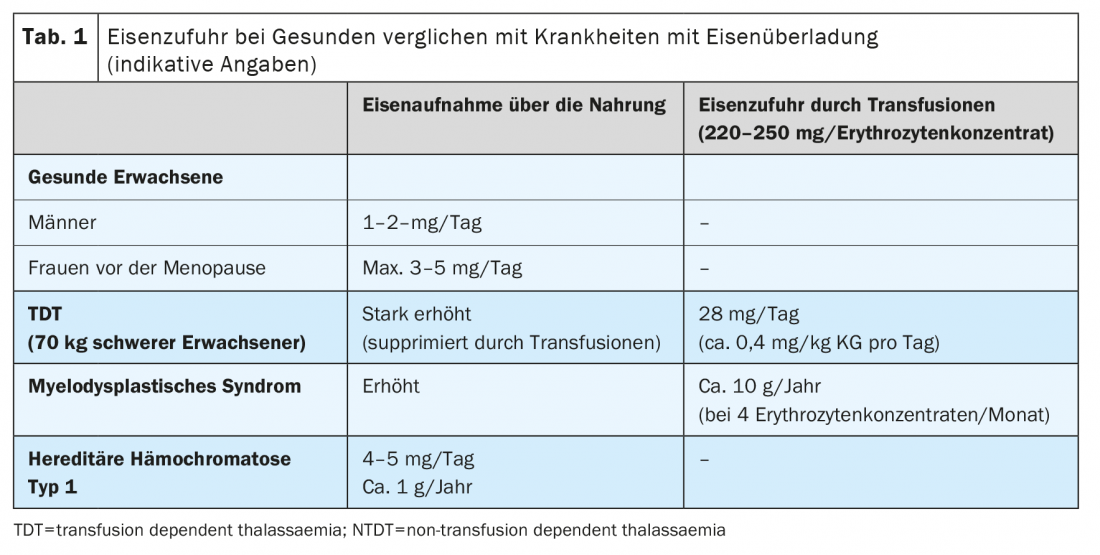
Une accumulation excessive de fer est due à deux mécanismes principaux : L’apport iatrogène de fer par transfusion de concentrés érythrocytaires et l’absorption accrue de fer provenant de l’alimentation. Chaque concentré érythrocytaire contient 220 à 250 mg de fer. Chez les patients adultes, un dépôt de fer significatif apparaît après 15 à 20 transfusions, et chez les jeunes enfants après plus de 10 administrations de concentrés érythrocytaires. L’augmentation de l’absorption gastro-intestinale joue un rôle central dans toutes les situations où l’érythropoïèse est augmentée ou inefficace. Dans ce cas, les érythroblastes disparaissent dans la moelle osseuse en raison d’une mort cellulaire avant de pouvoir se transformer en érythrocytes. Il en résulte une hyperstimulation et une hyperplasie de l’érythropoïèse, qui varie en fonction de la maladie sous-jacente. Plus l’altération de l’érythropoïèse est importante, plus l’absorption du fer provenant de l’alimentation est régulée à la hausse (tableau 1).
Dans l’hémochromatose héréditaire, un trouble génétique du métabolisme du fer sans anémie, le dépôt de fer résulte d’une dérégulation de l’axe hepcidine-ferroportine, le plus souvent d’une diminution de la production d’hepcidine (comme dans l’hémochromatose héréditaire de type 1). Plus rarement, il existe un dysfonctionnement d’autres molécules régulatrices du fer.
La chronologie et l’ampleur de l’accumulation du fer, ainsi que sa répartition dans les organes, varient en fonction de la maladie. Celle-ci est également influencée par d’autres facteurs tels que les infections chroniques (par exemple, l’hépatite chronique) et les maladies métaboliques (par exemple, la stéatohépatite).
Effets de l’excès de fer sur les cellules
La toxicité associée au fer est principalement observée dans les tissus qui stockent le fer à des concentrations élevées. Il s’agit notamment du foie, du système endocrinien et du myocarde. Le fer transfusé se dépose d’abord dans les macrophages du foie, de la rate et de la moelle osseuse, puis dans les hépatocytes et, plus tard seulement, dans les organes endocriniens (en particulier le pancréas) et le muscle cardiaque.
Le fer circulant est fixé par la protéine transferrine, puis libéré dans les cellules par la liaison de la transferrine aux récepteurs correspondants (TfR1, exprimé sur toutes les cellules, et TfR2, présent sur les hépatocytes). La proportion normale de transferrine liée au fer est de 16 à 45% et est mesurée en tant que saturation de la transferrine. En cas d’excès de fer, la capacité de liaison de la transferrine est dépassée et, à des valeurs supérieures à 70-75%, des molécules de fer non liées circulantes (Non-Transferrin-Bound Iron, NTBI ) apparaissent et sont rapidement absorbées dans les cellules par des voies non régulées (par exemple, via des canaux calciques dans les cellules du myocarde). L’absorption continue de NTBI augmente à la fois les réserves physiologiques intracellulaires de fer (ferritine) et la présence de formes labiles de fer. Ces derniers catalysent des réactions biochimiques telles que la réaction de Fenton, qui génère des radicaux oxygénés réactifs (ROS). Les conséquences sont une peroxydation des molécules intracellulaires, en particulier des lipides, avec des dommages aux organites, la mort cellulaire, la stimulation de la fibrogenèse et, finalement, le dysfonctionnement des organes. En outre, l’ADN est endommagé, ce qui peut entraîner une instabilité du génome et une tendance à la mutagénèse (Fig. 2).
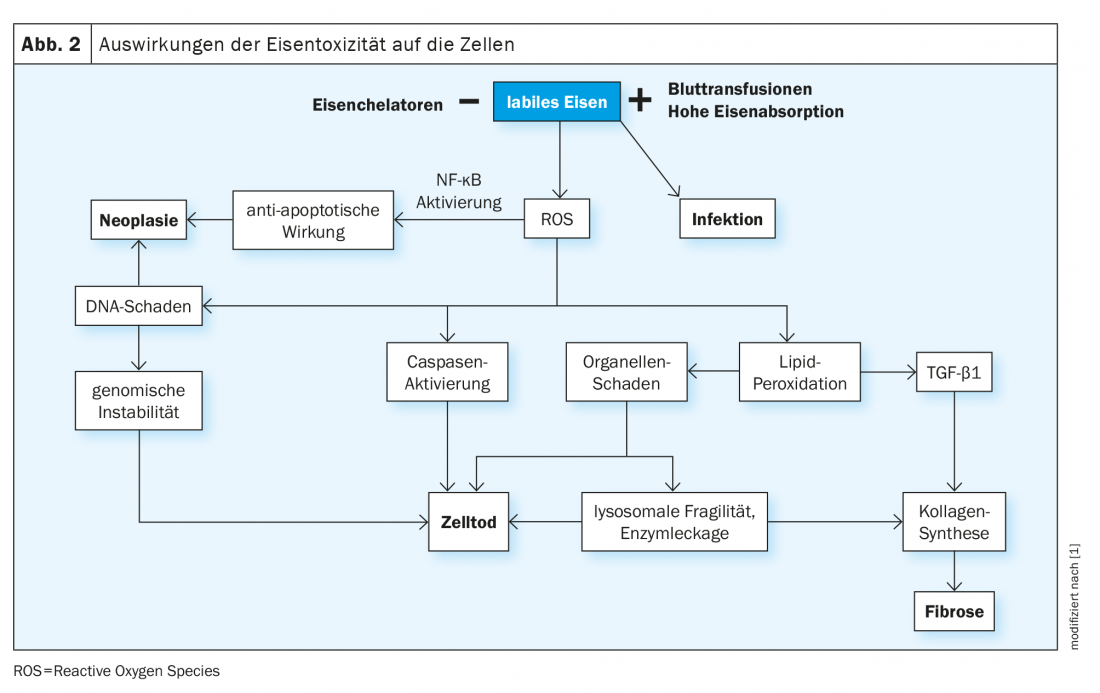
Le dépôt de fer est toléré différemment par les différents tissus. Par exemple, le foie peut stocker beaucoup plus de fer sans conséquence néfaste que le myocarde. La durée de l’exposition cellulaire au NTBI est un autre facteur déterminant dans le développement de lésions organiques. Celle-ci peut aujourd’hui persister pendant plusieurs décennies dans les maladies congénitales dépendantes de la transfusion, comme la thalassémie majeure, et est associée à un risque accru de malignité.
L’un des effets sous-estimés de la surcharge en fer est qu’elle favorise la prolifération des bactéries et le risque correspondant d’infections. La disponibilité rapide du fer libre pour les micro-organismes, d’une part, et les effets sur la fonction des macrophages et des leucocytes, d’autre part, expliquent la sensibilité accrue aux infections des patients atteints de thalassémie dépendante des transfusions. De nouvelles observations montrent également que l’excès de fer provoque un stress oxydatif sur l’endothélium de tous les vaisseaux et une diminution de l’exportation du cholestérol par les macrophages dans la paroi des vaisseaux, ce qui peut entraîner une augmentation de la formation de plaques.
Patients présentant un risque de surcharge en fer
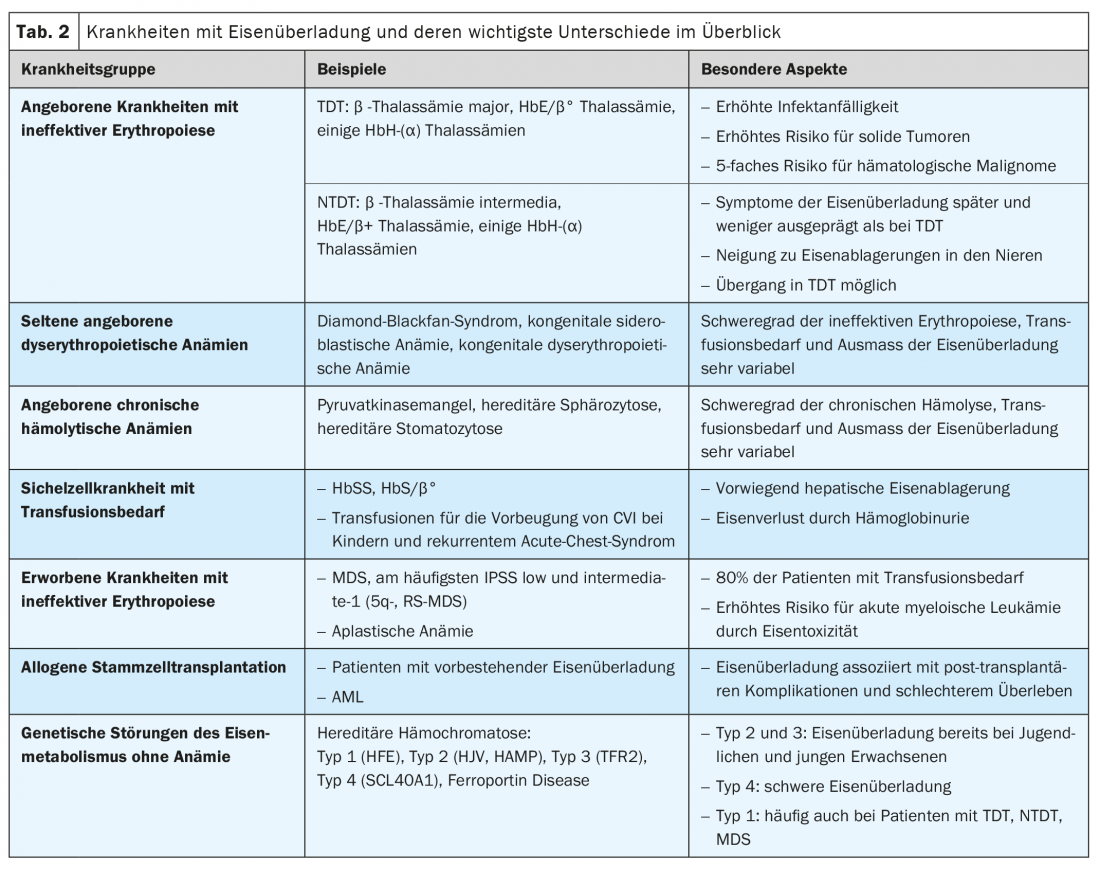
Les situations cliniques associées à une surcharge en fer comprennent les maladies congénitales et acquises avec une érythropoïèse inefficace (par exemple, les thalassémies et le syndrome myélodysplasique), les maladies hémolytiques chroniques, la drépanocytose nécessitant une transfusion et les troubles génétiques du métabolisme du fer sans anémie (hémochromatose héréditaire). (tableau 2). De plus, l’excès de fer chez les patients ayant subi une transplantation de cellules souches allogéniques a une importance pronostique.
Thalassémie dépendante de la transfusion (TDT) et thalassémie non dépendante de la transfusion (NTDT)
Les syndromes thalassémiques font partie des maladies génétiques les plus fréquentes dans le monde et sont causés par des anomalies génétiques sur le chromosome 11(β-thalassémie) ou 16(α-thalassémie) qui entraînent une diminution ou une absence de synthèse des chaînes de globine correspondantes. Le nombre énorme de variantes génétiques et de leurs combinaisons décrites jusqu’à présent, ainsi que le type d’hérédité, expliquent la grande variabilité clinique. D’un point de vue clinique, on distingue les thalassémies dépendantes de la transfusion (TDT) et les thalassémies non dépendantes de la transfusion (NTDT). Cette subdivision correspond à peu près à celle des thalassémies majeure et intermédiaire.
La β-thalassémie majeure est considérée comme le paradigme du TDT et des maladies avec surcharge en fer. La principale caractéristique du TDT est une érythropoïèse très altérée, voire absente, qui résulte d’une diminution de la synthèse de l’hémoglobine et de la précipitation des chaînes de globine en excès(α ou β). Il en résulte une anémie sévère avec, d’une part, un besoin de transfusion à vie dès la première année de vie et, d’autre part, une stimulation maximale de l’absorption intestinale du fer. Ainsi, l’apport quotidien massif de fer provenant de l’alimentation et l’apport iatrogène de fer, qui représente à lui seul environ 0,4 mg/kg de poids corporel par jour, s’additionnent. Les symptômes classiques de la surcharge en fer dans le TDT sont l’hépatopathie (fibrose, cirrhose, carcinome hépatocellulaire), la cardiopathie (en particulier la cardiopathie rythmogène et dilatée), les endocrinopathies (diabète sucré, hypothyroïdie, hypogonadisme) et l’ostéoporose (figure 3).
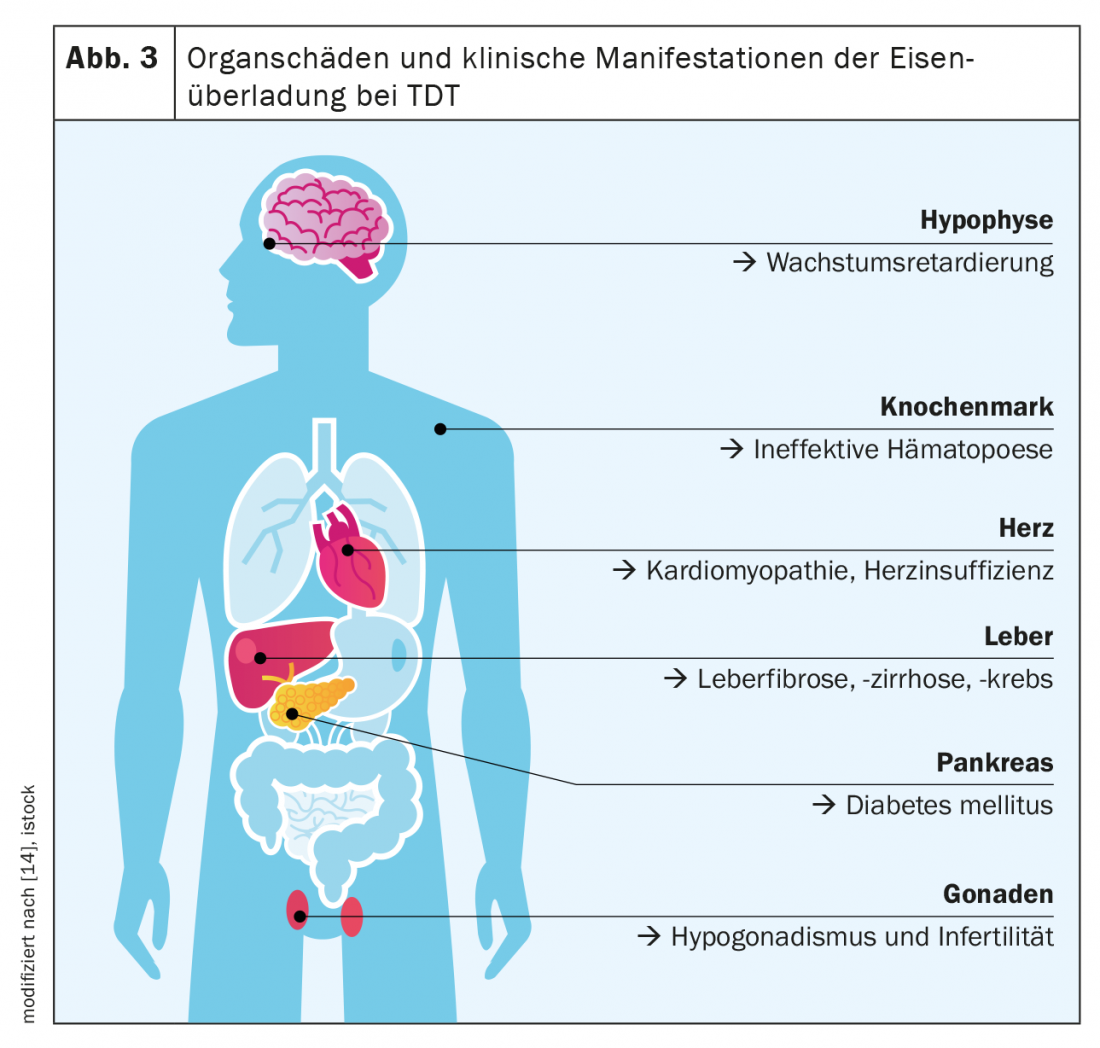
Avec l’introduction du traitement transfusionnel dans les années 1970, l’espérance de vie des patients atteints de TDT a été prolongée jusqu’à la puberté, les défaillances cardiaques et endocriniennes étant les principales causes de décès. Grâce à la possibilité de chélation du fer, les patients atteints de TDT ont aujourd’hui une espérance de vie de 40 à 50 ans ou plus et présentent des formes moins graves de cardiopathies et d’endocrinopathies. Cependant, il existe un risque accru de malignité, en particulier de carcinome gastro-intestinal, et un risque plus de 5 fois plus élevé de néoplasie hématologique comme conséquence à long terme de la toxicité du fer.
Dans le cas de la NTDT, l’augmentation de l’absorption du fer (environ 0,01 mg/kg de poids corporel par jour) est la conséquence d’une érythropoïèse fortement accrue et constitue le principal mécanisme de dépôt du fer. L’accumulation de fer dans la NTDT étant lente, les manifestations cliniques n’apparaissent que plus tard dans l’enfance, voire au début de l’âge adulte. Les symptômes de la surcharge en fer sont généralement moins prononcés, l’implication cardiaque est plus rare et le risque de néoplasie est plus faible que dans le cas du TDT. Cependant, les patients atteints de NTDT ont tendance à accumuler du fer dans les reins, ce qui peut entraîner un dysfonctionnement interstitiel et glomérulaire. Il est important de noter qu’une NTDT peut se transformer en TDT au cours de la vie.
Anémies congénitales rares avec érythropoïèse inefficace et anémies hémolytiques chroniques congénitales
De même, dans le cas des anémies congénitales, comme le syndrome de Diamond-Blackfan, la gravité de l’érythropoïèse inefficace et de l’anémie ainsi que les besoins transfusionnels déterminent l’ampleur de la surcharge en fer. Les données spécifiques sont rares pour ces maladies rares. En fonction des besoins transfusionnels, qui peuvent être importants même chez les jeunes enfants, les risques et les manifestations cliniques de la surcharge en fer sont similaires à ceux du TDT et du NTDT.
Les enzymopathies érythrocytaires congénitales telles que le déficit en pyruvate kinase, les membranopathies (par ex. la sphérocytose héréditaire) et les troubles de la synthèse de l’hème (par ex. les porphyries) entraînent une hémolyse chronique plus ou moins prononcée et, par conséquent, une hyperplasie de l’érythropoïèse. Les personnes atteintes peuvent présenter une surcharge en fer même en l’absence de transfusion (jusqu’à 47% des patients présentant un déficit en pyruvate kinase), les symptômes apparaissant généralement à l’âge adulte et rarement pendant l’enfance. Dans le cas de la sphérocytose héréditaire, qui est la cause la plus fréquente d’hémolyse chronique avec une prévalence estimée entre 1/2000 et 1/2500, seule une partie des patients ont besoin de transfusions sporadiques ou régulières.
Maladie drépanocytaire (SCD) nécessitant une transfusion
Les transfusions régulières ne sont indiquées chez les patients atteints de SCD que dans des situations spécifiques, notamment pour prévenir les accidents cérébrovasculaires chez les enfants et en cas de syndrome de la poitrine aiguë récurrente ou de crise vaso-occlusive sévère. Dans ces cas, on procède souvent à des transfusions d’échange manuelles ou automatisées, qui ne s’accompagnent pas d’une augmentation de l’apport en fer lié à la transfusion.
Les patients atteints de SCD perdent souvent du fer par hémoglobinurie (en quantité équivalente à 10 concentrés érythrocytaires par an) et présentent un faible taux plasmatique de NTBI. C’est pourquoi la surcharge en fer ne se développe que chez une proportion relativement faible des personnes concernées et les symptômes – principalement l’hépatopathie et la fibrose hépatique – apparaissent classiquement plus tard dans la vie. Bien que les lésions des organes endocriniens ou du cœur soient rares chez les patients atteints de SCD, les manifestations cliniques de la surcharge en fer et de la SCD elle-même sont souvent difficiles à distinguer, ce qui explique que les lésions organiques liées au fer soient parfois sous-estimées. Des études montrent ainsi que jusqu’à 11% des patients atteints de SCD meurent des suites d’une surcharge en fer. En raison de l’allongement de l’espérance de vie, les complications à long terme liées au fer sont de plus en plus fréquentes dans la SCD, comme dans la TDT et la NTDT.
Anémie chronique acquise due à une insuffisance de la moelle osseuse
Le syndrome myélodysplasique (SMD) regroupe un ensemble de maladies acquises caractérisées par une insuffisance de la moelle osseuse à des degrés divers et par le potentiel de développement d’une leucémie myéloïde aiguë. Le SMD est l’une des néoplasies hématologiques les plus fréquentes (incidence d’environ 4/100 000 en Europe) et touche généralement des patients âgés (âge médian au diagnostic : 71 ans).
Dans les SMD à faible risque (IPSS low- et intermediate-1), les cytopénies sont au premier plan, une anémie due à une érythropoïèse inefficace étant présente dans environ 80% des cas. Comme la plupart des patients atteints de SMD deviennent dépendants des transfusions, ils développent souvent une surcharge en fer. Les principales différences avec le TDT et le NTDT sont l’âge beaucoup plus élevé des patients au moment du diagnostic et la grande stabilité génomique des clones dysplasiques dans la moelle osseuse. Comme pour le TDT, les complications cardiaques sont fréquentes chez les patients SMD régulièrement transfusés (82,4% versus 67,1% chez les patients non transfusés). La toxicité du fer dans les SMD est particulièrement importante car elle favorise la progression vers une leucémie aiguë et a un impact négatif sur la survie après une greffe de cellules souches allogéniques.
Transplantation de cellules souches allogéniques
La transplantation de cellules souches allogéniques est un traitement potentiellement curatif pour les patients atteints de TDT, de SCD et de SMD, ainsi que d’autres maladies avec dépôt de fer. L’influence d’une surcharge en fer sur le succès de l’allogreffe de cellules souches, notamment sur la mortalité associée au traitement, a d’abord été décrite dans le cas des thalassémies et est aujourd’hui de plus en plus reconnue dans d’autres pathologies.
Même la toxicité de la chimiothérapie peut être attribuée en partie aux effets négatifs de la surcharge en fer, car une mobilisation massive des réserves de fer de la moelle osseuse avec libération de NTBI a lieu pendant le conditionnement. Les besoins transfusionnels avant et après la transplantation influencent l’évolution péri-transplantatoire. Les données montrent que 88% des patients atteints de SMD et 97% des patients atteints de leucémie myéloïde aiguë présentent des taux de ferritine élevés avant la transplantation et que l’excès de fer est associé à une mucosite, à une obstruction des vaisseaux hépatiques sinusoïdaux, à une septicémie et, globalement, à une survie globale plus faible.
Troubles génétiques du métabolisme du fer sans anémie
L’augmentation de l’absorption intestinale du fer est le corrélat physiopathologique des différentes formes d’hémochromatose héréditaire. L’absorption de fer peut être augmentée jusqu’à 4 mg par jour, soit 2 à 4 fois plus que chez les individus ne souffrant pas d’hémochromatose héréditaire (tableau 1).
Dans l’hémochromatose héréditaire associée à l’HFE (type 1), l’une des maladies génétiques les plus courantes dans la population européenne, le fer se dépose très lentement (environ 1 g/an) et les symptômes apparaissent typiquement à l’âge adulte (entre 40 et 50 ans chez les hommes, souvent après la ménopause chez les femmes). Les manifestations cliniques les plus fréquentes sont l’hépatopathie, les arthropathies et le diabète sucré. L’apparition dans le temps et la gravité de l’accumulation de fer varient en fonction de la mutation sous-jacente. Certaines formes rares, comme l’hémochromatose juvénile (type 2), sont plus agressives et entraînent une accumulation importante de fer dès la puberté.
En raison de sa fréquence, l’hémochromatose héréditaire, en particulier de type 1, n’est pas rarement détectée chez les patients atteints de thalassémie, de SMD ou présentant des risques d’accumulation pathologique de fer, et constitue donc un facteur supplémentaire dans le développement d’une surcharge en fer potentiellement grave.
Messages Take-Home
- L’augmentation de l’absorption intestinale du fer et l’apport iatrogène de fer par transfusion de concentrés érythrocytaires sont les principaux mécanismes à l’origine du développement d’une surcharge en fer.
- L’accumulation pathologique de fer se produit dans les maladies hématologiques congénitales et acquises avec une érythropoïèse inefficace, même en l’absence de transfusions régulières.
- La surcharge en fer se développe plus rapidement et dans une plus grande mesure chez les patients transfusés régulièrement que dans les maladies non transfusionnelles ; en cas de troubles génétiques du métabolisme du fer (hémochromatose héréditaire), le fer se dépose beaucoup plus lentement en comparaison.
- Dans le cas du SMD, l’excès de fer cellulaire peut renforcer l’instabilité du génome dans les clones cellulaires pré-leucémiques et ainsi favoriser la transformation en leucémie aiguë.
- La surcharge en fer est associée à des complications cliniques et à une mortalité accrue après une allogreffe de cellules souches.
- En raison de sa fréquence, l’hémochromatose héréditaire peut être présente chez les patients présentant d’autres risques de surcharge en fer cliniquement significatifs et influencer l’évolution clinique.
Littérature :
- Porter JB, et al : New insights into transfusion-related iron toxicity : Implications for the oncologist. Crit Rev Oncology/Hematology 2016 ; 99 : 261-271
- Camaschella C, Nai A, Silvestri L : Métabolisme du fer et troubles du fer revisités à l’ère de l’hepcidine. Haematologica 2020 ; 105 : 260-72
- Porter JB, Garbowski M : The pathophysiology of transfusional iron overload. Hématol. Oncol Clin N Am 2014 ; 28 : 683-701.
- Hahalis G, et al : Global vasomotor dysfunction and accelerated vascular aging in beta-thalassemia major. Atherosclerosis 2008 ; 198 (2) : 448-457.
- Gardenghi S, et al : L’érythropoïèse inefficace dans la bêta-thalassémie est caractérisée par une absorption accrue de fer médiée par la régulation à la baisse de l’hepcidine et à la hausse de la ferroportine. Blood 2007 ; 109(11) : 5027-5035.
- Vento S, Cainelli F, Cesario F : Infections et thalassémie. Lancet Infect Dis 2006 ; 6(4) : 226-233.
- Porter J, Garbowski M : Conséquences et gestion de la surcharge en fer dans la maladie drépanocytaire. Hematology Am Soc Hematol Educ Program. 2013 ; 2013 : 447-456.
- Roggero S, et al : Surcharge sévère en fer dans l’anémie de Blackfan-Diamond : une étude cas-contrôle. Am J Hematol. 2009 ; 84 : 729-32.
- Zanella S, Garani MC, Borgna-Pignatti C : Malignités et thalassémie : une revue de la littérature. Ann N Y Acad Sci 2016 ; 1368(1) : 140-148.
- Gattermann N : Surcharge en fer dans les syndromes myélodysplasiques (SMD). Int J Hematol 2018 ; 107 : 55-63.
- Koreth J, Antin JH : Surcharge en fer dans les tumeurs hématologiques et résultats de la transplantation allogénique de cellules souches hématopoïétiques. Haematologica 2010 ; 95 : 364-366.
- Pilling LC, et al : Conditions communes associées aux variants génétiques de l’hémochromatose héréditaire : étude de cohorte dans la biobanque britannique. BMJ 2019 ; 364 : k5222.
- Leuenberger N, et al : Hepcidin as a potential biomarker for blood doping. Drug Test Anal 2017 ; 9(7) : 1093-1097.
- Novartis : vivre avec les transfusions. www.leben-mit-transfusionen.de/eisenueberladung/krankheitsbild (dernier accès le 10.02.2022)
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(1) : 12-17