La pneumonie acquise en ambulatoire est une pathologie hétérogène. Le diagnostic clinique n’est pas toujours évident. Chez de nombreux patients, en particulier les plus âgés, les signes typiques tels que la toux, les expectorations ou la fièvre sont absents. La mise en évidence d’un infiltrat pneumonique sur la radiographie du thorax permet de confirmer le diagnostic. La gravité et donc la nécessité d’une hospitalisation peuvent être déterminées à l’aide de paramètres simples, il faut également tenir compte des comorbidités. Les patients traités en ambulatoire peuvent généralement être traités de manière empirique sans recherche d’agents pathogènes causaux ; pour les patients hospitalisés, le diagnostic des agents pathogènes doit être adapté à la gravité du cas. En cas d’échec du traitement, il faut en premier lieu penser à une complication ou à un diagnostic différentiel. Les infiltrats pulmonaires peuvent également avoir une origine non infectieuse.
Les infections respiratoires sont fréquentes dans la pratique de la médecine générale. Les infections des voies respiratoires supérieures, les bronchites aiguës, les bronchectasies exacerbées, les BPCO exacerbées aiguës et les pneumonies acquises en ambulatoire ne sont pas toujours faciles à distinguer au premier abord. Cependant, seule une délimitation de ces entités peut garantir le traitement qui, dans le contexte de la résistance croissante aux antibiotiques et de l’augmentation des coûts du système de santé, permet non seulement d’offrir des soins optimaux aux patients, mais aussi d’utiliser les antibiotiques de manière raisonnable et de répartir efficacement les ressources.
Pneumonie acquise en ambulatoire – une maladie hétérogène
D’un point de vue clinique, il est utile de classer la pneumonie – l’inflammation du parenchyme pulmonaire d’origine microbienne – en fonction du lieu d’acquisition et du statut immunitaire du patient. Les principaux agents pathogènes chez les patients ambulatoires non immunodéprimés sont résumés dans le tableau 1. Sont également considérées comme acquises en ambulatoire les pneumonies survenant lors d’un séjour dans une maison de retraite ou de soins ou lors d’un traitement chronique par hémodialyse.

Le terme “pneumonie acquise en ambulatoire” englobe un spectre hétérogène de tableaux cliniques, dont certains se déroulent facilement et sans complications, mais qui peuvent aussi constituer des urgences vitales et présenter une mortalité importante (la mortalité de toutes les pneumonies traitées à l’hôpital est de 10-20%). La pneumonie est également fréquente en phase terminale d’une maladie chronique pulmonaire ou extra-pulmonaire (par ex. insuffisance cardiaque, tumeur maligne, maladie neurologique) ou en fin de vie chez les personnes très âgées.
Clinique : pas toujours spécifique
La pneumonie se manifeste d’une part par des symptômes respiratoires (toux, expectoration purulente, dyspnée) et d’autre part par des symptômes systémiques (malaise, fièvre ou hypothermie, frissons). Elle doit être suspectée en cas de maladie aiguë chez un patient immunocompétent sans autre cause apparente, avec comme symptôme principal la toux, une nouvelle découverte focale à l’examen clinique du thorax et une fièvre de plus de 4 jours, une dyspnée ou une tachypnée.
Chez les patients âgés ou atteints d’une maladie chronique, la réponse immunitaire diminue, de sorte que les symptômes respiratoires ou la fièvre peuvent être limités ou absents. Confusion, faiblesse, somnolence, décompensation d’autres maladies ou autres symptômes extrapulmonaires non spécifiques peuvent rester les seuls symptômes.
La radiographie du thorax reste l’étalon-or
Il n’y a pas de symptômes spécifiques à la pneumonie. De même, la combinaison de l’anamnèse et de l’examen clinique ne permet pas de distinguer une pneumonie d’une autre infection des voies respiratoires inférieures (bronchite aiguë, exacerbation aiguë d’une BPCO ou d’une bronchectasie, grippe) avec une spécificité suffisante pour confirmer le diagnostic et poser ainsi l’indication d’une antibiothérapie.
La détection d’un infiltrat pneumonique par radiographie du thorax est nécessaire pour éviter un surtraitement des infections respiratoires basses par des antibiotiques. De plus, la radiographie permet d’identifier les complications (abcès pulmonaire, empyème) et la gravité (infiltrats multilobaires) de la pneumonie et donne des indications sur les maladies pulmonaires structurelles (fibrose ou tumeurs pulmonaires).
Rôle des biomarqueurs
Lorsqu’une pneumonie est diagnostiquée, elle est systématiquement traitée par un antibiotique. Dans les situations incertaines, par exemple lorsqu’aucun infiltrat certain n’est identifiable ou en l’absence de radiographie, la décision thérapeutique peut être étayée par des biomarqueurs, mais l’évaluation clinique doit toujours prévaloir (tab. 2).

Les biomarqueurs tels que la procalcitonine (Pro-CT) et la protéine C-réactive (CRP) peuvent être utiles non seulement pour établir le diagnostic, mais aussi pour évaluer la réponse au traitement et pour déterminer la durée du traitement. La procalcitonine est suffisamment spécifique pour distinguer les pneumonies bactériennes des pneumonies virales, et il existe des études d’intervention sur la procalcitonine pour guider le traitement. Les principales raisons de la diffusion malgré tout hésitante de la mesure de la procalcitonine sont la disponibilité limitée dans le secteur ambulatoire et les coûts élevés.
Diagnostic microbiologique
En règle générale, plus la pneumonie est grave, plus le diagnostic microbiologique est utile. Le diagnostic microbiologique n’est pas recommandé chez les patients traités en ambulatoire, à l’exception des personnes immunodéprimées. Pour les patients plus gravement atteints et nécessitant une hospitalisation, elle se fait en fonction du degré de gravité. Des cultures de sang et de crachats doivent systématiquement être effectuées. Cependant, les crachats ne peuvent être cultivés de manière significative que dans le cas d’expectorations purulentes, de crachats de bonne qualité et d’une logistique adaptée (traitement dans un délai de deux à quatre heures).
La détermination de l’antigène de la légionelle dans l’urine est sensible et spécifique et, si elle est positive, elle conduit à une modification du traitement. La recommandation concernant la détermination de l’antigène pneumococcique est moins forte, car tout traitement empirique de la pneumonie doit être dirigé contre le pneumocoque ; une détection positive peut toutefois contribuer à la détection de la pneumonie et au ciblage du traitement antibiotique.
S’il existe une intention de traitement (pneumonie sévère, symptômes <48 heures) et que la situation épidémiologique s’y prête, la détection de l’influenza par PCR doit être recherchée.
La recherche de Mycoplasma, Chlamydophila, Coxiella ou de virus respiratoires n’est utile que dans des situations particulières, par exemple les pneumonies graves (nécessitant des soins intensifs), les épidémies ou les considérations de diagnostic différentiel.
Si des méthodes invasives sont disponibles, le prélèvement de sécrétions trachéobronchiques par bronchoscopie ou un lavage broncho-alvéolaire doivent être discutés en cas de pneumonie sévère.
Épanchement pleural parapneumonique
Un épanchement pleural concomitant est observé chez 25 à 50% des patients atteints de pneumonie acquise en ambulatoire. À partir de 10 mm d’extension, il doit être échographié et ponctionné à des fins diagnostiques. Outre l’aspect macroscopique, la mise en évidence d’agents pathogènes ou un pH <7,2, la taille (≥ moitié de l’hémithorax) et la mise en évidence d’une localisation ou d’un sepsis sont également des indications pour un traitement par drainage (et éventuellement une fibrinolyse) ou pour un débridement thoracoscopique.
Où traiter ?
Chez les patients qui étaient en bon état fonctionnel avant la maladie, le pronostic et donc la nécessité d’une hospitalisation peuvent être évalués par la collecte de paramètres simples. Le score CRB-65, complété par un relevé pulsoxymétrique de l’oxygénation, est bien adapté pour déterminer la nécessité d’une hospitalisation (Fig. 1).
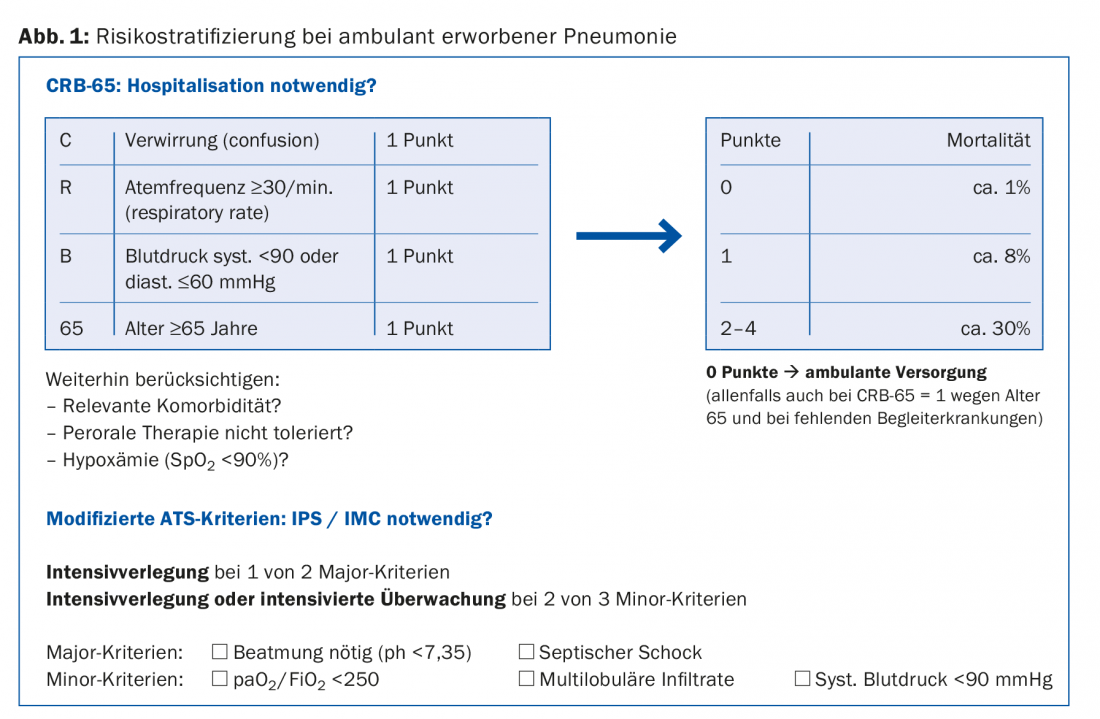
Chez les patients souffrant d’un diabète mal contrôlé, d’une insuffisance rénale ou hépatique sévère ou d’une maladie cardiaque grave, ces affections peuvent décompenser rapidement et violemment sous l’effet de la pneumonie, de sorte que dans ces cas, l’hospitalisation aura lieu plus tôt. Les circonstances sociales et les possibilités d’autosuffisance peuvent également rendre l’hospitalisation nécessaire.
Traitement antibiotique
Même dans les cas où un diagnostic microbiologique est indiqué, l’agent pathogène ne peut généralement pas être détecté rapidement. Par conséquent, un traitement empirique calculé est mis en œuvre sur la base de l’état local des agents pathogènes et de la résistance, ainsi que des facteurs de risque de germes résistants. Les recommandations pour la Suisse sont présentées dans le tableau 3 , bien qu’elles puissent varier localement en fonction de la situation de l’agent pathogène et de la résistance. Pour les pneumonies modérées à sévères, un traitement initial combiné avec un macrolide reste recommandé jusqu’à la stabilisation clinique. Son efficacité ne repose pas uniquement sur la couverture supplémentaire des agents pathogènes atypiques, mais on postule entre autres un effet immunomodulateur favorable.
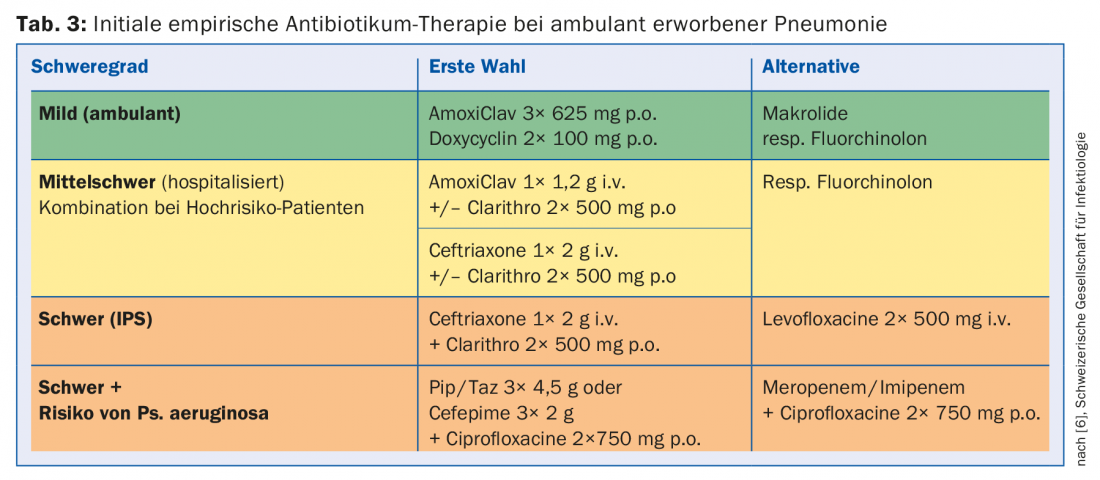
La durée du traitement est généralement de cinq jours pour les pneumonies légères et non compliquées, de cinq à sept jours pour les pneumonies modérées et jusqu’à dix jours pour les pneumonies sévères. Une durée de traitement plus longue est nécessaire en cas de bactéries intracellulaires détectées, d’abcès pulmonaires, de cavités et d’empyème.
Stéroïdes systémiques ?
L’utilisation des stéroïdes systémiques dans le traitement des pneumonies acquises en ambulatoire fait l’objet d’un regain d’intérêt. Les études cliniques ont montré que cela permettait d’atteindre plus tôt la stabilité clinique chez les patients hospitalisés et de réduire la durée de l’hospitalisation ainsi que l’utilisation d’antibiotiques parentéraux, sans que l’on puisse constater d’inconvénients significatifs à court terme. Les sous-groupes de patients atteints de pneumonie qui bénéficient réellement des stéroïdes systémiques, la manière dont le traitement doit être administré en détail et si l’effet ne pourrait pas être obtenu par une meilleure prise en compte de la clinique (critères de stabilité) et une utilisation plus prudente des antibiotiques (“antibiotic stewardship”) ne sont pas encore clarifiés, de sorte qu’aucune recommandation ne peut être formulée à ce sujet.
Autres médicaments
Le dextrométhorphane ou la codéine peuvent être recommandés pour le traitement symptomatique d’une toux irritative pénible et improductive. Les expectorants, les mucolytiques, les antihistaminiques et les bronchodilatateurs n’ont pas fait la preuve de leur efficacité.
Critère d’évaluation du traitement : stabilité clinique
Les symptômes de la pneumonie acquise en ambulatoire durent généralement bien plus longtemps que le temps nécessaire à la stabilisation clinique (tab. 4). C’est pourquoi il ne faut pas considérer la disparition définitive des symptômes, mais la stabilité clinique comme un substitut de la réponse au traitement. Le patient est considéré comme cliniquement stable si les critères suivants s’appliquent :
- Pas de fièvre
- Normocardie et normotonie
- Pas de tachypnée
- Pas d’hypoxémie (SpO2 ≥90% ou pO2 ≥60 mmHg sous air ambiant)
- Alimentation orale et prise de médicaments possibles
- État mental préexistant à nouveau atteint.
Une fois la stabilité clinique atteinte, il est possible de passer à un traitement per os si un traitement i.v. a été administré au préalable.
Échec thérapeutique précoce et tardif
Une aggravation précoce de l’état (<72 heures après le début du traitement = pneumonie progressive) est généralement due à une non-réponse au traitement initial. Les raisons incluent un agent pathogène non couvert, une résistance inattendue ou un autre diagnostic (embolie pulmonaire, pneumopathie interstitielle aiguë), mais la raison principale est le développement d’une septicémie. C’est pourquoi l’échec précoce du traitement doit être activement exclu, même chez les patients traités en ambulatoire, au moyen d’un contrôle clinique 72 heures après l’introduction du traitement.
L’aggravation en deux temps, survenant tardivement après une réponse initiale au traitement (>72 heures), peut généralement être attribuée à une complication de la pneumonie (surinfection, abcès, empyème) ou à l’exacerbation d’une comorbidité (insuffisance cardiaque, insuffisance rénale).
Il faut distinguer l’échec du traitement de la pneumonie non résolutive (“non-resolving”), définie comme la persistance de la modification radiologique pendant plus de quatre à huit semaines malgré une réponse clinique au traitement. Dans ces cas, une maladie pulmonaire sous-jacente doit être recherchée, par exemple un carcinome bronchique, des bronchectasies, une pneumonie organisatrice, une pneumopathie interstitielle idiopathique ou une vascularite.
Suivi des patients
En cas de pneumonie acquise en ambulatoire, un contrôle clinique est nécessaire le deuxième ou troisième jour après l’initiation du traitement afin de détecter un éventuel échec précoce du traitement. Même si l’évolution est favorable, le patient et ses proches doivent être instruits de reprendre contact si la fièvre persiste pendant plus de quatre jours, si la dyspnée augmente, si l’alimentation et l’hydratation par voie orale sont impossibles, si un trouble de la conscience survient ou si un symptôme quelconque persiste pendant plus de trois semaines. Il existe peu de preuves pour un contrôle radiologique quatre à six semaines après la pneumonie, mais il est recommandé en cas de symptômes persistants et de risque élevé de tumeur (fumeur, antécédents de tumeur maligne, âge >50 ans).
Prévention primaire et secondaire
Les vaccins contre la grippe et le pneumocoque sont efficaces à titre préventif. Le vaccin conjugué 13-valent contre le pneumocoque, nouvellement inclus dans les recommandations, présente l’avantage d’être également efficace en termes d’infections non invasives et de mortalité, et de maintenir son efficacité au fil du temps, par rapport au vaccin polysaccharidique 23-valent utilisé jusqu’à présent. Il est recommandé aux fumeurs actifs d’arrêter de fumer. En cas de pneumonie par aspiration suspectée ou évidente, la dysphagie doit être identifiée et traitée à temps. L’indication d’une médication continue pouvant favoriser les pneumonies (corticostéroïdes inhalés, inhibiteurs de la pompe à protons) doit être vérifiée.
Littérature :
- Prina E, et al : Community-acquired pneumonia. Lancet 2015 ; 386(9998) : 1097-1108.
- Musher D, et al : Community-acquired pneumonia. N Engl J Med 2014 ; 371(17) : 1619-1628.
- Woodhead M, et al : Guidelines for the management of adult lower respiratory tract infections. Eur Respir J 2005 ; 26(6) : 1138-1180.
- Ewig S, et al. : S3-Leitlinie. Prise en charge des patients adultes atteints de pneumonie acquise en ambulatoire et prévention – Mise à jour 2016. Pneumologie 2016 ; 70(3) : 151-200.
- Eccles S, et al : Diagnostic et prise en charge de la pneumonie acquise en milieu communautaire et hospitalier chez l’adulte : résumé des lignes directrices du NICE. BMJ 2014 ; 349 : g6722.
- Laifer G, et al : Management of community acquired pneumonia (CAP) in adults (ERS/ESCMID guidelines adapted for Switzerland), www.sginf.ch/guidelines/guidelines-of-the-ssi.html (accessed Apr 25, 2016).
- Lim WS, et al : BTS guidelines for the management of community acquired pneumonia in adults : update 2009. Thorax 2009 ; 64 Suppl 3 : iii1-55.
- Schuetz P, et al : Procalcitonine pour initier ou interrompre les antibiotiques dans les infections aiguës des voies respiratoires. Cochrane Database Syst Rev 2012 ; 9 : CD007498.
- Chalmers JD, et al : Severity assessment tools for predicting mortality in hospitalised patients with community-acquired pneumonia. Revue systématique et méta-analyse. Thorax 2010 ; 65(10) : 878-883.
- Wan YD, et al : Efficacité et sécurité des corticostéroïdes pour la pneumonie acquise dans la communauté : une revue systématique et une méta-analyse. Chest 2016 ; 149(1) : 209-219.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(7) : 11-15