L’intolérance à l’histamine est une intolérance alimentaire qui comprend une série de réactions indésirables dues à l’histamine accumulée ou ingérée. Elle est causée par un déséquilibre entre la quantité d’histamine libérée par l’alimentation et la capacité de l’organisme à éliminer cette quantité. Détecter un hit n’est cependant pas si simple.
Une dégradation perturbée de l’histamine peut entraîner de nombreux problèmes. C’est pourquoi l’intolérance à l’histamine (IAH) a fait l’objet d’une attention croissante de la part du public au cours des dernières années. Les praticiens se demandent souvent si et quand cette maladie doit être prise au sérieux. La TIH est le nom donné à une intolérance alimentaire qui comprend une série de réactions indésirables dues à l’histamine accumulée ou ingérée. Elle s’accompagne d’une diminution de l’activité de l’enzyme DAO, ce qui entraîne une augmentation de la concentration d’histamine dans le plasma et l’apparition de réactions indésirables [1]. La TIH doit être distinguée de l’intoxication à l’histamine, également appelée syndrome de Scrombroid, scombroïdose ou intoxication à l’histamine. Le terme est dérivé du nom de la famille de maquereaux (Scombridae) après la consommation de laquelle l’intoxication a été le plus souvent observée. La famille des Scombridae comprend le thon, le hareng et le maquereau. L’intoxication à l’histamine est considérée dans le monde entier comme l’une des intoxications les plus fréquentes causées par la consommation de poisson [2]. Dans le cas de la TIH, la quantité d’histamine absorbée est beaucoup plus faible que dans le cas d’une intoxication à l’histamine. Les manifestations de la TIH sont également moins graves que celles de l’intoxication.
Apparence hétérogène
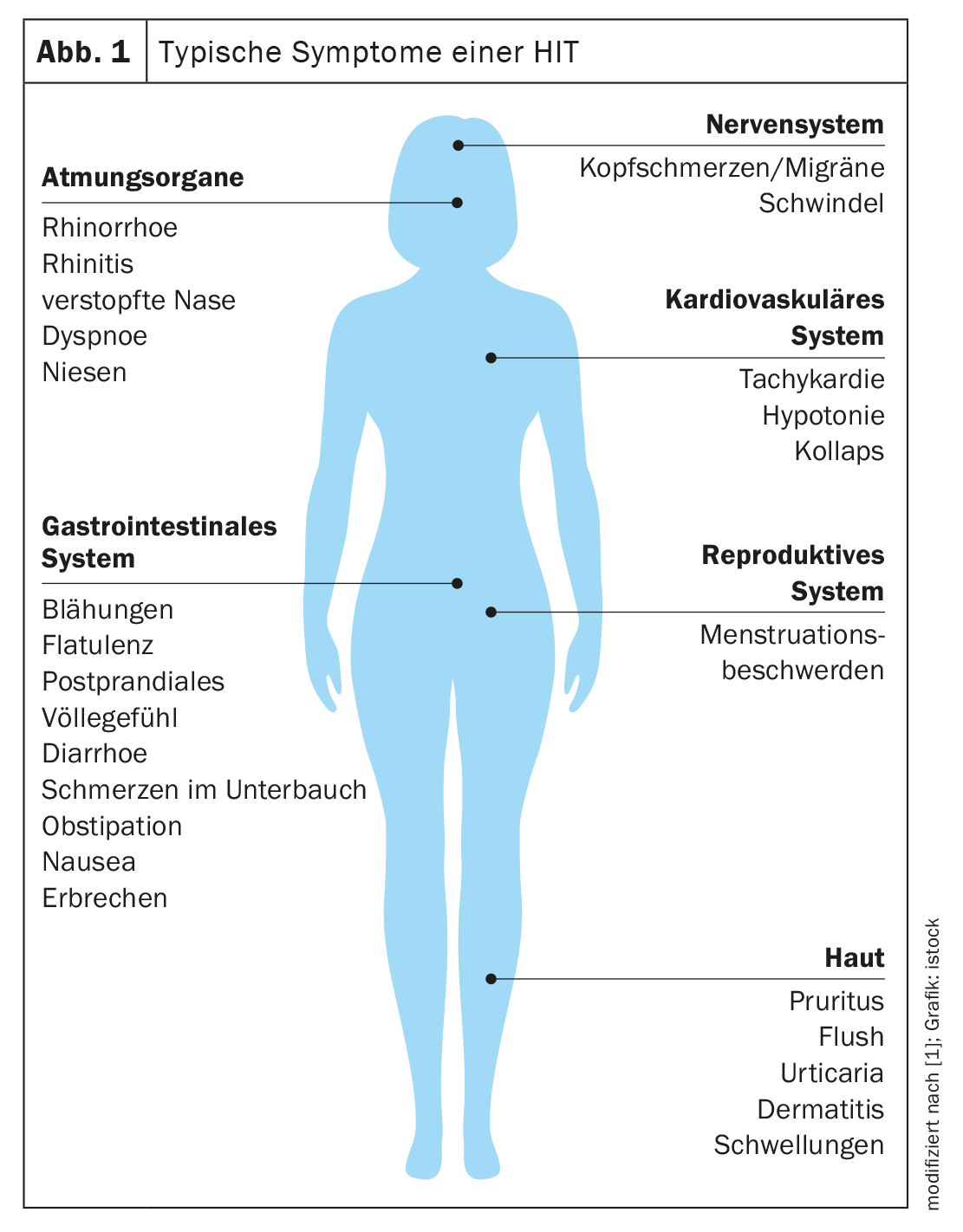
Les manifestations de la TIH peuvent être causées par différents mécanismes physiopathologiques ou par une combinaison de ceux-ci. Cette symptomatologie complexe est due au fait que l’on trouve des récepteurs à l’histamine dans de nombreux organes du corps [1]. Il en résulte une grande diversité mais aussi une inconstance des manifestations chez une même personne après des stimuli similaires. Les signes typiques sont des manifestations cutanées, par exemple des rougeurs sur le visage (flush), des démangeaisons ou des éruptions cutanées urticariennes sur le corps. Les symptômes gastro-intestinaux comprennent la diarrhée, mais aussi la constipation et les douleurs abdominales. Des manifestations dans le système cardiovasculaire telles que l’hypotension et la tachycardie sont également observées, ainsi que des troubles dans les systèmes nerveux et respiratoire. Il s’agit par exemple de maux de tête, de migraines ou de vertiges (Fig. 1) [1,3].
Taux d’histamine dans l’organisme
L’apparition de symptômes dépend du niveau d’histamine dans l’organisme. L’histamine est produite de manière endogène et est principalement stockée dans les mastocytes et les basophiles. Les mastocytes, les basophiles, les cellules gastriques de type entérochromaffine et les neurones histaminergiques sont les sources cellulaires d’histamine les mieux décrites. Mais d’autres types de cellules, par exemple les plaquettes, les cellules dendritiques (DC) et les cellules T, peuvent également exprimer l’histidine décarboxylase (HDC) après stimulation. L’expression des HDC et la libération d’histamine sont influencées par des cytokines telles que l’IL-1, l’IL-3, l’IL-12, l’IL-18, le GM-CSF, le facteur de stimulation des colonies de macrophages et le facteur de nécrose tumorale (TNF)-α 1, 11, 12 [4].
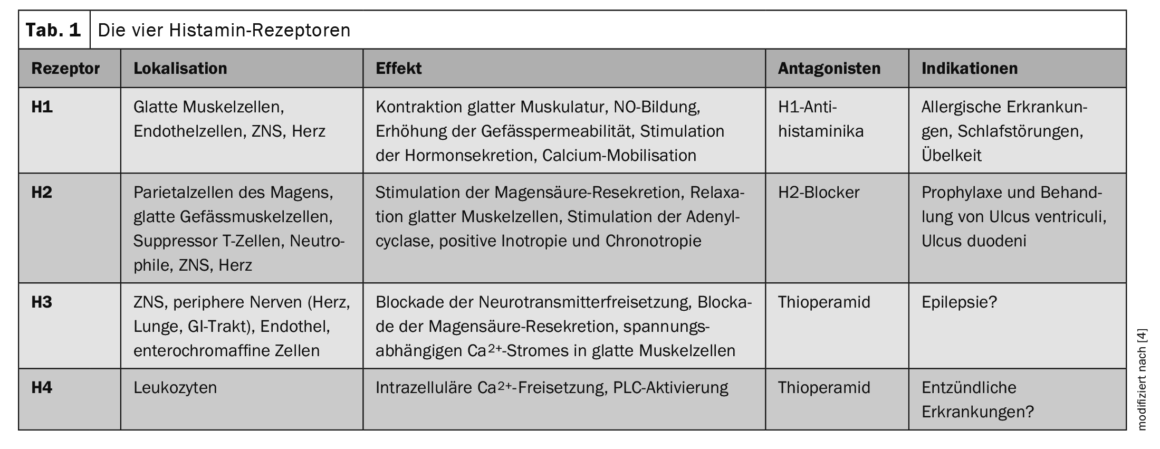
L’histamine affecte l’ensemble des fonctions physiologiques de différents tissus et cellules, y compris l’immunité [1,4]. D’un point de vue chimique, il s’agit d’une amine biogène ubiquitaire. Dans l’organisme, sa synthèse est assurée par décarboxylation de l’acide aminé L-histidine par l’enzyme L-histidine décarboxylase. L’histamine agit dans l’organisme comme agoniste des récepteurs histaminiques H1, H2, H3 et H4 [1]. Les différents effets dépendent des sous-types de récepteurs et de leurs différences d’expression (tableau 1) [4]. Les récepteurs H1 et H2 sont ubiquitaires, H2 étant surtout présent dans le tube digestif (estomac, duodénum, intestin grêle). Les récepteurs H3 sont abondants dans le système nerveux et les récepteurs H4 sont présents dans certains tissus (peau, amygdales), mais en faible quantité.
Les récepteurs H1 sont les plus étudiés. Ils sont exprimés dans de nombreuses cellules, y compris les mastocytes, et sont impliqués dans les réactions d’hypersensibilité de type 1. Comme H1R, H2R est exprimé dans une grande variété de tissus et de cellules, y compris le cerveau, les cellules pariétales de l’estomac, les cellules musculaires lisses, les cellules T et B et le tissu cardiaque. H2R peut moduler un certain nombre d’activités du système immunitaire, telles que la dégranulation des mastocytes, la synthèse d’anticorps, la production de cytokines et la polarisation des lymphocytes T. H3R est un autorécepteur présynaptique dans le système nerveux périphérique et central et a été démontré comme étant impliqué dans le rythme veille-sommeil, la cognition, la régulation homéostatique des niveaux d’énergie et l’inflammation. Le H4R est le récepteur le plus récent à avoir été découvert et partage certaines caractéristiques moléculaires et pharmacologiques avec le H3R. Cependant, contrairement à H3R, H4R est exprimé par une grande variété de cellules, y compris les kératinocytes, les cellules de Langerhans, les DC, les neutrophiles et les lymphocytes [4].
Dégradation de l’histamine
La dégradation de l’histamine se fait par désamination oxydative (diamine oxydase, DAO) ou par méthylation du cycle (histamine N-méthyltransférase, HNMT) [5]. La DAO est stockée dans des structures vésiculaires associées à la membrane plasmique dans les cellules épithéliales et est excrétée dans la circulation sanguine après stimulation. En revanche, l’histamine N-méthyltransférase est une enzyme cytosolique qui ne peut convertir l’histamine que dans l’espace intracellulaire. L’histamine N-méthyltransférase est largement répandue dans les tissus humains. L’expression la plus forte se trouve dans les reins et le foie, suivis de la rate, du côlon, de la prostate, des ovaires, des cellules de la moelle épinière, des bronches et de la trachée. L’histamine N-méthyltransférase est donc également considérée comme l’enzyme clé de la dégradation de l’histamine dans l’épithélium bronchique [4,6]. En revanche, chez les mammifères, l’expression de la DAO est limitée à certains tissus tels que l’intestin grêle, le côlon, le placenta et les reins [5]. La fonction physiologique de l’enzyme DAO comprend la régulation des processus inflammatoires, de la prolifération, des réactions allergiques et de l’ischémie [1]. L’action de la DAO peut être inhibée par l’alcool et les médicaments.
Diagnostic multidisciplinaire
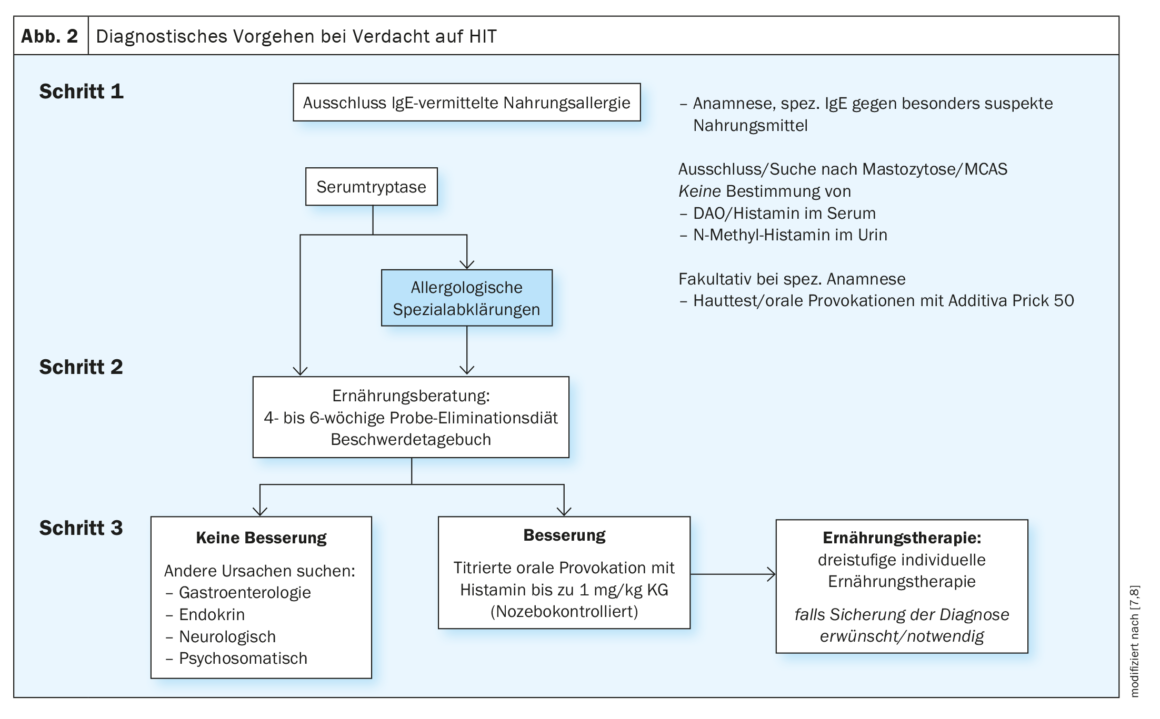
Le diagnostic de la TIH nécessite une approche multidisciplinaire complexe et longue, y compris l’élimination systématique des maladies présentant des symptômes similaires (figure 2) [7,8]. Les critères de diagnostic ou les marqueurs spécifiques à la TIH font défaut. On pense que la manifestation des symptômes de la TIH trouve son origine dans une diminution de la concentration/activité de la DAO. Sur cette base, la mesure de la concentration ou de l’activité de cette enzyme pourrait être effectuée pour le diagnostic de la TIH. Cependant, le problème est qu’une valeur de référence pour le taux de DAO dans le sérum n’a pas encore été établie. En outre, une valeur de DAO mesurée et/ou une activité de DAO mesurée dans le sérum peuvent différer du niveau/de l’activité fonctionnelle actuels de DAO dans la muqueuse intestinale. Actuellement, l’exclusion d’une allergie à médiation IgE proprement dite est donc une mesure judicieuse lorsque les troubles peuvent être mis en relation avec un aliment spécifique. Les tests cutanés, le diagnostic moléculaire des allergies et, le cas échéant, les tests de provocation orale aux additifs alimentaires souvent suspectés par les patients permettent d’effectuer un examen allergologique approfondi. Dans un deuxième temps, il faut penser à une mastocytose sous-jacente. Dans ce cas, le dosage de la tryptase sérique peut donner des indications. La détermination de la mutation c-Kit dans le sang périphérique ou un examen de la moelle osseuse peuvent également être utiles. Le diagnostic du syndrome d’activation des mastocytes (MCAS) repose quant à lui sur la réponse aux bloqueurs H1R et sur une augmentation significative de la tryptase sérique lors de la crise. Si ces mesures ne permettent pas d’obtenir une image claire, il convient de faire appel à un nutritionniste formé en allergologie. Une amélioration des symptômes sous réduction de l’histamine est en faveur d’une TIH – au moins comme co-facteur. Toutefois, si aucune amélioration n’est constatée ou si elle est à peine perceptible, des examens complémentaires sont indiqués. Il peut s’agir d’une provocation orale titrée à l’histamine, idéalement réalisée en double aveugle et contrôlée par placebo, avec des paramètres cliniquement définis comme critère d’évaluation. Dans ce cas, l’histamine est ajoutée à des niveaux de titration croissants jusqu’à 75 mg – y compris les placabodoses. Cela doit se faire dans le cadre d’une hospitalisation, en combinaison avec un régime approprié, des conseils nutritionnels et, si nécessaire, d’autres spécialistes en allergologie, dermatologie et psychosomatique. En Suisse, elle est proposée à la Hochgebirgsklinik Davos-Wolfgang(www.hochgebirgsklinik.ch) dans le cadre d’une hospitalisation de plusieurs jours. En cas de troubles gastro-intestinaux fréquents, un examen gastro-entérologique approfondi devrait également être effectué dans de nombreux cas. Mais des maladies hormonales ou neurologiques doivent également être envisagées en fonction des symptômes. Il est également rare de pouvoir exclure totalement les troubles psychosomatiques, qu’il s’agisse d’une cause primaire ou d’une conséquence de l’insécurité alimentaire permanente.
Les récepteurs de l’histamine (H1, H2 et surtout H3) étant présents à la fois dans le système nerveux périphérique et central, l’histamine a un impact important sur les aspects neuropsychologiques. En outre, la N-méthyltransférase joue un rôle essentiel dans la dégradation de l’histamine dans le SNC. C’est pourquoi, outre la migraine déjà mentionnée, d’autres maladies telles que la maladie de Parkinson, le TDAH ou la myasthénie grave sont liées à une altération de la fonction de cette enzyme. Comme certains médicaments, tels que la chlorquine, inhibent la N-méthyltransférase, les effets neuro-psychologiques et les symptômes de l’histamine peuvent être renforcés par les médicaments correspondants [9,10].
Le fait que des facteurs psychosomatiques puissent être impliqués est également démontré d’une autre manière par le fait que, lors de provocations contrôlées par placebo, une proportion non négligeable de patients ressentent des troubles, même en réponse au seul placebo, comme lors de l’ingestion de produits contenant de l’histamine. Le fait de s’attendre à ce que les aliments riches en histamine provoquent des troubles peut donc également être “gravé” dans l’esprit, surtout si cette expérience a été vécue à plusieurs reprises. Comme les facteurs qui influencent la dégradation de l’histamine, tels que le microbiome, peuvent changer, il est certainement justifié d’essayer d’assouplir progressivement les mesures diététiques, en particulier avec l’aide d’un nutritionniste expérimenté.
Gestion du traitement de la TIH
Parmi les approches thérapeutiques, l’étalon-or est un régime pauvre en histamine. Une bonne réponse à un tel régime est considérée comme une confirmation de la TIH. Outre les mesures diététiques, une supplémentation en DAO, qui favorise la dégradation de l’histamine ingérée, peut être envisagée comme traitement complémentaire pour les personnes souffrant d’un déficit intestinal en DAO. L’utilisation d’antihistaminiques ciblant les H1R peut également être utile.
Régime pauvre en histamine : le principe du régime pauvre en histamine consiste à sélectionner des aliments pour lesquels une quantité excessive d’histamine ou d’amines biogènes n’est pas attendue. Elle est divisée en trois phases : Phase d’attente, Phase de test et Nutrition permanente. Dans un premier temps, il convient d’exclure complètement les aliments qui contiennent typiquement une grande quantité d’histamine. Il existe de grandes différences entre les études en ce qui concerne le type d’aliments à éviter pendant le régime d’élimination. Certains des aliments systématiquement exclus ne contiennent que de faibles quantités d’amines biogènes et sont appelés “libérateurs d’histamine” [11]. Pendant dix jours à trois semaines, l’accent doit être mis sur une alimentation mixte à base de légumes, les aliments devant être consommés aussi frais que possible. Ensuite, pendant environ six semaines, la phase de test est suivie par la réintroduction ciblée des aliments suspects. Au cours de la phase de nutrition continue, des éliminations individuelles doivent permettre de couvrir les besoins nutritionnels tout en maintenant une bonne qualité de vie. Souvent, les personnes concernées tirent déjà profit d’une modification de la combinaison des principaux groupes d’aliments (protéines, lipides, glucides) ou/et d’une modification de la structure des repas.
Supplémentation en DAO : de la même manière qu’un supplément de lactase est utilisé pour l’intolérance au lactose, l’apport exogène de l’enzyme DAO a été développé pour la TIH [1]. Un extrait de rein de porc contenant 0,3 mg d’enzyme DAO peut être administré comme aliment à des fins médicales spéciales. La dose journalière maximale d’enzyme absorbée de manière exogène est de 3× 0,3 mg, ce qui correspond à 0,9 mg de DAO. En pratique clinique, il a été démontré que la supplémentation exogène en DAO peut améliorer de manière significative les symptômes chez une partie des patients. Une supplémentation en vitamine C (100-1000 mg/jour), en vitamine B6 ou en cuivre peut également être envisagée, car ces substances favorisent la dégradation de l’histamine via la DAO ou la HNMT.
Antihistaminiques : le traitement des patients avec des antihistaminiques est empirique. Il n’existe pas d’études cliniques randomisées démontrant l’apport de ce traitement dans la TIH. Toutefois, compte tenu de leur efficacité et de leur sécurité, les antihistaminiques H1 de deuxième ou troisième génération devraient avoir la priorité. Les bloqueurs H2 pourraient être utilisés chez les patients présentant des symptômes gastro-intestinaux dominants. Le traitement par antihistaminiques doit être délibéré et limité dans le temps et doit aider à se faire une idée si le blocage des récepteurs H1/H2 atténue les manifestations. En conséquence, ils peuvent également être utilisés comme test de diagnostic thérapeutique [1].
Conclusion
La TIH est un ensemble de troubles différents qui surviennent après la consommation d’aliments riches en histamine. Les manifestations peuvent être causées par différents mécanismes physiopathologiques ou une combinaison de ceux-ci. Le diagnostic d’une TIH nécessite donc une approche multidisciplinaire complexe et longue, incluant l’élimination systématique des maladies présentant des symptômes similaires. Un régime pauvre en histamine est actuellement une mesure diagnostique et thérapeutique appropriée (mais pas la seule). En plus des mesures diététiques, une supplémentation orale en DAO ainsi que l’utilisation d’antihistaminiques ciblant les H1R peuvent s’avérer efficaces [12].
Messages Take-Home
- La TIH est une intolérance alimentaire qui comprend une série de réactions indésirables dues à l’histamine accumulée ou ingérée.
- Elle est causée par un déséquilibre entre la quantité d’histamine libérée par l’alimentation et la capacité de l’organisme à éliminer cette quantité.
- Les symptômes vont des troubles gastro-intestinaux aux maux de tête ou aux vertiges, en passant par les éternuements, les difficultés respiratoires, les flushs et les démangeaisons.
- Le diagnostic doit être multidisciplinaire et la systématisation des
Inclure l’élimination des maladies présentant des symptômes similaires. - Un régime alimentaire graduellement pauvre en histamine, une supplémentation orale en DAO et l’administration d’antihistaminiques ciblant les H1R peuvent contribuer à soulager les symptômes des patients atteints de TIH.
Littérature :
- Hrubisko M, Danis R, Huorka M, Wawruch M: Histamine Intolerance – The More We Know the Less We Know. A Review. Nutrients 2021; 13(7): 2228.
- Colombo FM, Cattaneo P, Confalonieri E, Bernardi C: Histamine food poisonings: A systematic review and meta-analysis. Crit Rev Food Sci Nutr 2018; 58: 1131–1151.
- Reese I, Ballmer-Weber B, Beyer K, et al.: German guideline for the management of adverse reactions to ingested histamine. Allergologie 2021; 10:761-772.
- Smolinska S, et al.: Histamine and gut mucosal immune regulation. Allergy 2014; 69(3): 273-81.
- Klocker J, Matzler SA, Huetz GN, et al.: Expression of histamine degrading enzymes in porcine tissues. Inflamm Res 2005; 54(Suppl 1): S54–S57.
- Yamauchi K, Sekizawa K, Suzuki H, et al.: Structure and function of human histamine N-methyltransferase: critical enzyme in histamine metabolism in airway. Am J Physiol 1994; 267(3 Pt 1): L342–L349.
- Reese I, et al.: Guideline on management of suspected adverse reactions to ingested histamine: Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Society for Pediatric Allergology and Environmental Medicine (GPA), the Medical Association of German Allergologists (AeDA) as well as the Swiss Society for Allergology and Immunology (SGAI) and the Austrian Society for Allergology and Immunology (ÖGAI). Allergol Select 2021; 5: 305–314.
- Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D: Food Intolerances. Nutrients 2019; 11(7): 1684.
- Sergeeva OA, Klyuch BP, Fleischer W, et al.: P2Y receptor-mediated excitation in the posterior hypothalamus. Eur J Neurosci. 2006 Sep; 24(5): 1413–1426.
- Yoshikawa T, Nakamura T, Yanai K. Histamine N-Methyltransferase in the Brain. Int J Mol Sci. 2019 Feb 10;20(3): 737.
- Sánchez-Pérez S, Comas-Basté O, Veciana-Nogués M, et al.: Low-histamine diets: Is the exclusion of foods justified by their histamine content? Nutrients 2021; 13: 1395.
- Schmid-Grendelmeier P , Gianelli D, Gutzweiler JP, et al.: Histaminintoleranz – zwischen Mythen und Fakten. Schweizer Zeitschrift für Ernährungsmedizin 2022; 2: 10–15.
InFo NEUROLOGIE & PSYCHIATRIE 2023; 21(3): 6–10