Les patients atteints d’épilepsie généralisée idiopathique et les enfants atteints d’épilepsie de Rolando peuvent être complètement dispensés d’IRM. En revanche, le diagnostic par IRM à haute résolution doit absolument être pratiqué en cas d’épilepsie focale non traitable par des médicaments. L’intensité du champ IRM doit être d’au moins 1,5 tesla, mais idéalement de 3 teslas. Une haute résolution spatiale avec la séquence IRM avec des épaisseurs de coupes ≤3 mm, en tenant compte d’un rapport signal/bruit suffisant, est importante pour détecter les lésions souvent très petites et subtiles. Les séquences 3D avec des volumes de voxels isotropes permettent non seulement des reformatages multiplanaires, mais elles sont également particulièrement adaptées au post-traitement automatisé (analyse basée sur les voxels), qui permet de trouver des dysplasies supplémentaires non détectées autrement dans environ 5% des cas. La séquence FLAIR est la plus importante pour le diagnostic.
D’une manière générale, le diagnostic de l’épilepsie nécessite tout d’abord de distinguer s’il s’agit de crises occasionnelles ou de crises récurrentes généralisées ou focales. Les crises généralisées (primaires) partent d’un point précis d’un réseau neuronal impliquant les deux hémisphères cérébraux, avec une propagation rapide. Le point de départ et la latéralisation ne sont pas constants d’une crise à l’autre, et il n’y a pas de lésion épileptogène sous-jacente.
Les crises focales partent d’un réseau neuronal limité à un hémisphère cérébral, c’est souvent à ce niveau que l’on trouve une lésion épileptogène. Pour chaque type de crise, le début des crises individuelles est constant et associé à des schémas de propagation préférentiels qui peuvent impliquer l’hémisphère controlatéral. Les crises focales peuvent évoluer sans (anciennement : crise focale simple) ou avec une restriction de la conscience (anciennement : crise focale complexe) et se transformer en crises généralisées toniques, cloniques ou tonico-cloniques (anciennement : crise secondairement généralisée) [1].
L’attention du neuroradiologue est focalisée sur les crises focales [2]. Souvent, ce que l’on appelle l’aura, c’est-à-dire la phase initiale d’une crise focale dont le patient se souvient, et les symptômes cliniques observés pendant la crise d’épilepsie indiquent le lieu d’origine de la crise (tableau 1).
Cependant, les lésions épileptogènes des épilepsies focales sont souvent négligées [3]. Trois raisons principales expliquent qu’ils soient ignorés :
- Les lésions épileptogènes sont souvent de petite taille et ne nécessitent pas d’espace. Ils évoluent peu au cours de la vie et se distinguent ainsi d’une tumeur ou d’un infarctus, qui sont détectés au plus tard lors des examens de suivi en raison de leur croissance ou de leur rétrécissement et de leur démarcation.
- Le neuroradiologue ne dispose pas d’informations cliniques ou ne peut pas classer les examens cliniques disponibles. C’est-à-dire qu’il ne sait pas s’il peut trouver une lésion épileptogène et, si oui, dans quelle région du cerveau il doit la chercher.
- Les tomographies IRM réalisées sont de qualité insuffisante en termes d’orientation anatomique, de résolution spatiale et de rapport signal/bruit ou contraste/bruit.
Protocole d’IRM
A cet égard, les points suivants doivent être pris en compte :
Intensité du champ : l’intensité du champ doit être d’au moins 1,5 tesla, idéalement de 3 teslas. Le rapport signal/bruit est environ 1,8 fois plus élevé à 3 Tesla qu’à 1,5 Tesla.
Orientation : les couches transversales (axiales) sont orientées soit le long d’une ligne passant par la commissure antérieure et la commissure postérieure, soit le long d’une ligne passant par l’axe longitudinal des hippocampes (“angulation temporale”). Les couches coronaires doivent toujours être orientées perpendiculairement à l’axe longitudinal des hippocampes (“angulation temporale”). Afin d’obtenir une représentation symétrique des deux hémisphères cérébraux, il est important que le plan coronal soit correctement aligné le long de l’axe a.p. La planification des séquences se fait donc de manière optimale sur une séquence d’écho de gradient sagittale pondérée en T1 avec des couches minces et sur une séquence axiale pondérée en T2. Les séquences 3D avec voxels isotropes permettent un reformatage multiplanaire, de sorte que les angulations non exactes peuvent être compensées posthoc.
Résolution spatiale : les lésions épileptogènes susceptibles de faire l’objet d’une chirurgie de l’épilepsie ont souvent un diamètre de seulement cinq à sept millimètres. Les exemples incluent les petits cavernomes, les dysplasies corticales focales (FCD) de type 2b selon Palmini situées dans la profondeur du sillon ou les petites hétérotopies nodulaires périventriculaires ; ces dernières ne présentent toutefois aucune perspective d’absence de crises après la chirurgie. La probabilité de détecter une lésion épileptogène dépend d’une part du contraste avec la substance grise ou blanche environnante et d’autre part de la taille des voxels des séquences utilisées. Pour qu’une lésion ne soit pas “masquée” par des effets de volume partiel, elle doit avoir une taille de trois voxels ou, dans le meilleur des cas, de deux voxels. Cela signifie que l’épaisseur des couches des séquences 2D ne doit pas dépasser trois millimètres [4].
Contrastes : la résolution spatiale et le rapport signal/bruit sont inversement proportionnels. Les deux peuvent être améliorés avec un temps de mesure plus long, mais en même temps, la probabilité de l’instabilité du mouvement augmente. Il faut donc trouver un compromis raisonnable entre la qualité de l’image et le temps de mesure. Il est donc relativement fréquent que des examens IRM soient nécessaires chez des patients sous sédation ou sous anesthésie par intubation. Si l’on compare les séquences 2D et 3D, les séquences 2D ont un meilleur rapport signal/bruit, avec une épaisseur de couche généralement plus élevée et une meilleure résolution “dans le plan”. Inversement, les images 3D acquises dans le sens sagittal peuvent être reformatées en conséquence et la lésion peut ainsi être mise en évidence.
Post-traitement (morphométrie basée sur les voxels) : Pour le post-traitement, on utilise des séquences 3D avec des voxels isotropes, généralement de 1 mm3. Dans la procédure développée par H.J. Huppertz, sur la base du logiciel SPM, les enregistrements pondérés en T1 sont d’abord “normalisés” sur un cerveau standard et corrigés en intensité. Il s’ensuit une segmentation en substance grise, substance blanche et LCR et la création d’images binaires (substance grise et substance blanche). A partir de là, il est possible de calculer différentes cartographies (“Thickness-, Extension-, Junction-Image”) et de “mettre en lumière” les différences en les soustrayant aux images d’un groupe de contrôle. La qualité de ces images dépend fortement de la qualité d’acquisition à la fois du patient individuel et du groupe de contrôle qui n’est pas totalement dépourvu de scanners. Les lésions mises en évidence peuvent être des lésions faussement positives et doivent dans tous les cas être retrouvées sur les images structurelles [5].
Sur la base des considérations ci-dessus, la commission “Imagerie structurelle” de la section allemande de la Ligue internationale contre l’épilepsie a recommandé un protocole d’IRM composé des séquences décrites dans le tableau 2 [4].
L’administration d’un produit de contraste supplémentaire peut être utilisée pour spécifier, mais pas pour détecter une lésion épileptogène. L’évaluation des images à l’aide de la morphométrie basée sur les voxels peut se faire sur une base individuelle et est principalement utilisée par les services de neuroradiologie spécialisés en collaboration avec les centres de chirurgie de l’épilepsie.
Lésions épileptogènes
Les résultats de résection obtenus par les grands centres de chirurgie épileptique montrent que les lésions épileptogènes peuvent être différenciées en trois grands groupes : Scléroses hippocampiques, tumeurs glioneuronales, dysplasies corticales focales [6] :
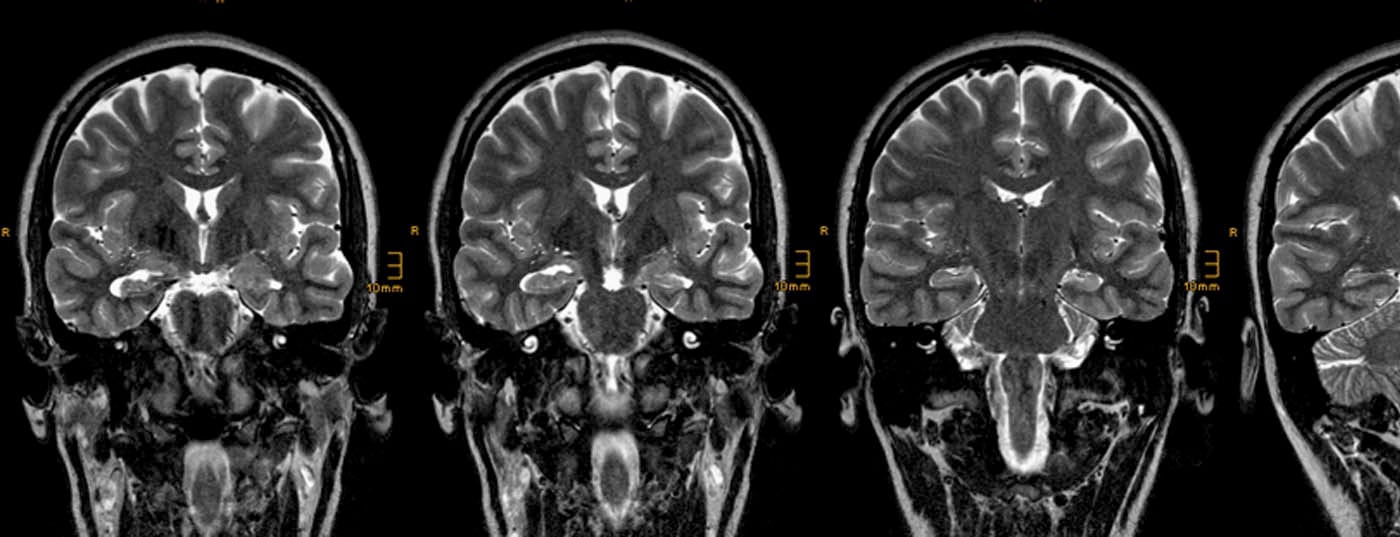
Sclérose de l’hippocampe : Le corrélat IRM de la sclérose de l’hippocampe consiste en une atrophie et une augmentation du signal de l’hippocampe sur les clichés FLAIR et T2 pondérés TSE (Fig. 1).
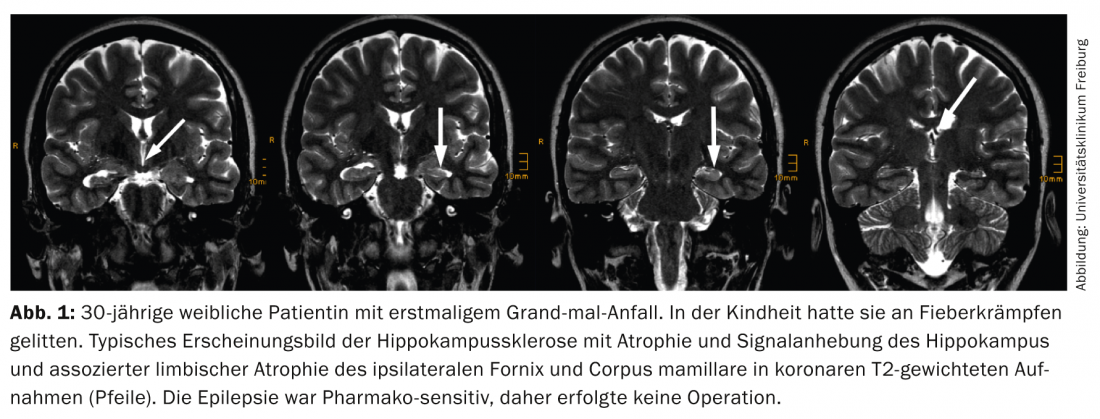
La meilleure façon de visualiser ce motif est sur des clichés coronariens à angulation temporale, d’environ deux à trois millimètres d’épaisseur. Les points suivants doivent être pris en compte :
- On s’intéresse surtout à la couche passant par la tête de l’hippocampe, car c’est là que le volume relatif de l’hippocampe est le plus important et que les différences latérales sont donc le plus facilement identifiables. En revanche, le diagnostic neuropathologique de sclérose de l’hippocampe est établi sur des coupes coronales du corps de l’hippocampe, car ce n’est que sur ces coupes que l’on peut établir une correspondance fiable entre les différents secteurs de Sommer de l’hippocampe.
- Si l’on compare les enregistrements pondérés T2 et FLAIR, les enregistrements FLAIR présentent un rapport contraste/bruit plus élevé. L’inconvénient est que les structures limbiques déjà saines présentent une intensité de signal plus élevée sur les images FLAIR, ce qui augmente la probabilité de diagnostics faussement positifs [7].
- Une sclérose bilatérale de l’hippocampe est observée chez jusqu’à 20% des patients, dans ce cas, la détermination du temps de relaxation T2 peut être utile.
- L’atrophie hippocampique entraîne également l’aplatissement des digitationes hippocampi dirigées vers le haut, qui sont également les plus visibles dans la tête de l’hippocampe, mais cet effet est également observé dans l’atrophie liée à l’âge. De même, on observe souvent une dilatation de la corne inférieure du ventricule, mais le système ventriculaire est souvent asymétrique, même chez les personnes en bonne santé, de sorte que ce signe est peu fiable.
- L’atrophie hippocampique sans anomalies de signal est extrêmement rare, elle est décrite dans moins de 5% des scléroses hippocampiques histologiquement confirmées.
- Des lésions supplémentaires à la sclérose de l’hippocampe sont observées chez jusqu’à 20% des patients (“pathologie duale”).
- Les modifications supplémentaires du système limbique comprennent une atrophie de l’amygdale, du cortex entorhinal, du corps mamillaire ipsilatéral, du fornix ipsilatéral et un trouble de la différenciation gris-blanc du lobe temporal antérieur. Cette dernière est également considérée par certains auteurs comme une dysplasie corticale focale et, avec la sclérose hippocampique, comme une pathologie duale.
Tumeurs glioneuronales : le gangliogliome et la tumeur neuroépithéliale dysembryoplasique (DNT) présentent des éléments neuronaux et gliaux (= tumeurs glioneuronales), se caractérisent par leur localisation dans le cortex et les camps médullaires adjacents et provoquent typiquement des crises d’épilepsie impossibles à traiter par des médicaments.
Les corrélats IRM du gangliogliome sont la localisation corticale/sous-corticale préférentiellement dans le gyrus parahippocampique et temporo-occipital latéral. L’association d’un ou de plusieurs kystes intracorticaux, d’une zone circonscrite d’augmentation du signal cortical/sous-cortical sur les images pondérées FLAIR/T2 et d’un nodule de prise de contraste est classique. La calcification est présente dans un tiers des cas. S’il n’y a pas de prise de contraste (dans environ 50% des cas), la distinction avec la dysplasie peut être difficile. Dans ces cas, ce sont surtout le(s) kyste(s) intracortical(aux) qui indiquent la voie à suivre. Les gangliogliomes sont des tumeurs OMS°I dans 90% des cas et des tumeurs OMS°III dans 10% des cas. Les signes évocateurs d’un gangliogliome WHO°III sont un œdème périfocal, une localisation extratemporale, le sexe masculin, l’âge >40 ans, l’absence de crises d’épilepsie, et une composante tumorale gemistocytaire [8].
Le corrélat IRM (de la variante simple) du DNT est constitué de multiples petits kystes (Fig. 2) qui correspondent histologiquement à l’élément glioneuronal et sont mieux détectés sur les clichés d’EST pondérés en T2 à haute résolution.
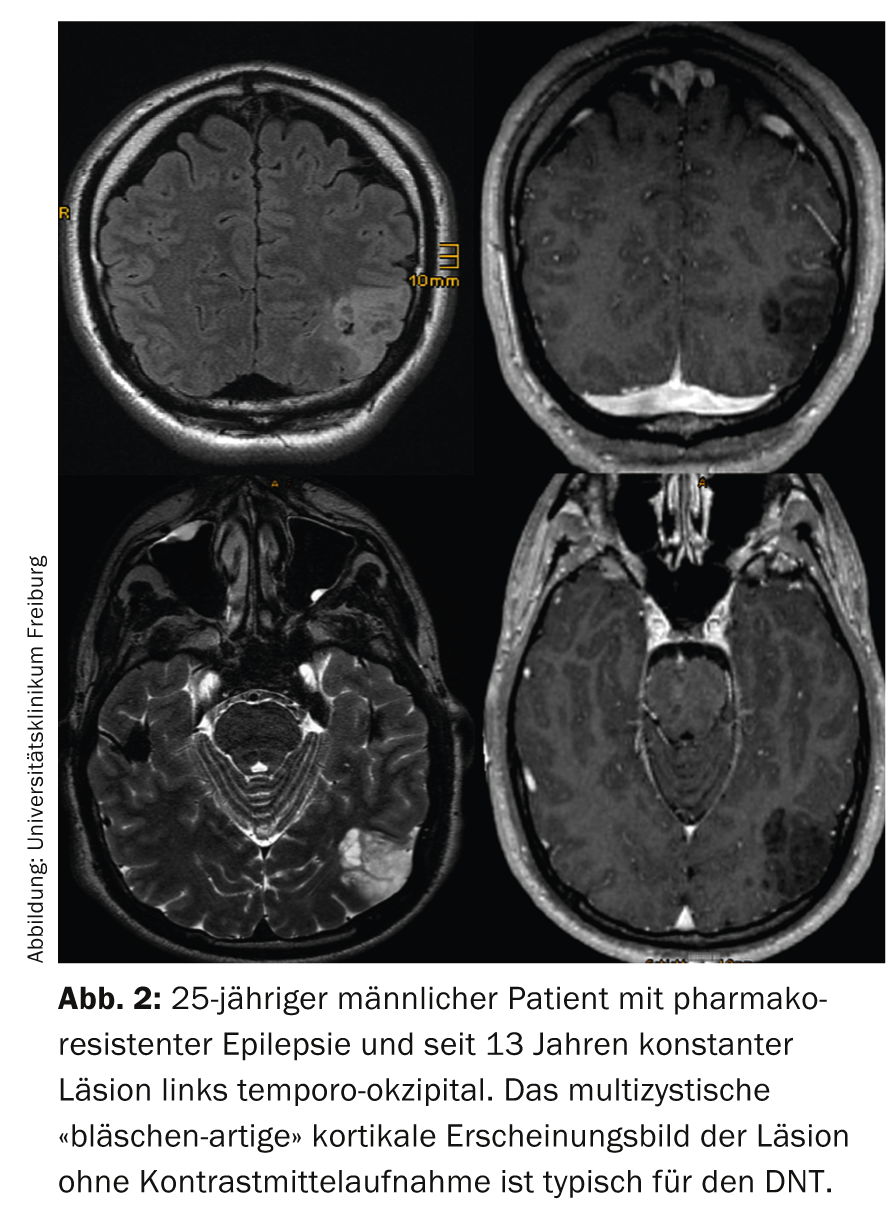
Dans la variante complexe, des calcifications ou même des hémorragies, détachées de l’élément glioneuronal, s’ajoutent. Une prise de contraste annulaire au sein de l’élément glioneuronal est parfois observée, mais il est intéressant de noter qu’elle peut également disparaître. D’un point de vue clinique, les DNT sont toujours des tumeurs WHO°I et environ 15% des DNT sont encore aujourd’hui confondues avec des tumeurs gliales (typiquement des oligodendrogliomes) [9].
Pour une description plus détaillée des autres tumeurs mentionnées ci-dessus, veuillez vous référer aux manuels [10].
Les tumeurs astrocytaires ayant une localisation et une épileptogénicité similaires sont l’astrocytome pilocytique et le xanthoastrocytome pléomorphe (PXA). La quatrième édition de la classification de l’OMS a également inclus dans la catégorie des autres tumeurs neuroépithéliales le gliome angiocentrique (tumeur neuroépithéliale angiocentrique, ANET), qui provoque typiquement des crises d’épilepsie et présente des similitudes histologiques avec l’épendymome [11]. Le terme “long term epilepsy associated tumors” (LEATs) est aussi couramment utilisé pour désigner les tumeurs mentionnées ci-dessus [12].
Dysplasies corticales focales (FCD) : La classification et la corrélation avec l’imagerie ne sont pas uniformes entre les différents centres de chirurgie épileptique, la seule dysplasie clairement définie est la FCD IIb caractérisée par des cellules à ballonnet. En IRM, le cortex altéré est isointense sur les clichés pondérés en T1, iso- ou légèrement hyperintense sur les clichés pondérés en T2 et légèrement hyperintense sur les clichés FLAIR. On observe également une hyperintensité nette en forme d’entonnoir, sous-corticale, se rétrécissant en direction du ventricule latéral et atteignant parfois le ventricule latéral, qui est mieux visible sur les clichés FLAIR que sur les clichés pondérés en T2 (Fig. 3) et qui a donné son nom à la dysplasie transmurale.
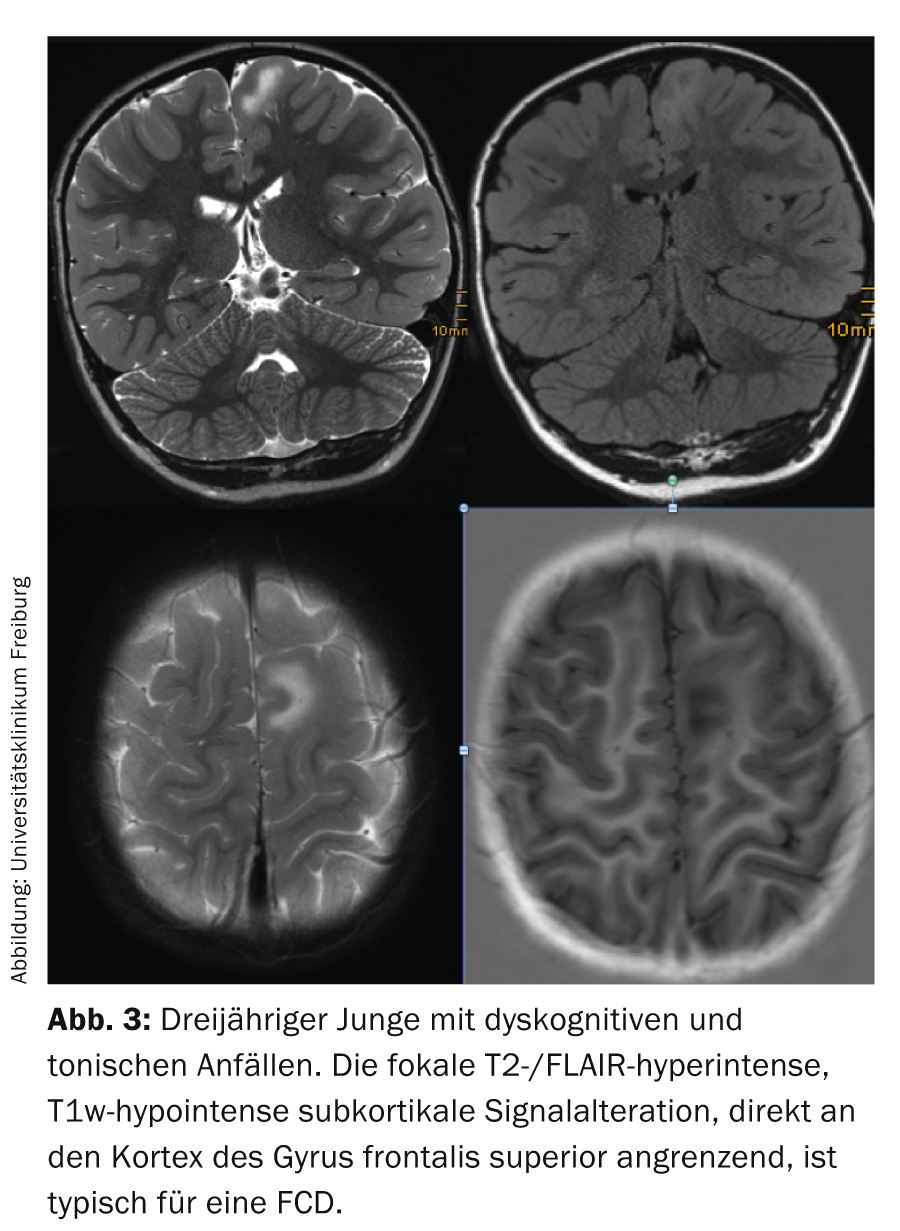
Les lésions sont généralement solitaires et de localisation néocorticale, elles touchent le plus souvent le lobe frontal (probablement en raison de la taille du lobe). En cas de lésions multiples, on pense à une sclérose tubéreuse et on recherche des calcifications sous-épendymaires et un astrocytome à cellules géantes. Les lésions peuvent être de taille variable : les très petites lésions se situent de manière caractéristique dans la vallée du sulcus et passent facilement inaperçues sur les coupes axiales. En raison de l’orientation, il faut ici exiger des images FLAIR coronales et sagittales ou un jeu de données 3D avec les reformatages correspondants. Les très grandes lésions peuvent parfois toucher la majeure partie d’un hémisphère, elles ne sont souvent pas complètement résorbables, ce qui réduit le risque d’absence de crises postopératoires à moins de 50%.
Outre les entités susmentionnées, un grand nombre de lésions épileptogènes différentes sont trouvées chez les patients atteints d’épilepsie focale, de sorte que la proportion d’examens IRM négatifs diminue au fil du temps, quoique légèrement [6,13]. Pour le médecin et le patient, il est d’abord rassurant d’avoir trouvé la cause des crises d’épilepsie. En particulier dans le cas d’épilepsies focales non contrôlables par des médicaments, ce point et le fait qu’en présence de lésions épileptogènes appropriées, environ 70% des patients ne font plus de crises grâce à une opération devraient inciter à effectuer un examen IRM ciblé et à adresser éventuellement le patient à un centre de chirurgie de l’épilepsie.
PD Dr. med. Stephan Meckel
Littérature :
- Berg AT, et al. : Terminologie et concepts révisés pour l’organisation des crises et des épilepsies : Rapport de la commission de classification et de terminologie de l’ILAE, 2005-2009. Epilepsia 2010;1-10 Terminologie et concepts révisés pour l’organisation des crises d’épilepsie et des épilepsies : Rapport de la commission de classification et de terminologie de la Ligue internationale contre l’épilepsie. Akt Neurol 2010 ; 37 : 120-130.
- Urbach H : Imagerie des épilepsies. Eur Radiol 2005 ; 15 : 494-500.
- von Oertzen J, et al : L’IRM standard est insuffisante pour les patients atteints d’épilepsie focale réfractaire. J Neurol Neurosurg Psychiatry 2002 ; 73 : 643-647.
- Wellmer J, et al. : Proposition d’un protocole d’imagerie par résonance magnétique pour la détection des lésions épileptogènes aux stades précoces de l’outpatient. Epilepsia 2013 Oct 7. [Epub ahead of print].
- Huppertz HJ : Analyse morphométrique par IRM. In : IRM dans l’épilepsie. Ed Urbach H. Springer Heidelberg, New York, Dordrecht, London 2013 ; 73-84.
- Bien CG, et al. : Trends in presurgical evaluation and surgical treatment of epilepsy at one centre from 1988-2009. J Neurol Neurosurg Psychiatry 2013 Jan ; 84(1) : 54-61.
- Hirai T, et al. : Lobe limbique du cerveau humain : évaluation avec l’imagerie RM d’inversion-récupération assistée par fluide turbo. Radiology 2000 ; 215 : 470-475.
- Majores M, et al : Récurrence tumorale et progression maligne des gangliomes. Cancer 2008 ; 113 : 3355-3363.
- Campos AR, et al : Tumeurs neuroépithéliales dysembryoplasiques simples et complexes (DNT) : profil clinique, IRM et histopathologie. Neuroradiologie 2009 ; 51 : 433-439.
- Urbach H : Epilepsy associated tumors and tumor-like lesons. In : IRM dans l’épilepsie. Ed Urbach H. Springer Heidelberg, New York, Dordrecht, London 2013 ; 109-124.
- Louis DN, et al : The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007 ; 114 : 97-109.
- Luyken C, et al : The Spectrum of Long-term associated Tumors : Long-term Seizure and Tumour outcome and Neurosurgical aspects. Epilepsia 2003 ; 44 : 822-830.
- Bien CG, et al : Caractéristiques et résultats chirurgicaux des patients atteints d’épilepsies réfractaires à l’IRM négative. Arch Neurol 2009 ; 66 : 1491-1499.
- Wagner J, et al : Morphometric MRI analysis improves detection of focal cortical dysplasia type.II. Brain 2011 Oct ; 134(10) : 2844-2854.
InFo NEUROLOGIE & PSYCHIATRIE 2014 ; 12(4) : 4-9