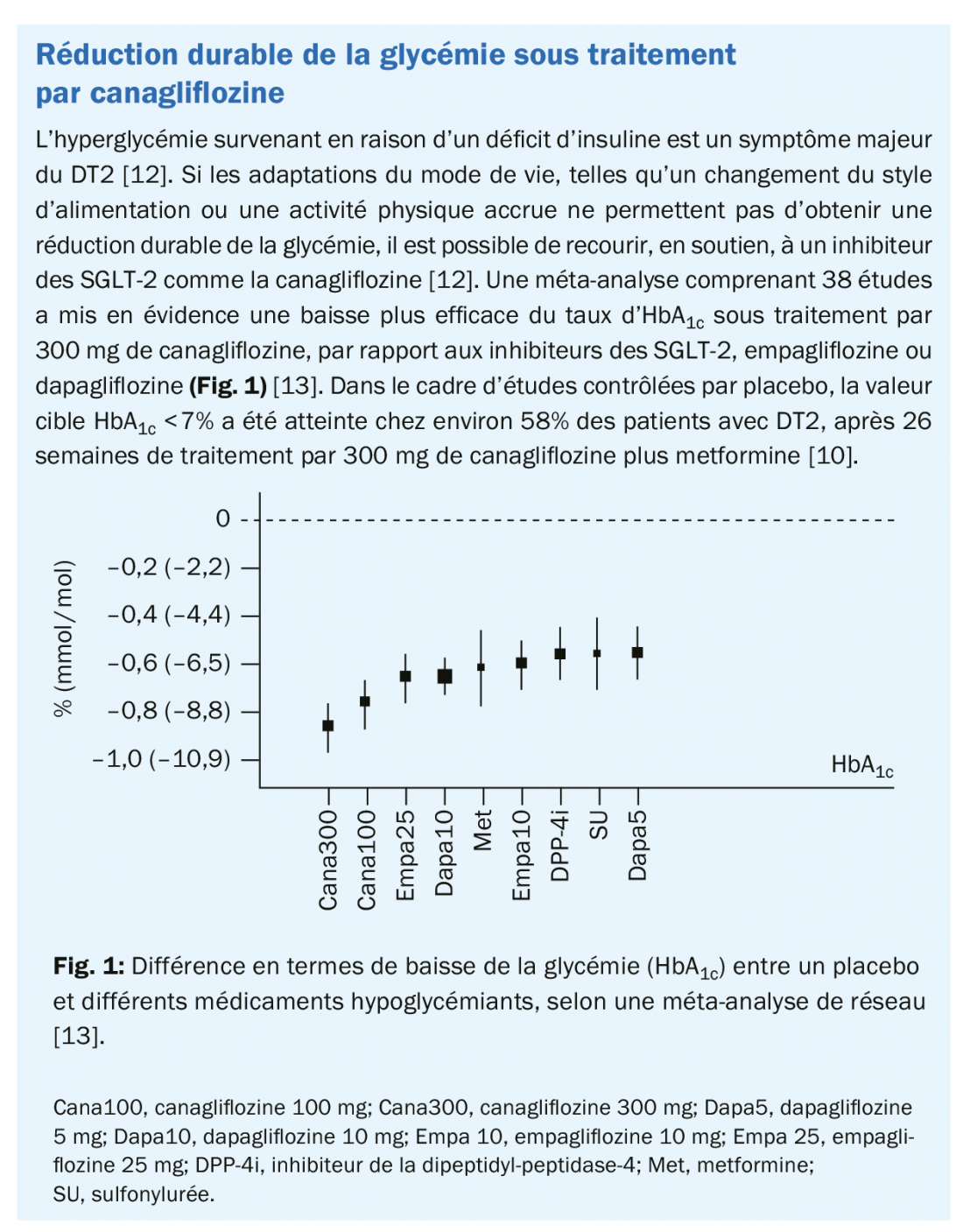
Le diabète de type 2 (DT2) est associé à une forte augmentation du risque de maladies cardiovasculaires [1]. La prise en charge conjointe du DT2 et des risques cardiovasculaires est donc devenue une priorité [1].
Le diabète est l’une des maladies les plus fréquentes au monde, et le nombre de patients qui en sont atteints ne cesse d’augmenter [2,3]. La Suisse compte 500’000 personnes diabétiques, dont 460’000 présentent un diabète de type 2 (DT2) [3]. Dans ce contexte, le risque cardiovasculaire est, lui aussi, nettement plus élevé [2]. Selon la méta-analyse «Emerging Risk Factor Collaboration», le risque de maladie coronarienne, d’accident vasculaire cérébral ischémique et de décès d’origine vasculaire est multiplié par deux chez les patients diabétiques, indépendamment des autres facteurs de risque [4]. Par ailleurs, le DT2 et les maladies cardiovasculaires sont favorisés par les mêmes facteurs de risque typiques, tels que l’obésité, l’hypertension, la résistance à l’insuline et la dyslipidémie [2]. En conséquence, réduire le risque cardiovasculaire dans le cadre du traitement du DT2 est devenu un enjeu de plus en plus important au cours des dernières années. [5].
Réduction du risque cardiovasculaire en priorité
La gestion et la prévention des maladies cardiovasculaires liées au DT2 sont prioritaires dans les Directives actualisées en 2019 de l’European Society of Cardiology (ESC) et de l’European Association for the Study of Diabetes (EASD) [5]. Dans ce cadre, de nouvelles catégories de risque cardiovasculaire (risque modéré, élevé, très élevé) ont été définies, qui tiennent également compte de la durée du diabète et des comorbidités (Tab. 1) [5]. En outre, l’administration de metformine en première intention n’est plus prévue que pour les patients obèses, qui ne présentent pas de risque cardiovasculaire, ou présentent un risque modéré. Chez les patients à risque cardiovasculaire élevé ou très élevé, un traitement de première ligne par un inhibiteur des SGLT-2 ou un agoniste du récepteur GLP-1 est privilégié en lieu et place de la metformine [5]. L’utilisation la plus précoce possible d’un inhibiteur des SGLT-2 ou d’un agoniste du récepteur GLP-1 associé à la metformine est également recommandée dans les nouvelles Recommandations de la Société Suisse d’Endocrinologie et de Diabétologie (SSED) [6].

Amélioration des résultats cardiovasculaires sous traitement par canagliflozine
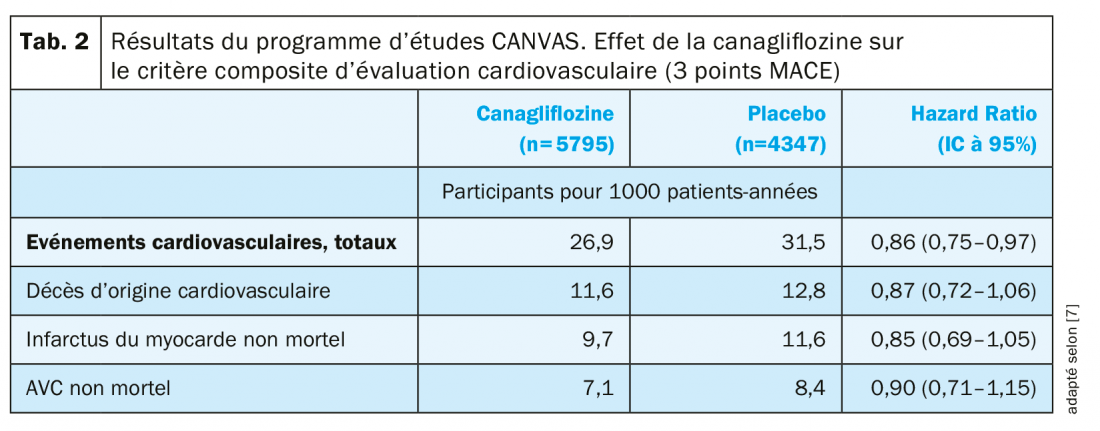
Les deux études sœurs du programme CANVAS ont inclus plus de 10’000 patients présentant un DT2 et un risque cardiovasculaire élevé à très élevé, qui ont été randomisés pour recevoir soit un traitement par canagliflozine, soit un placebo [7]. Le critère composite d’évaluation primaire 3 points MACE – mortalité CV, infarctus du myocarde non mortel, AVC non mortel – a été observé nettement plus rarement dans le groupe canagliflozine que dans le groupe placebo (supériorité, p=0,02, Tab. 2) [7]. À l’exception des patients prenant des diurétiques, tous les sous-groupes de patients définis ont également bénéficié du traitement par canagliflozine [7]. Les effets indésirables observés sous canagliflozine correspondaient majoritairement à son profil de sécurité déjà connu [7]. Dans l’ensemble, des effets indésirables graves sont apparus plus rarement sous canagliflozine que sous placebo (104,3 vs. 120,0 participants pour 1000 patients-années, HR: 0,93) [7]. Une augmentation du risque d’amputation a été observée sous traitement par canagliflozine (6,3 vs. 3,4 participants pour 1000 patients-années; HR, 1,97), toutefois, aucun rapport de cause à effet n’a pu être établi entre le traitement par canagliflozine et le risque d’amputation accru. La plupart des amputations ont eu lieu au niveau des orteils ou des métatarsiens, et des antécédents d’amputation, une artériopathie oblitérante périphérique ou une neuropathie faisaient partie des facteurs de risque [7,8]. Aucun risque accru d’amputation n’a été observé dans le cadre d’une autre étude [9].
Extension de l’indication de la canagliflozine
La canagliflozine est autorisée depuis 2014, en complément d’un régime alimentaire et de l’exercice physique, pour le traitement des patients adultes atteints de DT2 insuffisamment contrôlé, ou en association avec d’autres médicaments hypoglycémiants [10]. Sur la base des données du programme d’études CANVAS, qui ont démontré l’effet cardioprotecteur de la canagliflozine chez des patients présentant un DT2 et un risque cardiovasculaire élevé, l’indication de la canagliflozine (Invokana®) et de l’association fixe de canagliflozine et metformine (Vokanamet®) a été récemment étendue de manière à inclure la prévention d’événements cardiovasculaires chez les patients adultes atteints de DT2 et d’une affection cardiovasculaire déjà manifeste [10,11].
Conclusion
Dans le cadre du programme d’études CANVAS, le traitement par canagliflozine a entraîné une réduction significative des événements cardiovasculaires comparativement au placebo, chez des diabétiques de type 2 à haut risque cardiovasculaire [7]. L’extension d’autorisation de la canagliflozine basée sur ces résultats ouvre désormais une nouvelle option thérapeutique en termes de prévention des événements cardiovasculaires chez les patients diabétiques de type 2, présentant une maladie cardiovasculaire déjà manifeste [10].
Bibliographie:
- Einarson TR, et al.: Prevalence of cardiovascular disease in type 2 diabetes: a systematic literature review of scientific evidence from across the world in 2007–2017. Cardiovasc Diabetol, 2018. 17(1): 83.
- De Rosa S, et al.: Type 2 Diabetes Mellitus and Cardiovascular Disease: Genetic and Epigenetic Links. Front Endocrinol, 2018. 9: 2.
- Website of Diabetes Schweiz «A propos du diabète». https://www.diabetesschweiz.ch/fr/a-propos-du-diabete.html. Last access: 11.05.2020.
- Sarwar N, et al.: Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet, 2010. 375(9733): 2215–2222.
- Cosentino F, et al.: 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J, 2020. 41(2): 255–323.
- Empfehlungen der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie (SGED/SSED) für die Behandlung von Diabetes mellitus Typ 2 (2020). https://www.sgedssed.ch/fileadmin/user_upload/6_Diabetologie/61_Empfehlungen_Facharzt/2020_Swiss_Recomm_Medis_DE_def.pdf. Last access: 25.03.2020.
- Neal B, et al.: Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med, 2017. 377(7): 644–657.
- Matthews DR, et al.: Effects of canagliflozin on amputation risk in type 2 diabetes: the CANVAS Program. Diabetologia, 2019. 62(6): 926–938.
- Perkovic, V., et al., Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med, 2019. 380(24): 2295–2306.
- Fachinformation Invokana®. www.swissmedicinfo.ch. State of Information: October 2019.
- Fachinformation Vokanamet®. www.swissmedicinfo.ch. State of Information: October 2019.
- Wilding JP, et al.: Efficacy and safety of canagliflozin by baseline HbA1c and known duration of type 2 diabetes mellitus. J Diabetes Complications, 2015. 29(3): 438–444.
- Zaccardi F, et al.: Efficacy and safety of sodium-glucose co-transporter-2 inhibitors in type 2 diabetes mellitus: systematic review and network meta-analysis. Diabetes Obes Metab, 2016. 18(8): 783–794.
Responsabilité du contenu et soutien financier assumés par Mundipharma Medical Company, Agence de Bâle.
PR202005
INVOKANA® (canagliflozine), VOKANAMET® (canagliflozine, chlorhydrate de metformine). I: INVOKANA®: adultes (à partir de 18 ans) atteints de diabète sucré de type 2 insuffisamment contrôlé, en complément d’un régime alimentaire et de l’exercice physique: en monothérapie, en association thérapeutique adjuvante avec d’autres médicaments hypoglycémiants; prévention des événements cardiovasculaires et des maladies cardiovasculaires manifestes chez les patients atteints de diabète sucré de type 2. VOKANAMET®: indiqué chez les adultes (à partir de 18 ans) atteints de diabète sucré de type 2 insuffisamment contrôlé, en complément d’un régime alimentaire et de l’exercice physique: à la place de la metformine: en remplacement des principes actifs canagliflozine et metformine déjà administrés séparément; en association thérapeutique adjuvante (Add-on) avec d’autres médicaments hypoglycémiants; en association thérapeutique initiale, indiqué pour la prévention des événements cardiovasculaires et des maladies cardiovasculaires manifestes chez les patients atteints de diabète sucré de type 2. P: INVOKANA®: la dose recommandée est de 100 mg une fois par jour. En cas de nécessité d’un contrôle glycémique plus étroit: augmentation de la dose à 300 mg pour autant que le risque d’effets indésirables liés à une diminution du volume intravasculaire soit faible et que le DFGe soit ≥60 ml/min/1,73 m2. VOKANAMET®: en cas de contrôle insuffisant avec la metformine seule: 50 mg de canagliflozine deux fois par jour en association avec la dose de metformine prise jusqu’ici ou avec la dose thérapeutique appropriée de metformine la plus proche. En cas de nécessité d’un contrôle glycémique plus étroit: augmentation de la dose à 150 mg de canagliflozine deux fois par jour si la dose de 50 mg de canagliflozine deux fois par jour est bien tolérée, et en présence d’un faible risque de diminution du volume intravasculaire et de DFGe soit ≥60 ml/min/1,73 m2. Chez les patients ayant pris auparavant des comprimés séparés de canagliflozine et de metformine : mêmes doses quotidiennes totales de canagliflozine et de metformine que celles prises jusque-là ou dose thérapeutique appropriée la plus proche de metformine. CI: hypersensibilité à la canagliflozine ou à l’un des excipients. INVOKANA® Tab. contiennent du lactose. VOKANAMET®: hypersensibilité à la metformine; acidocétose diabétique, précoma diabétique; altération de la fonction rénale (DFGe <60 ml/min/1,73 m2 ou ClCr <60 ml/min); maladies aigües susceptibles d’altérer la fonction rénale; maladies aiguës ou chroniques susceptibles de provoquer une hypoxie tissulaire; insuffisance hépatique, intoxication éthylique aigüe, alcoolisme. PR: par mesure de précaution, une surveillance attentive des patients présentant un risque accru d’amputation doit être envisagée, de même que le conseil aux patients concernant l’importance des soins préventifs réguliers des pieds et le maintien d’une hydratation suffisante. INVOKANA® et VOKANAMET® ne sont pas recommandées chez les patients présentant un diabète de type 1 et pour le traitement d’une acidocétose diabétique. Dans le cas de signes d’acidose, une acidocétose diabétique devrait également être considérée même avec des valeurs de glycémie inférieures à 13,9 mmol/l, si le diagnostic est confirmé, arrêter immédiatement le traitement. La prudence est de rigueur en cas de risque de déplétion volumique, de cardiopathie ischémique ou de maladie cérébrovasculaire, patients âgés ≥75 ans ou administration concomitante de diurétiques épargneurs de potassium (hyperkaliémie), médicaments agissant sur le système rénine-angiotensine-aldostérone. En cas d’administration concomitante d’insuline ou d’un sécrétagogue de l’insuline, une réduction de la dose d’insuline ou du sécrétagogue de l’insuline doit être envisagée en raison du risque d’hypoglycémies ; des cas de fasciite nécrosante du périnée (gangrène de Fournier) ont été signalés chez des patients atteints de diabète sucré ayant reçu des inhibiteurs de SGLT2, dont INVOKANA®/VOKANAMET®. Les patients traités par INVOKANA®/VOKANAMET® et souffrant de douleur ou de sensibilité, d’érythème ou d’enflure de la région génitale ou périnéale, de fièvre ou d’inconfort doivent être examinés pour la fasciite nécrosante. En cas de suspicion, un traitement aux antibiotiques à large spectre et un débridement chirurgical doivent être entrepris immédiatement. INVOKANA®/VOKANAMET® doit être arrêté; évaluer le rapport bénéfice-risque en cas d’infections mycosiques génitales récidivantes. INVOKANA®: interrompre le traitement chez les patients présentant un DFGe durablement <45 ml/min/1,73 m2 ou une ClCr <45 ml/min; faire preuve d’une prudence accrue en présence d’un DFGe <60 ml/min/1,73 m2 ou d’une ClCr <60 ml/min, contrôler régulièrement la fonction rénale. VOKANAMET®: interrompre immédiatement le traitement en cas de suspicion d’acidose lactique. EI: canagliflozine: hypoglycémie en association avec l’insuline ou des sulfonylurées, candidose vulvovaginale, balanite ou balanoposthite, infections des voies urinaires, polyurie ou pollakiurie; une augmentation des valeurs hématocrites, dyslipidémie, obstruction, soif, nausée, infection urinaire (pyélonéphrite et urosepsis), déshydratation, augmentation des niveaux de potassium dans le sang, hypotension, éruption cutanéec, photosensibilité, urticaire, fractures osseuses, élévation des taux sanguins de créatinine, élévation des taux sanguins d’urée, insuffisance rénale, acidocétose diabétique, réaction anaphylactique, angio-œdème, insuffisance rénale (en rapport avec une déplétion volémique), amputations des membres inférieurs. Metformine : troubles gastro-intestinaux, goût métallique, diminution du taux de vitamine B12, acidose lactique. Autres EI, voir IP. IA: INVOKANA®/VOKANAMET®: ne provoque pas d’induction de l’expression des enzymes du CYP450 ; en cas d’administration concomitante d’inducteurs des UGT et de transporteurs de médicaments, l’efficacité de la canagliflozine peut être diminuée. VOKANAMET®: la consommation concomitante d’alcool peut renforcer l’effet hypoglycémiant de la metformine jusqu’au coma hypoglycémique. Liste, voir IP. GA: l’utilisation doit être évitée pendant la grossesse et pendant l’allaitement. Présentations: INVOKANA®: 30, 100 comprimés pelliculés. VOKANAMET®: flacons de 60 et 180 (3×60) comprimés pelliculés. Admis aux caisses-maladie. Cat. de remise: B. Pour de plus amples informations: www.swissmedicinfo.ch; titulaire de l’autorisation: Janssen-Cilag AG, Gubelstrasse 34, 6300 Zug