La thrombose veineuse profonde se développe chez 1/1000 habitants par an en Europe de l’Ouest. En phase aiguë, il est crucial de prévenir les complications de l’embolie artérielle pulmonaire. Cela se fait aujourd’hui de manière efficace au moment du diagnostic avec un traitement anticoagulant. Pourtant, plusieurs milliers de personnes meurent chaque année de cette maladie thromboembolique pulmonaire, faute d’avoir été diagnostiquées.
La thrombose veineuse profonde se développe chez 1/1000 habitants par an en Europe occidentale [1]. En phase aiguë, il est crucial de prévenir les complications de l’embolie artérielle pulmonaire. Cela se fait aujourd’hui de manière efficace au moment du diagnostic avec un traitement anticoagulant. Cependant, environ 25 000 personnes meurent chaque année en Allemagne de cette maladie thromboembolique pulmonaire, notamment parce que les patients décèdent subitement d’une embolie artérielle pulmonaire aiguë ou que le diagnostic est posé trop tard.
Autant l’anticoagulation est efficace dans la prévention des thromboembolies, autant elle est inefficace dans la prévention du syndrome post-thrombotique (SPT). Au cours de l’évolution à long terme, les patients atteints de thrombose veineuse profonde développent un syndrome post-thrombotique dans 20 à 83% des cas, en fonction de la localisation et de l’étendue de la thrombose [2,3]. Les veines iliaques sont impliquées dans environ 40% des cas de thrombose ilio-fémorale et, malgré l’anticoagulation, la recanalisation échoue dans 70% des cas [4,5]. Cela conduit alors à une obstruction chronique de l’écoulement et, par conséquent, au STP.
Le SPT regroupe les troubles dus aux veines profondes endommagées et/ou obstruées par une thrombose veineuse profonde. Cela inclut généralement une sensation de lourdeur, des paresthésies, des démangeaisons, des crampes, des douleurs et des œdèmes périphériques dans les jambes. On observe également des indurations cutanées, une hyperpigmentation, des rougeurs, des ectasies veineuses, des ulcères de jambe et une douleur à la compression du mollet. En particulier, la claudication veineuse est un symptôme majeur qui, comme la claudication intermittente, entraîne une limitation de la distance de marche. L’ulcère de jambe, en tant qu’étape finale de la symptomatologie, entraîne des coûts parfois élevés pour le système de santé en raison de ses conséquences socio-économiques, comme la réduction de la mobilité et la nécessité de soins [6,7].
Thrombose veineuse profonde
Diagnostic : en cas de thrombose veineuse profonde, la procédure diagnostique est clairement définie dans les directives. Tout signe de thrombose veineuse profonde doit faire l’objet d’un examen approfondi immédiat afin de mettre en place un traitement anticoagulant si nécessaire. C’est la seule façon de réduire le risque d’embolie artérielle pulmonaire et d’arrêter la progression de la TVP [8]. L’évaluation comprend tout d’abord l’anamnèse et l’examen physique. En raison de sa faible sensibilité, elle ne permet pas à elle seule de diagnostiquer ou d’exclure une thrombose. C’est pourquoi, en fonction de la probabilité clinique (KW), le diagnostic de laboratoire, en particulier la détermination des D-dimères, et/ou l’échographie de compression suivent. Il existe des scores validés pour déterminer le KW de la présence d’une TVP, comme le score de Wells, fréquemment utilisé [8].
A l’aide de ce score, des facteurs tels que la présence d’une tumeur ou la différence de circonférence des jambes sont interrogés et évalués par un score de 0 ou 1. Cela permet d’établir un KW élevé ou faible pour la présence d’une TVP. Ceci devrait être documenté comme une étape diagnostique indépendante. Si la VC est faible, le test des D-dimères suit généralement. Si celui-ci est négatif, il est très probable qu’une TVP soit exclue et qu’aucun autre diagnostic ne doive être posé [8]. Si la probabilité clinique est élevée, l’échographie de compression suit. Si celle-ci n’est pas concluante, il convient de procéder à une nouvelle imagerie ou à une nouvelle échographie 3 à 5 jours plus tard. Il est recommandé d’examiner l’ensemble de la jambe concernée, y compris les veines pelviennes, à l’aide de l’échographie de compression. Si un diagnostic par imagerie n’est pas disponible en temps voulu, une anticoagulation est indiquée en cas de forte probabilité clinique, après avoir évalué le risque de saignement [8].
Traitement : Le traitement de la TVP comprend, outre l’anticoagulation, la thérapie par compression et la mobilisation rapide. Il est également recommandé d’arrêter ou de modifier le facteur de risque déclencheur éventuel, comme la contraception, et de traiter une maladie sous-jacente nouvellement diagnostiquée, comme la maladie tumorale. Ces dernières années, l’anticoagulation s’est enrichie des nouveaux anticoagulants oraux (NOAK), ce qui a certainement facilité son maniement par le patient. Cependant, les NOAK présentent de plus en plus d’interactions avec d’autres médicaments tels que les antibiotiques et les antiarythmiques. Cela doit être vérifié lors de la préparation et du suivi.
Après un traitement d’entretien de 3 à 6 mois, un traitement d’entretien prolongé doit être discuté. La Société allemande d’angiologie propose un schéma de feux tricolores pour vous aider à décider de la poursuite du traitement. (tableau 1). Il convient de préciser que les deux études sur le rivaroxaban et l’apixaban dans le cadre d’un traitement d’entretien prolongé à faible dose n’ont pas encore été prises en compte et qu’elles ne sont autorisées que pour un an. [9,10]. Un bilan de thrombophilie peut être réalisé chez des patients sélectionnés au cours de l’évolution, mais il n’a que rarement une conséquence thérapeutique. Le syndrome des antiphospholipides, le déficit en antithrombine III ou un déficit significatif en inhibiteur sont des exemples de conséquences thérapeutiques.

Un contrôle clinique du patient présentant une TVP doit être effectué dans les 21 premiers jours, et un contrôle échographique après 3 mois ou à la fin du traitement anticoagulant.
En ce qui concerne la thérapie par compression, malgré toutes les faiblesses du protocole d’étude, l’essai Sox n’a pas montré d’avantage pour la thérapie par compression dans la prévention du syndrome post-thrombotique (SPT) [13]. Toutefois, la compression est indispensable pour soulager les symptômes ; un traitement par compression doit être appliqué, surtout au cours des premières semaines.
Une TVP d’origine indéterminée présente le taux de récidive le plus élevé, jusqu’à 9% la première année. Le débat sur la question de savoir si les patients atteints de TVP ont un risque accru de développer une tumeur n’a pas encore été tranché de manière définitive [14,15]. Si un dépistage est effectué, il semble qu’un examen préventif adapté à l’âge, plus l’anamnèse et le laboratoire, soit suffisant [16]. Chez les patients plus jeunes, un bilan de vascularite peut être utile.
Les patients atteints de tumeurs ont un risque plus ou moins élevé de développer une TVP, en fonction de l’entité tumorale et de sa localisation. Le risque de TVP le plus élevé est celui des patients atteints d’une tumeur du pancréas. La survenue d’une TVP est associée à un résultat nettement moins bon chez les patients atteints de tumeurs [17]. Les patients atteints de tumeurs ont d’emblée une probabilité clinique plus élevée et les D-dimères sont en soi régulièrement élevés. Il est donc recommandé de rechercher une éventuelle TVP chez les patients atteints de tumeurs, notamment à l’aide de l’échographie duplex couleur et d’une imagerie supplémentaire si nécessaire [18]. Les patients atteints de tumeurs doivent être traités pendant 3 à 6 mois avec une héparine de bas poids moléculaire, car celle-ci est supérieure à l’héparine non fractionnée [19,20] et au Marcumar [21–23]. La posologie et la durée doivent être déterminées en concertation avec les collègues oncologues traitants. En raison du risque très élevé de récidive pouvant atteindre 20%, une anticoagulation à long terme est recommandée en fonction du risque de saignement, du moins tant que la tumeur est présente, même si les données à ce sujet sont limitées.
Par rapport à l’héparine de bas poids moléculaire, plusieurs études ont été menées avec les NOAK chez des patients atteints de tumeurs. Pour l’edoxaban par rapport à la daltéparine, une réduction du taux de récidive (7,9% vs 11,3%) a été observée, mais au prix d’une augmentation du taux de saignement (6,9% vs 4,0%) à 12 mois [24]. L’augmentation du taux de saignement s’est produite principalement dans le tractus gastro-intestinal chez les patients atteints de tumeurs gastro-intestinales. L’étude pilote Select-D a évalué le rivaroxaban par rapport à la daltéparine sur une période de 6 mois. Là encore, le rivaroxaban a montré un avantage en termes de taux de récidive de thrombose (4% vs 11%), tandis que le taux d’hémorragie grave a été plus élevé (6% vs 4%) [25]. Dans cette étude, l’augmentation du taux de saignement gastro-intestinal avait également été remarquée. Après la mise à jour des lignes directrices à ce sujet, les données sur l’apixaban n’étaient pas encore disponibles. Une étude internationale randomisée a montré la non-infériorité de l’apixaban par rapport à la daltéparine en termes de taux de récidive (5,6% vs 7,9%). Cependant, contrairement à l’edoxaban et au rivaroxaban, l’apixaban n’a pas augmenté les complications hémorragiques (3,8% vs 4,0%) [26] chez un groupe de patients comparable.
En résumé, les NOAK semblent être une alternative pour les patients atteints de tumeurs, mais une grande prudence est encore de mise actuellement chez les patients atteints de tumeurs gastro-intestinales ou urogénitales. Selon ces données, les NOAK pourraient être utilisés à partir du diagnostic de TVP, mais cela dépend de l’entité tumorale, du stade de la tumeur et du traitement actuel de la tumeur.
La thrombose de la jambe (thrombose veineuse profonde distale) est anticoagulée pendant 3 mois maximum, comme la thrombose veineuse musculaire, en raison de son évolution favorable en termes de pronostic, même en cas de récidive ou d’origine idiopathique [27,28]. Cependant, il n’y a pas de preuve claire de la nécessité d’une anticoagulation, et le dosage est également en discussion actuellement.
|
LEFt- Score
|
L’une des causes les plus fréquentes de décès pendant la grossesse et le post-partum est la TVP, avec un risque quatre fois plus élevé [29]. Chez la femme enceinte, la TVP se produit dans 70 à 90% des cas sur la jambe gauche [30,31]. La thrombose veineuse pelvienne est également plus souvent diagnostiquée pendant la grossesse. Pour le diagnostic, on utilise donc d’une part le score LEFt avec une valeur prédictive négative élevée, mais il nécessite une évaluation supplémentaire dans un collectif de patients plus important (encadré). Les D-dimères sont élevés pendant la grossesse, mais selon Morse et al. et Chan et al. celui-ci peut être adapté à l’âge de la grossesse [32,33]. Cependant, des études récentes indiquent que l’utilisation des D-dimères seuls pour exclure une TVP est peu pratique en clinique, en dehors des patientes à haut risque [34]. Il semble plutôt utile d’appliquer des règles de prédictibilité clinique en combinaison avec un test de D-dimères afin d’économiser les radiations en cas de suspicion d’embolie pulmonaire.

Il convient de mentionner à cet égard l’algorithme YEARS adapté à la grossesse proposé dans les lignes directrices actuelles de l’ESC pour l’embolie pulmonaire [35,36]. Enfin, l’échographie de compression doit être utilisée régulièrement pour exclure une TVP pendant la grossesse, y compris en position latérale si nécessaire. Si l’on ne peut pas conclure à une TVP, il est recommandé de réaliser une imagerie par phlébographie IRM [37] en évitant l’utilisation de gadolinium et en utilisant des séquences non contrastées [8]. Si l’échographie de compression est négative, un contrôle 7 jours plus tard est recommandé [8].
En cas de détection d’une TVP, une anticoagulation par héparine, de préférence de bas poids moléculaire, est recommandée et doit être administrée pendant 3 mois à dose thérapeutique. Ensuite, il est possible de réduire la dose à une dose intermédiaire (2× prophylactique) ou prophylactique [8]. L’anticoagulation doit cependant être poursuivie pendant au moins 6 semaines après l’accouchement [38]. Les NOAK sont contre-indiqués pendant la grossesse en raison de leur passage placentaire, mais aussi pendant la période d’allaitement en raison de l’absence de données de sécurité [39].
Chez les patients présentant une symptomatologie marquée due à une thrombose veineuse pelvienne aiguë descendante, une approche endovasculaire à faible risque hémorragique doit être discutée. Une thrombose descendante a généralement pour origine une sténose/obstruction de la veine cave inférieure et/ou de la veine iliaque, ce qui entraîne une croissance descendante rapide du thrombus et donc une symptomatologie rapide et intense chez le patient concerné. Les patients présentant cette entité de thrombose bénéficient notamment, selon une analyse de sous-groupe de l’Attract Trial, d’une approche interventionnelle [11]. Comme il s’agit généralement de jeunes patients, l’exposition aux radiations doit être minimisée ou évitée grâce à la thérapie endovasculaire guidée par ultrasons (Fig. 1). Sous guidage échographique, il est possible de réaliser une thrombectomie, une thérapie locale de lyse ainsi qu’une PTA et une implantation de stent, comme le montre partiellement la casuistique suivante [12].
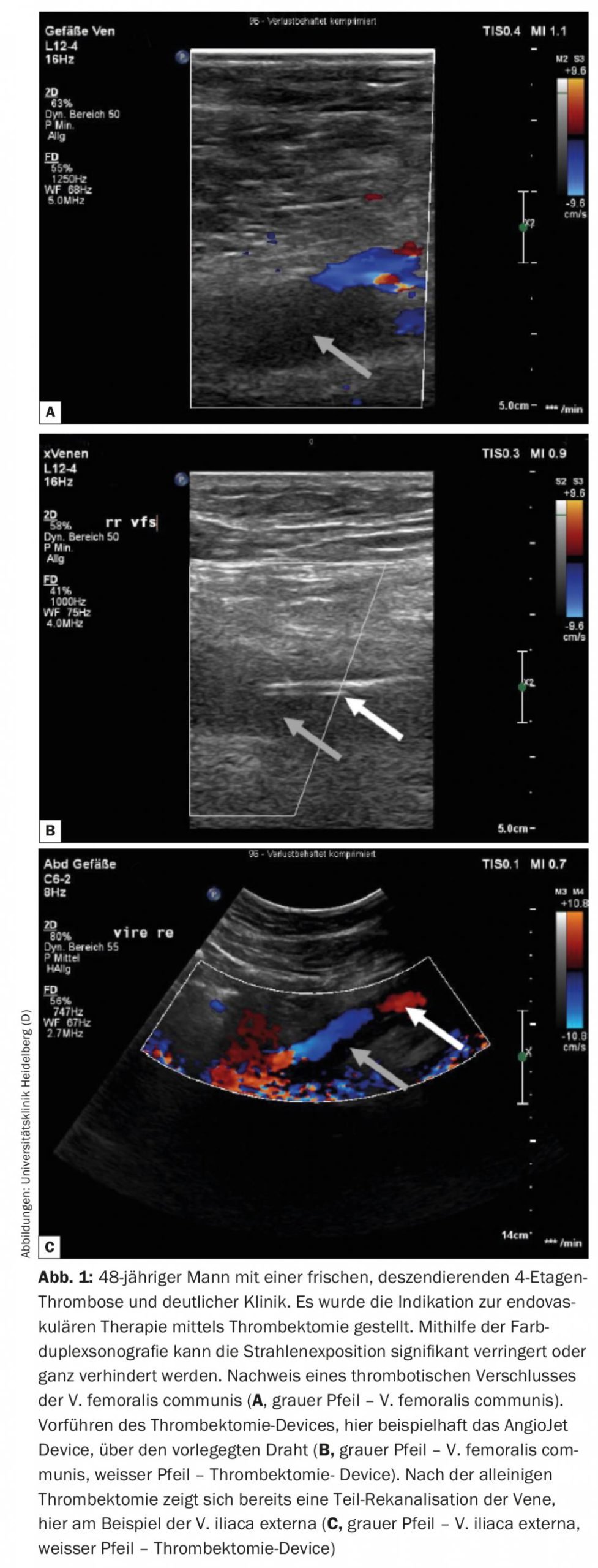
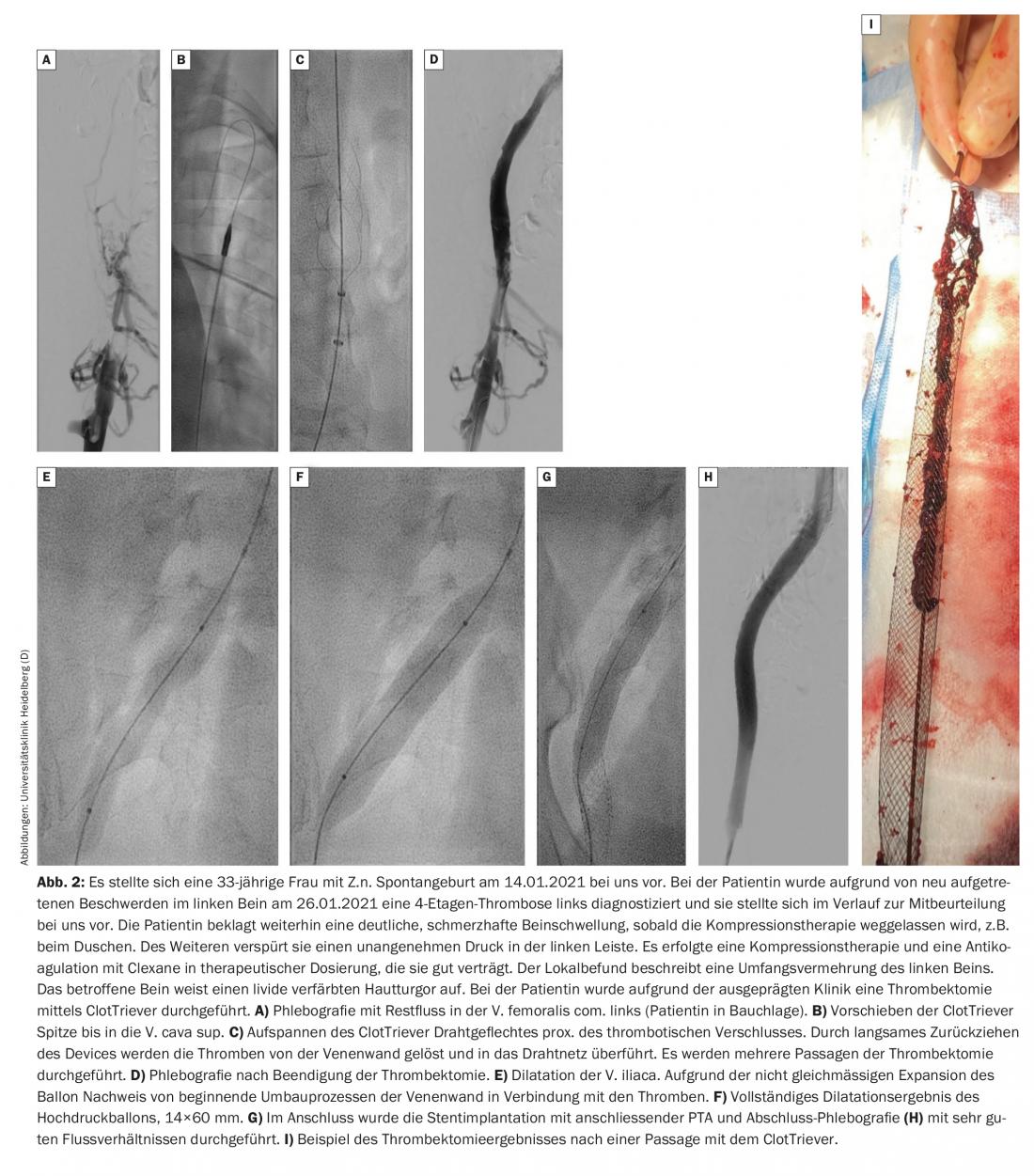
Selon le protocole de Heidelberg, les patients sont d’abord traités de manière conservatrice pendant quelques jours. Si aucune amélioration significative des symptômes ou de l’extension du thrombus n’est constatée au cours de cette période, il convient de discuter avec le patient d’une procédure endovasculaire et, le cas échéant, de la mettre en œuvre. La thrombectomie doit si possible être effectuée dans les 14 jours suivant le début des symptômes. Un nouveau dispositif, appelé ClotTriever, semble également permettre de traiter efficacement les thromboses veineuses pelviennes subaiguës. Un registre est actuellement en cours à ce sujet et il reste à voir quels seront les premiers résultats (fig. 2).
Traitement du syndrome post-thrombotique (SPT)
Indication et évaluation diagnostique avant une intervention endovasculaire : L’indication d’une intervention endovasculaire dépend des symptômes du patient. A partir d’un stade 3 du CEAP, il existe une indication de réouverture des veines occluses selon les recommandations américaines. Les veines pouvant être traitées par voie endovasculaire sont la veine fémorale commune, la veine iliaque, la veine cave inférieure et supérieure et, en partie, la veine sous-clavière. Avant l’intervention, un diagnostic est d’abord posé avec un examen clinique, un test de marche, l’échographie duplex couleur et, si nécessaire, une imagerie supplémentaire comme une IRM ou un scanner phlébographique. Le degré d’occlusion de la veine ainsi que le flux entrant et sortant sont essentiels, car le taux d’ouverture à long terme dépend de ces facteurs.
Traitement : le traitement de base du STP consiste en une thérapie de compression, des mesures physiques et de l’exercice. Le mouvement est essentiel à la formation de circuits de contournement et donc à l’amélioration des symptômes. De plus, le traitement optimal des plaies est élémentaire en cas d’ulcère de jambe.
Le traitement invasif d’une thrombose veineuse proximale ou d’une occlusion veineuse chronique a été introduit au niveau international il y a 30 ans déjà. Chez nous, les interventions endovasculaires sont pratiquées avec succès depuis quelques années dans les grands centres avec des taux d’ouverture élevés et entraînent une nette amélioration des symptômes du patient et la guérison des ulcères veineux.
Si la clinique s’y prête, il est possible de discuter avec le patient d’une éventuelle intervention veineuse et de discuter des avantages et des inconvénients ou des risques. L’âge de l’obstruction ne joue aucun rôle dans les chances de succès de l’intervention. Le taux d’ouverture primaire est de près de 70% à 5 ans. Cette méta-analyse a également montré une nette amélioration de la symptomatologie ; jusqu’à 82% des patients traités n’ont plus de douleurs après 5 ans. De plus, l’intervention a entraîné la guérison à long terme d’un ulcère de jambe dans une proportion pouvant atteindre 80% [1].
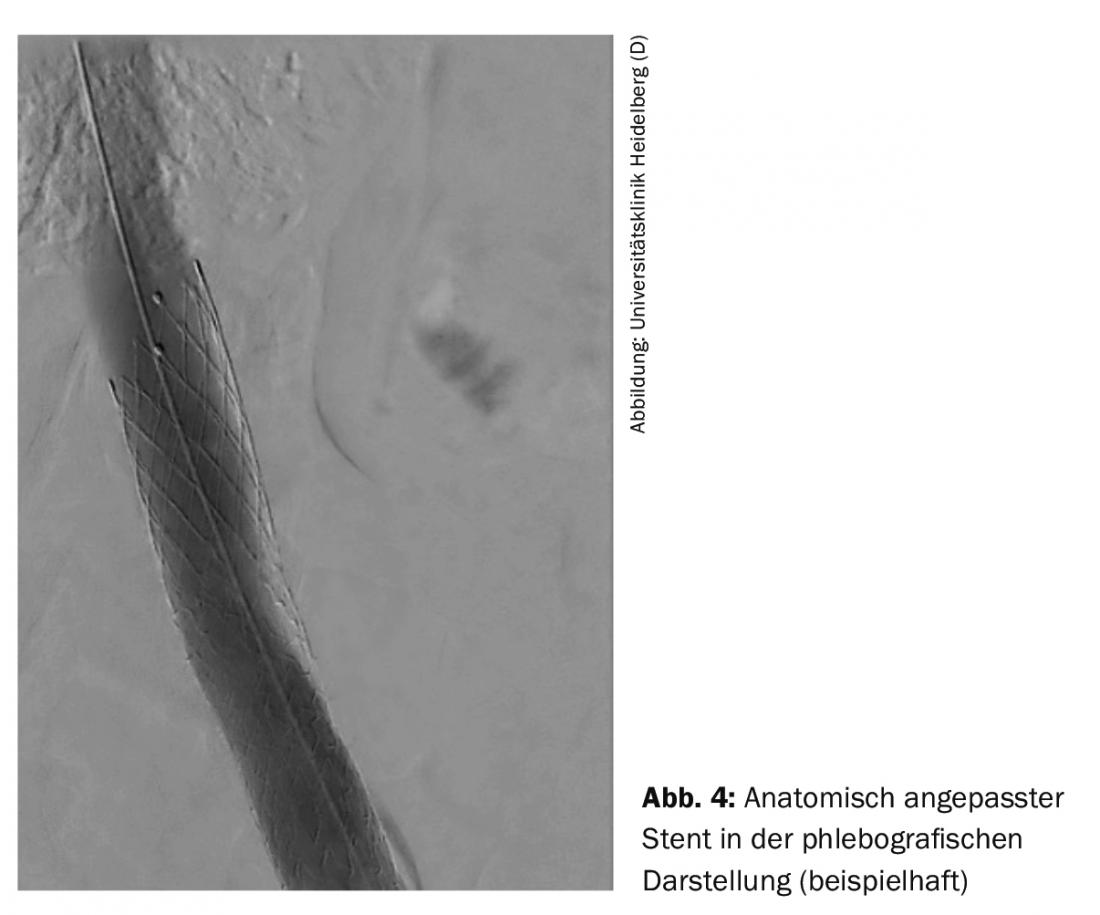
L’intervention endovasculaire est généralement réalisée par la veine poplitée. Les autres voies d’accès sont la veine fémorale et la veine jugulaire. Selon les cas, l’intervention peut être réalisée sous analgosédation ou sous anesthésie par intubation. Après la phlébographie, un passage de fil a lieu à travers l’occlusion. Ensuite, en raison de la rigidité des occlusions veineuses, des ballons spéciaux à haute pression d’un diamètre de 14 à 16 mm dans la veine iliaque et de 20 à 24 mm dans la veine cave inf. sont utilisés pour une dilatation adéquate. est utilisé. Après la dilatation, la paroi veineuse ne constitue pas une construction stable et s’effondre rapidement, d’où l’utilisation de stents spécialement conçus pour les veines afin de garantir un taux d’ouverture à long terme. Pour obtenir un positionnement optimal du stent lors d’une intervention unilatérale dans la région de la veine iliaque commune proximale, des stents adaptés à l’anatomie sont disponibles (Fig. 4).
Autres groupes de patients : les étiologies complémentaires sont les compressions de la veine par des artères, les sténoses veineuses dites non thrombotiques (NIVL) ou les lésions spatiales telles que les tumeurs. Les NIVL consistent généralement en une compression de la veine iliaque com. à gauche par l’artère iliaque com. droite, appelée sténose de May-Thurner. Si des troubles s’y ajoutent, on parle alors de syndrome de May-Thurner. Ces compressions NIVL peuvent aujourd’hui être réalisées efficacement avec un taux d’ouverture très élevé d’environ 90% à 5 ans, pour un temps d’intervention court et un produit de dose surfacique faible [1].
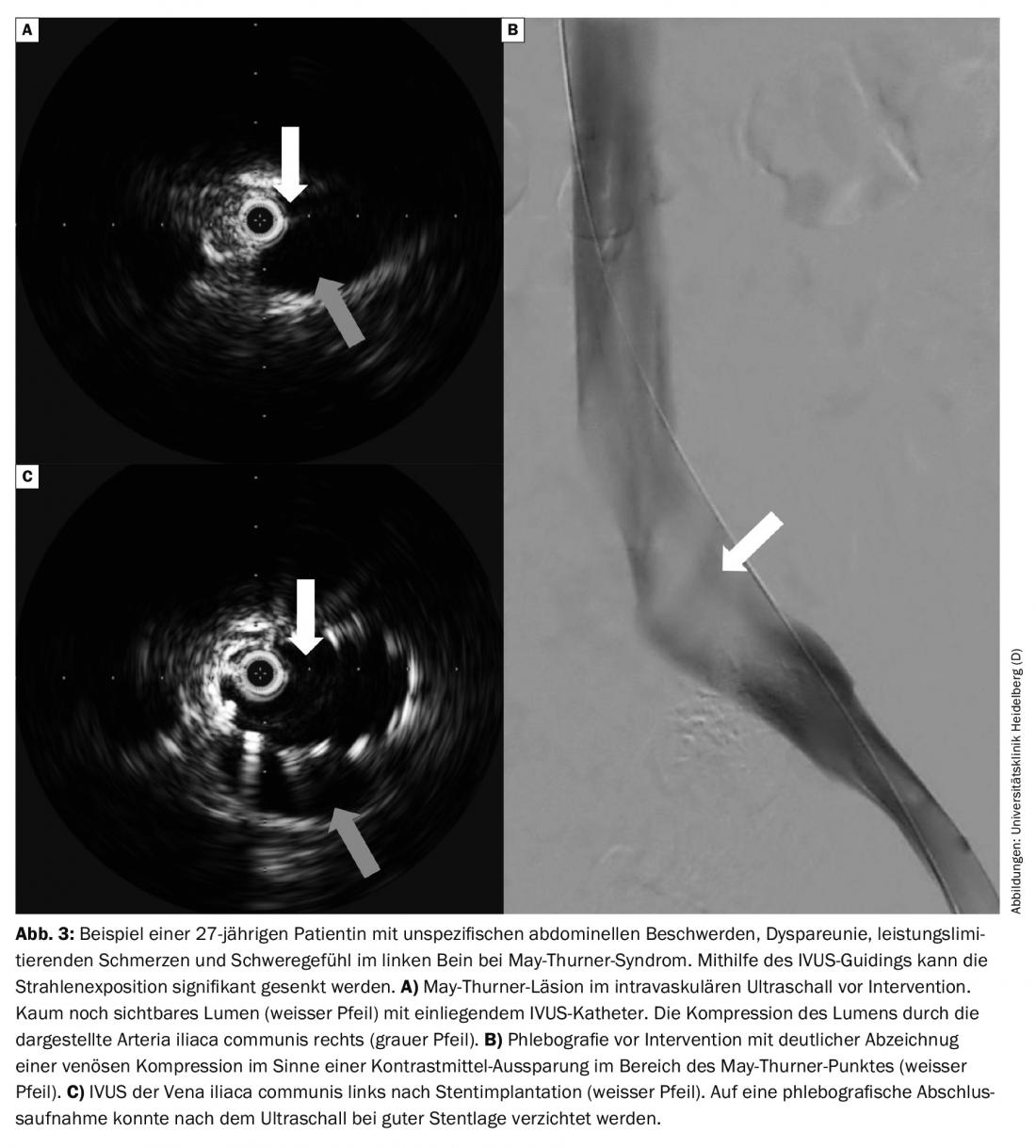
Les limites de l’échographie duplex couleur, de la tomodensitométrie et de la phlébographie par résonance magnétique pour la détection des obstructions dynamiques iliaques peuvent aujourd’hui être surmontées par l’utilisation de l’échographie intravasculaire (IVUS) en cas de suspicion de thrombose veineuse pelvienne avec des symptômes typiques sans corrélation diagnostique. (Fig. 3A). Il est donc possible d’économiser, voire de renoncer à la dose de rayons X pour ce groupe de patients souvent jeunes. Si une intervention est nécessaire, l’IVUS peut aider à choisir la taille et la longueur du stent.
Le traitement invasif d’une compression veineuse due à une tumeur peut permettre de soulager rapidement les symptômes, et pas seulement dans le cadre de soins palliatifs. Après la mise en place du stent et la post-dilatation, le stent atteint sa forme optimale pour maintenir ouverte la veine correspondante grâce à des forces dirigées vers l’extérieur.
Suivi : les contrôles de l’évolution sont recommandés à 1,3 et 12 mois. Ces jours-là, l’évolution clinique et l’échographie duplex couleur sont contrôlées. Une nouvelle phlébographie, ou CTA, n’est pas nécessaire en routine.
Le traitement antithrombotique post-interventionnel dépend de l’étiologie du risque individuel de thrombose et de saignement. Elle se fait de manière individuelle. Le plus souvent, une anticoagulation thérapeutique totale est nécessaire pendant 6 à 12 mois. La suite de la procédure est ensuite discutée et réalisée individuellement avec le patient. En outre, un traitement antiplaquettaire peut être conseillé pendant les 6 premiers mois. Les LNV nécessitent un régime moins strict après l’intervention que les occlusions chroniques complexes. Une anticoagulation totale est recommandée pendant 3 à 6 mois. L’anticoagulation est ensuite arrêtée.
En résumé, le traitement endovasculaire des occlusions veineuses est une très bonne option pour aider efficacement et à long terme les patients présentant des symptômes plus prononcés.
Messages Take-Home
- Un traitement NOAK peut être administré aux patients atteints de tumeurs.
- Cela dépend toutefois de l’entité tumorale (pas pour les tumeurs GI et urogénitales), du stade de la tumeur et de son traitement.
- Une anticoagulation conforme aux directives minimise le taux de thromboembolie, mais pas la probabilité de survenue du syndrome post-thrombotique (SPT).
- En cas de thrombose veineuse pelvienne aiguë clairement symptomatique, une approche interventionnelle doit être discutée en l’absence d’amélioration des symptômes et de l’extension du thrombus sous traitement conservateur.
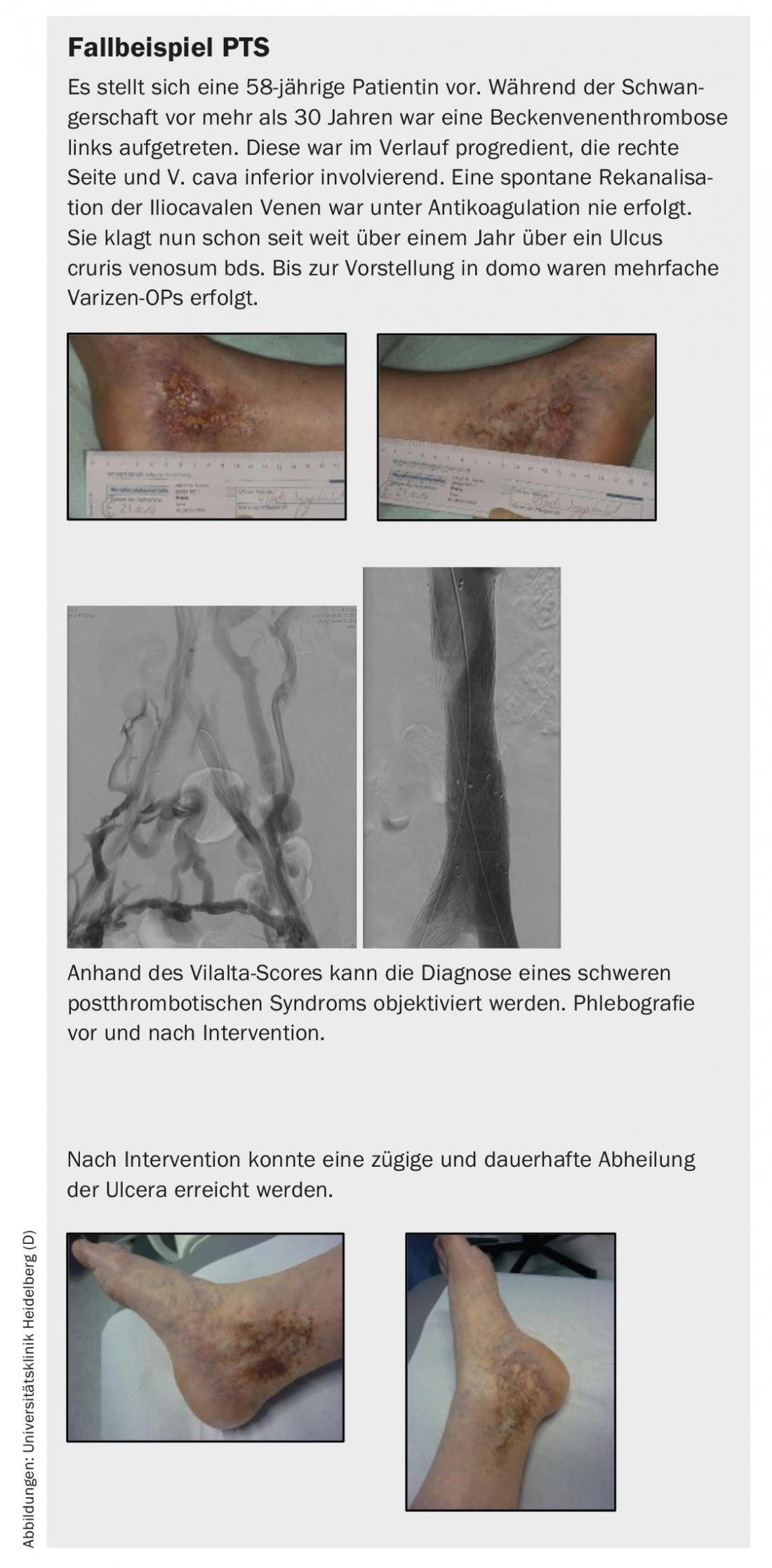
- Dans le cas du syndrome post-thrombotique, la réouverture endovasculaire des veines obstruées peut améliorer considérablement la qualité de vie des patients symptomatiques. De plus, cela constitue un traitement efficace pour la guérison à long terme des ulcères veineux.
- Pour les sténoses veineuses non thrombotiques (par ex. sténose de May-Thurner), le taux d’ouverture après intervention est d’environ 90% à 5 ans.
Littérature :
- Razavi MK, Jaff MR, Miller LE : Sécurité et efficacité de la mise en place d’un stent pour l’obstruction de l’écoulement veineux iliofémoral : revue systématique et méta-analyse. Circ Cardiovasc Interv 2015 ; 8 : e002772.
- Kahn SR, Shrier I, Julian JA, et al : Determinants and time course of the postthrombotic syndrome after acute deep veinous thrombosis. Ann Intern Med 2008 ; 149 : 698-707.
- Prandoni P, Lensing AW, Cogo A, et al : The long-term clinical course of acute deep veinous thrombosis. Ann Intern Med 1996 ; 125 : 1-7.
- Johnson BF, Manzo RA, Bergelin RO, Strandness DE, Jr : Relations entre les changements dans le système veineux profond et le développement du syndrome post-thrombotique après un épisode aigu de thrombose veineuse profonde du bas du dos : un suivi de un à six ans. J Vasc Surg 1995 ; 21 : 307-312 ; discussion 13.
- Akesson H, Brudin L, Dahlstrom JA, et al : Fonction veineuse évaluée sur une période de 5 ans après une thrombose veineuse ilio-fémorale aiguë traitée par anticoagulation. Eur J Vasc Surg 1990 ; 4 : 43-48.
- Ashrani AA, Heit JA. : Incidence et coût du syndrome post-thrombotique. J Thromb Thrombolysis 2009 ; 28 : 465-476.
- Guanella R, Ducruet T, Johri M, et al : Charge économique et déterminants des coûts de la thrombose veineuse profonde dans les 2 ans suivant le diagnostic : une évaluation prospective. J Thromb Haemost 2011 ; 9 : 2397-2405.
- Ligne directrice S2 : Diagnostic et traitement de la thrombose veineuse et de l’embolie pulmonaire. www.awmf.org/leitlinien/detail/ll/065-002.html. Dernière mise à jour : 10 octobre 2015.
- Agnelli G, Buller HR, Cohen A, et al : Apixaban for extended treatment of veinous thromboembolism. N Engl J Med 2013 ; 368 : 699-708.
- Weitz JI, Lensing AWA, Prins MH, et al : Rivaroxaban ou aspirine pour le traitement prolongé du thromboembolisme veineux. N Engl J Med 2017 ; 376 : 1211-1222.
- Comerota AJ, Kearon C, Gu CS, et al : Endovascular Thrombus Removal for Acute Iliofemoral Deep Vein Thrombosis. Circulation 2019 ; 139 : 1162-1173.
- Heckmann MB, Wangler S, Katus HA, Erbel C : Traitement endovasculaire assisté par ultrasons des thromboses veineuses aiguës. Vasa 2019 ; 48 : 443-449.
- Kahn SR, Shapiro S, Wells PS, et al : Compression stockings to prevent post-thrombotic syndrome : a randomised placebo-controlled trial. Lancet 2014 ; 383 : 880-888.
- Carrier M, Lazo-Langner A, Shivakumar S, et al : Screening for Occult Cancer in Unprovoked Venous Thromboembolism. N Engl J Med 2015 ; 373 : 697-704.
- Robin P, Le Roux PY, Planquette B, et al : Dépistage limité avec ou sans (18)F-fluorodésoxyglucose PET/CT pour la malignité occulte dans la thromboembolie veineuse non provoquée : un essai contrôlé randomisé en ouvert. Lancet Oncol 2016 ; 17 : 193-199.
- Khan F, Vaillancourt C, Carrier M. : Devons-nous procéder à un dépistage extensif du cancer après une thrombose veineuse non provoquée ? BMJ 2017 ; 356 : j1081.
- Levitan N, Dowlati A, Remick SC, et al : Rates of initial and recurrent thromboembolic disease among patients with malignancy versus those without malignity. Analyse de risque à partir des données de réclamations de Medicare. Medicine (Baltimore) 1999 ; 78 : 285-291.
- Gary T : Thromboembolie veineuse liée au cancer – prophylaxie et traitement. Vasa 2014 ; 43 : 245-251.
- Akl EA, Rohilla S, Barba M, et al : Anticoagulation for the initial treatment of veinous thromboembolism in patients with cancer : a systematic review. Cancer 2008 ; 113 : 1685-1694.
- Akl EA, Kahale L, Neumann I, et al : Anticoagulation for the initial treatment of veinous thromboembolism in patients with cancer. Cochrane Database Syst Rev 2014 : CD006649.
- Akl EA, Kahale L, Barba M, et al : Anticoagulation for the long-term treatment of veinous thromboembolism in patients with cancer. Cochrane Database Syst Rev 2014 : CD006650.
- Hull RD, Pineo GF, Brant RF, et al : Héparine à faible poids moléculaire à long terme versus soins habituels chez les patients atteints de thrombose de la veine proximale avec cancer. Am J Med 2006 ; 119 : 1062-1072.
- Lee AYY, Kamphuisen PW, Meyer G, et al : Tinzaparin vs Warfarin for Treatment of Acute Venous Thromboembolism in Patients With Active Cancer : A Randomized Clinical Trial. JAMA 2015 ; 314 : 677-686.
- Raskob GE, van Es N, Verhamme P, et al : Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism. N Engl J Med 2018 ; 378 : 615-624.
- Young AM, Marshall A, Thirlwall J, et al : Comparaison d’un inhibiteur du facteur Xa oral avec l’héparine de faible poids moléculaire chez les patients atteints de cancer avec thromboembolie veineuse : Résultats d’un essai randomisé (SELECT-D). J Clin Oncol 2018 ; 36 : 2017-2023.
- Agnelli G, Becattini C, Meyer G, et al : Apixaban pour le traitement de la maladie thromboembolique veineuse associée au cancer. N Engl J Med 2020 ; 382 : 1599-1607.
- Galanaud JP, Sevestre MA, Genty C, et al : Incidence et facteurs prédictifs de récidive thromboembolique veineuse après une première thrombose veineuse profonde distale isolée. J Thromb Haemost 2014 ; 12 : 436-443.
- Baglin T, Douketis J, Tosetto A, et al : La présentation clinique et l’étendue de la thrombose veineuse prédisent-elles la probabilité et le type de récidive ? Une méta-analyse patient-niveau. J Thromb Haemost 2010 ; 8 : 2436-2442.
- Marik PE, Plante LA. : Maladie thromboembolique veineuse et grossesse. N Engl J Med 2008 ; 359 : 2025-2033.
- Chan WS, Spencer FA, Ginsberg JS : Distribution anatomique de la thrombose des veines profondes pendant la grossesse. CMAJ 2010 ; 182 : 657-660.
- Ginsberg JS, Brill-Edwards P, Burrows RF, et al : Thrombose veineuse pendant la grossesse : jambe et trimestre de présentation. Thromb Haemost 1992 ; 67 : 519-520.
- Morse M : Establishing a normal range for D-dimer levels through pregnancy to help in the diagnosis of pulmonary embolism and deep vein thrombosis. J Thromb Haemost 2004 ; 2 : 1202-1204.
- Chan WS, Lee A, Spencer FA, et al : D-dimer testing in pregnant patients : towards determining the next ‘level’ in the diagnosis of deep vein thrombosis. J Thromb Haemost 2010 ; 8 : 1004-1011.
- Goodacre S, Horspool K, Nelson-Piercy C, et al : The DiPEP study : an observational study of the diagnosis accuracy of clinical assessment, D-dimer and chest x-ray for suspected pulmonary embolism in pregnancy and postpartum. BJOG 2019 ; 126 : 383-392.
- Konstantinides SV, Meyer G, Becattini C, et al : 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2020 ; 41 : 543-603.
- van der Pol LM, Tromeur C, Bistervels IM, et al : Pregnancy-Adapted YEARS Algorithm for Diagnosis of Suspected Pulmonary Embolism. N Engl J Med 2019 ; 380 : 1139-1149.
- Tan M, Mol GC, van Rooden CJ, et al : Magnetic resonance direct thrombus imaging differentiates acute recurrent ipsilateral deep vein thrombosis from residual thrombosis. Blood 2014 ; 124 : 623-627.
- Chan WS, Rey E, Kent NE, et al : Thromboembolisme veineux et traitement antithrombotique pendant la grossesse. J Obstet Gynaecol Can 2014 ; 36 : 527-553.
- Cohen H, Arachchillage DR, Middeldorp S, et al. : Prise en charge des anticoagulants oraux directs chez les femmes en âge de procréer : conseils du CSS de l’ISTH. J Thromb Haemost 2016 ; 14 : 1673-1676.
- Bauersachs, et al : Dtsch Med Wochenschr 2018 ; 143 : 1-6 (13).
PRATIQUE DU MÉDECIN DE FAMILLE 2021 ; 16(12) : 4-11