Au cours des dernières décennies, l’éventail des paramètres permettant d’évaluer les maladies neurologiques a augmenté de manière disproportionnée par rapport aux autres domaines de l’immunologie. De nombreuses maladies dont on ignorait la pathogenèse ou que l’on qualifiait de psychiatriques sont en réalité d’origine auto-immune.
Au cours des dernières décennies, l’éventail des paramètres permettant d’évaluer les maladies neurologiques a augmenté de manière disproportionnée par rapport aux autres domaines de l’immunologie. De nombreuses maladies dont on ignorait la pathogenèse ou que l’on qualifiait de psychiatriques sont en réalité d’origine auto-immune. Ces auto-anticorps sont divisés en deux groupes qui diffèrent en termes de pathogenèse, de clinique, d’association tumorale, de traitement, de pronostic et de diagnostic [1]. Certains anticorps reconnaissent des antigènes intracellulaires, sont associés à des syndromes paranéoplasiques et sont donc également appelés anticorps onconeuronaux. Les autres sont dirigés contre des domaines extracellulaires de récepteurs ou de canaux. Ils provoquent des encéphalites auto-immunes, répondent mieux à l’immunothérapie et présentent un meilleur pronostic en cas de traitement précoce, d’où l’importance d’un diagnostic correct. Les anticorps anti-GAD (glutamate décarboxylase) occupent une position intermédiaire. L’antigène est intracellulaire au niveau présynaptique dans les vésicules synaptiques, mais il est libéré dans la fente synaptique lors de la transmission du signal [2].
Anticorps contre les antigènes intracellulaires
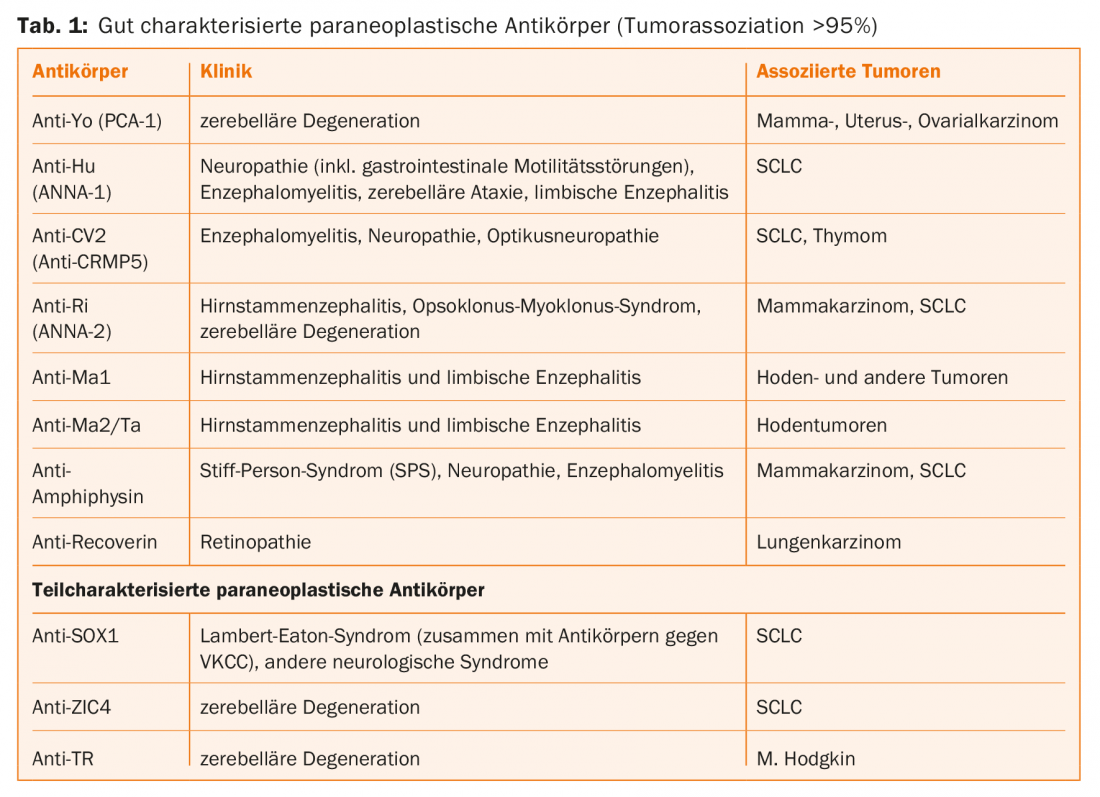
Dans le cadre des tumeurs, il peut y avoir des symptômes neurologiques qui ne sont pas déclenchés par la tumeur elle-même ou par le traitement. Lorsqu’une tumeur, par exemple un carcinome bronchique à petites cellules dérivé du neuroectoderme, exprime des protéines neuronales ectopiques [3], le système immunitaire active des lymphocytes T cytotoxiques pour se défendre, ce qui peut secondairement endommager les structures neurologiques. Chez deux tiers des patients, la tumeur n’est pas encore connue lors de l’apparition des symptômes neurologiques. Des anticorps paranéoplasiques peuvent être détectés dans le sang, qui ne sont pas eux-mêmes pathogènes, mais qui sont importants pour le diagnostic [4]. En règle générale, ces anticorps sont déterminés par immunoblot. Le sérum est suffisant, le test du LCR n’apporte pas d’informations supplémentaires. Il est indispensable que le laboratoire teste tout résultat positif par immunofluorescence indirecte sur tissu cérébral (figure 1) [5].
Parmi les anticorps paranéoplasiques, il y en a de bien caractérisés, dont on sait que dans >95% des cas, il y a une tumeur maligne derrière. Il existe également des cas sans tumeur, en particulier chez les enfants, de sorte que ces anticorps doivent être recherchés dans ce groupe d’âge en cas de symptômes correspondants [6]. Pour les anticorps paranéoplasiques partiellement caractérisés, la valeur prédictive par rapport à la tumeur n’est pas claire en raison de la base de données encore insuffisante [5]. Les anti-Tr et les anti-Sox-1 semblent particulièrement pertinents pour indiquer la présence d’une tumeur maligne. Cependant, les anticorps paranéoplasiques ne peuvent pas être détectés chez tous les patients, de sorte que la détection des anticorps n’est pas obligatoire pour le diagnostic. La recherche de tumeurs peut être mieux ciblée en tenant compte du syndrome clinique, de l’anticorps et des informations sur l’âge, le sexe et les antécédents de nicotine.
Le tableau 1 énumère les anticorps qui sont déterminés de manière routinière. Les manifestations neurologiques et les tumeurs malignes associées les plus fréquentes sont énumérées.
Anticorps contre les antigènes de surface
Les anticorps dirigés contre les canaux et les récepteurs reconnaissent les épitopes complexes, contrairement aux épitopes linéaires des anticorps intracellulaires. Les anticorps déclenchent directement les symptômes de la maladie en provoquant des modifications électrophysiologiques, des perturbations de la transmission synaptique et de la plasticité neuronale. Les mécanismes d’action possibles sont le crosslinking et l’internalisation des protéines. Les patients répondent souvent bien à l’immunothérapie, car lorsque l’anticorps est retiré, les protéines peuvent reprendre leur position sur la membrane et exercer leur fonction. L’évolution est souvent monophasique, mais des récidives sont possibles. Ces anticorps sont beaucoup plus rarement paranéoplasiques. La détection de ces anticorps se fait par immunofluorescence indirecte sur des cellules transfectées (Fig. 2), et pour la détection des anticorps dirigés contre les VGCC (canaux calciques voltage-dépendants), également par RIA (radio-immunoessai). Les immunoblots ne sont pas adaptés car ils dénaturent les protéines, qui ne sont alors plus reconnues par les anticorps. Les changements inflammatoires dans le LCR et l’IRM peuvent être absents, de sorte que le diagnostic de ces maladies peut être difficile. Pour un aperçu des principaux anticorps, voir le tableau 2.
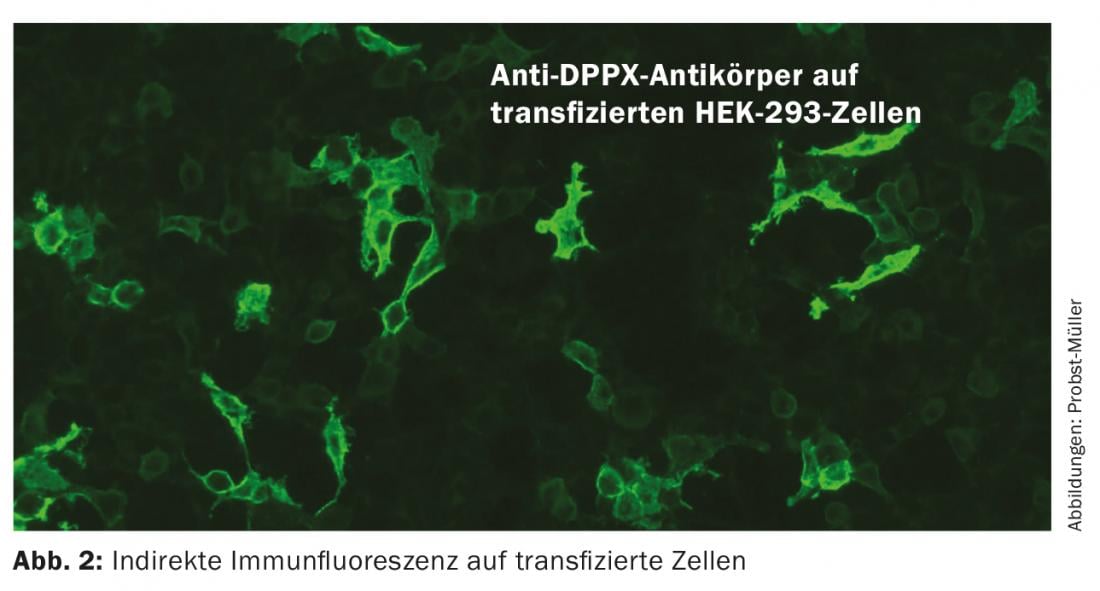
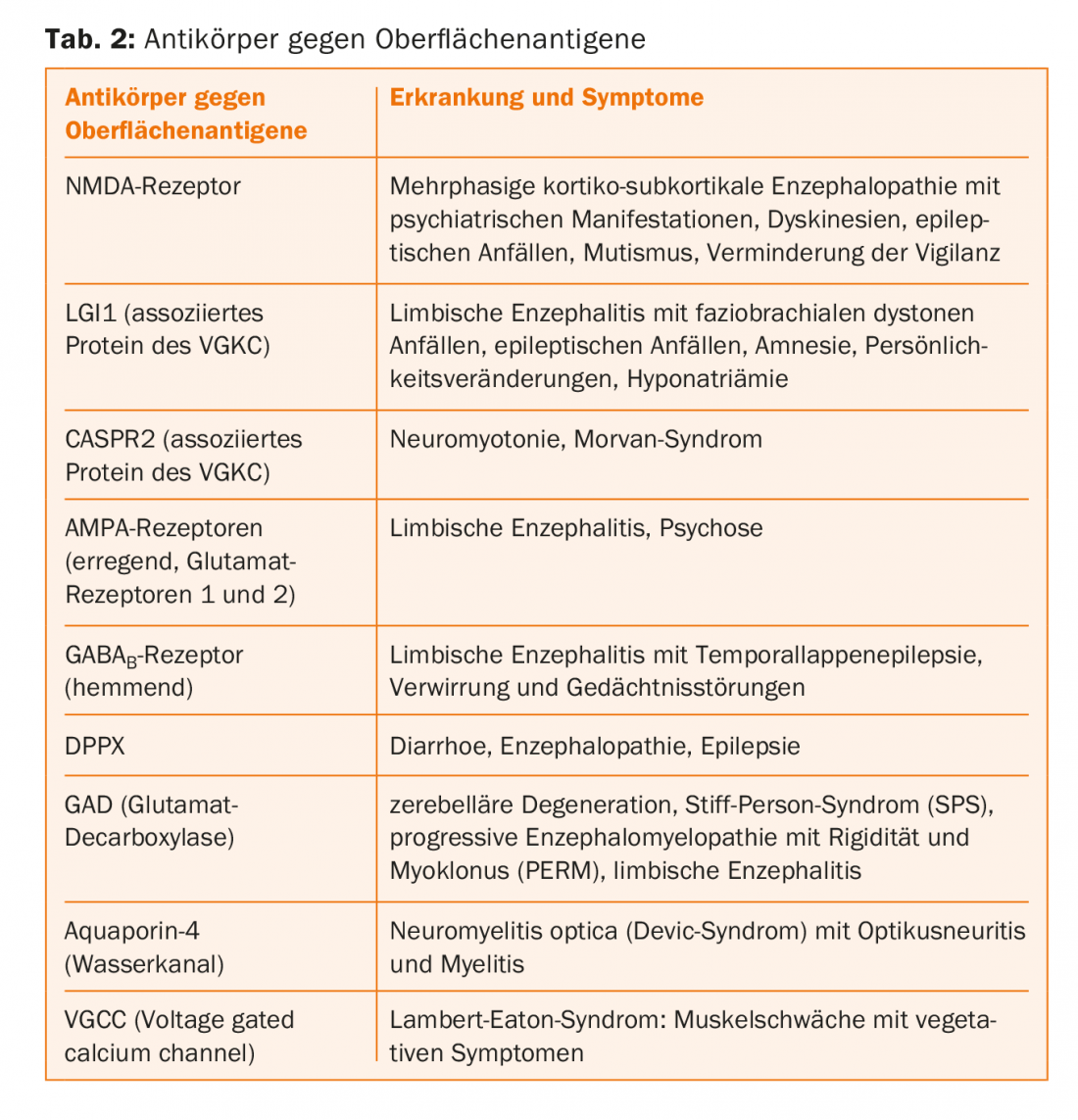
Encéphalite limbique (LE) : les symptômes typiques de la LE sont des pertes de mémoire, des anomalies psychiatriques et des crises d’épilepsie. En l’absence de ces derniers, la maladie était souvent considérée autrefois comme psychiatrique. Le LCR présente souvent, mais malheureusement pas toujours, des modifications inflammatoires : pléiocytose lymphocytaire, augmentation des protéines, léger trouble de la barrière et éventuellement des bandes oligoclonales. L’EEG peut révéler des anomalies médiotemporales et l’IRM peut révéler une inflammation de l’hippocampe. En outre, les patients doivent être soumis à une recherche d’anticorps associés à la LE. L’idéal est de tester le sérum et, si possible, le liquide céphalorachidien. Différents anticorps ont été décrits dans la LE (tab. 2). D’autres mammifères peuvent également tomber malades. La crise qui a conduit à la noyade de l’ours polaire Knut avait été déclenchée par des anticorps anti-récepteurs NMDA.
Encéphalite des récepteurs NMDA-AK : les récepteurs NMDA sont des canaux ioniques activés par le glutamate. Il existe de nombreux récepteurs de glutamate différents dans le système nerveux. Ils sont importants pour les impulsions nerveuses excitatrices. Le nom de récepteur NMDA vient du fait que ce canal est activé par la molécule synthétique NMDA. Une encéphalite déclenchée par des anticorps dirigés contre le récepteur NMDA [7,8] a été décrite à l’origine chez des jeunes femmes ou des jeunes filles atteintes d’un tératome de l’ovaire, mais d’autres groupes d’âge et des hommes sont également concernés. Il n’y a pas de tératome chez ces patients. Au début de la maladie, les troubles psychiatriques sont au premier plan, puis viennent les pertes cognitives et les crises d’épilepsie. Les troubles de la conscience et la dérégulation autonome peuvent conduire à l’admission en soins intensifs. Dans la plupart des cas, la détection d’anticorps dans le sérum est suffisante. Il est rare que seul le LCR soit positif, de sorte qu’en cas de forte suspicion, le LCR doit également être analysé.
Encéphalite due aux anticorps anti-LGI1 et CASPR2 : les canaux potassiques voltage-dépendants (VGKC) sont présents dans tout le cerveau. Ils servent à rétablir le potentiel de la membrane pendant l’hyperpolarisation. La RIA permet de trouver des anticorps contre les VGKC chez les patients atteints de neuromyotonie et d’encéphalite limbique. On sait aujourd’hui que les anticorps ne sont pas directement dirigés contre le VGKC, mais contre deux protéines associées, LGI1 et CASPR2 [9]. Les patients porteurs de ces anticorps sont majoritairement des hommes. Ils souffrent principalement d’encéphalite limbique avec des symptômes extralimbiques tels que la neuromyotonie avec des crampes musculaires douloureuses, des troubles moteurs, des troubles du sommeil et une hyponatrémie sérique. La fréquence de ces symptômes varie en fonction de l’anticorps. Les crises dystoniques faciobrachiales ne se produisent que chez les patients LGI1 positifs. Il s’agit de crises unilatérales avec grimaces et dystonie du bras ipsilatéral, qui durent moins de trois secondes, mais qui peuvent se produire jusqu’à des centaines de fois par jour. Ces crises sont déclenchées par des mouvements, des émotions et des bruits forts. Comme ces crises surviennent avant que l’encéphalite limbique ne s’accompagne de déficits cognitifs, elles permettent un diagnostic et un traitement précoces. La dysautonomie est dangereuse, avec notamment une bradycardie et une mort subite d’origine cardiaque. Les patients CASPR2-positifs sont les plus touchés.
Les patients doublement négatifs sont ceux qui présentent des anticorps contre le VGKC, mais qui sont négatifs pour les anticorps contre le LGI1 et le CASPR2. Des études récentes montrent que ces anticorps se lient aux parties intracellulaires du VGKC ou à la dendrotoxine, le venin de serpent utilisé dans l’AIR, et ne sont pas pathogènes. On les trouve chez des personnes en bonne santé ou chez des patients atteints de maladies non auto-immunes comme la maladie d’Alzheimer ou de Parkinson. De plus, ils sont détectables chez les travailleurs sains des abattoirs exposés aux aérosols de cerveaux d’animaux. Ces données montrent qu’il est probablement suffisant de déterminer uniquement les anticorps contre LGI1 et CASPR2, et non ceux contre le complexe VGKC.
Anti-GAD
L’enzyme glutamate décarboxylase (GAD) convertit en une seule étape le glutamate, le principal neurotransmetteur activateur, en acide γ-aminobutyrique (GABA), le principal neurotransmetteur inhibiteur. On trouve cette enzyme dans le système nerveux et dans le pancréas. Même si la GAD est une molécule intracellulaire, elle est libérée dans le cerveau lors de la libération des vésicules synaptiques et peut être reconnue par des auto-anticorps. Les auto-anticorps anti-GAD sont présents d’une part dans le diabète sucré de type I, d’autre part dans les maladies neurologiques [10]. Dans le cas du diabète sucré, les titres sont faibles. Pour les maladies neurologiques, les titres sont très élevés. Les maladies associées sont l’ataxie cérébelleuse, l’encéphalite limbique et le syndrome de Stiff-Person (SPS). Le SPS est une maladie rare qui peut être spontanée ou paranéoplasique. L’élément typique est une augmentation progressive du tonus musculaire au fil des années. Des convulsions surviennent spontanément ou de manière déclenchée. Comme ces spasmes sont également déclenchés par des émotions, des sons, des contacts, etc., la souffrance est souvent rejetée comme psychiatrique au début. L’électromyogramme montre une activité permanente, même lorsque le patient essaie de se détendre. Si des anticorps anti-GAD sont détectables, le SPS n’est généralement pas paranéoplasique. Lorsque des anticorps anti-amphiphysine sont détectés (tableau 1), il s’agit de femmes atteintes d’un cancer du sein.
Perspectives
Les anticorps présentés ici ne sont que les principaux. D’autres anticorps seront certainement ajoutés dans les années à venir. Il est important d’y penser chez les patients présentant des symptômes neurologiques peu clairs, afin que le diagnostic soit posé rapidement et que le meilleur traitement possible puisse être proposé au patient.
Messages Take-Home
- Au cours des dernières années, un grand nombre d’anticorps importants pour le diagnostic et le pronostic ont été décrits comme étant à l’origine de maladies à médiation immunitaire du système nerveux central et périphérique.
- Les antigènes cibles des anticorps sont classés en fonction de leur localisation : membranaire ou intracellulaire.
- Les anticorps dirigés contre des antigènes intracellulaires tels que Hu, Ri, Yo, CV2, SOX-1 sont également appelés onconeuronaux, car ils sont généralement présents dans le cadre de tumeurs malignes. Une tumeur doit être recherchée. L’immunothérapie n’a qu’un succès très limité.
- Les anticorps dirigés contre les antigènes membranaires tels que les récepteurs et les canaux, par exemple les récepteurs NMDA ou les canaux potassiques, déclenchent directement les symptômes et entraînent des encéphalites auto-immunes. Les patients répondent généralement bien à l’immunothérapie.
Littérature :
- Rachel L, et al. : Test d’auto-anticorps dans les encéphalopathies. Practical Neurology 2012 ; 12 : 4-13.
- Bost C, et al : Encéphalite auto-immune dans les institutions psychiatriques : perspectives actuelles. Maladie neuropsychiatrique et traitement 2016 ; 12 : 2775-2787
- Onganer PU, et al : Caractéristiques neuronales du cancer du poumon à petites cellules. British Journal of Cancer ; 93 : 1197-1201.
- Dalmau JO, et al : Syndromes paranéoplasiques. Arch Neurol 1999 ; 56 : 405-408.
- www.dgn.org/leitlinien/2383-ll-79-2012-paraneoplastische-neurologische-syndrome
- Honnorat J, et al : Encéphalopathie limbique auto-immune et anticorps anti-Hu chez les enfants sans cancer. Neurology 2013 ; 80(24) : 2226-2232.
- Gresa-Arribas N, et al : Titres d’anticorps au diagnostic et pendant le suivi de l’encéphalite à récepteurs anti-NMDA : une étude rétrospective. Lancet Neurol 2014 ; 13(2) : 167-177.
- Dalmau J, et al. : Encéphalite à récepteurs anti-NMDA : série de cas et analyse des effets des anticorps. Lancet Neurol 2008 ; 7(12) : 1091-1098.
- Binks NM, et al. : LGI1, CASPR2 et les anticorps associés : une évolution moléculaire des phénotypes. J Neurol Neurosurg Psychiatry 2017 ; 0 : 1-9.
- Saiz A, et al : Spectrum of neurological syndromes associated with glutamic acid decarboxylase antibodies : diagnostic clues for this association. Brain 2008 ; 131 : 2553-2563.
InFo NEUROLOGIE & PSYCHIATRIE 2018 ; 16(2) : 4-8