Depuis la première description d’une résection pancréatique par le chirurgien de Königsberg Walter Kausch en 1909, la chirurgie pancréatique s’est développée pour devenir un traitement central interdisciplinaire. La chirurgie du pancréas est la seule chance de guérison pour les patients atteints d’un cancer du pancréas. Le dépistage précoce de la maladie ainsi que la mise en place rapide d’un traitement multidisciplinaire personnalisé sont décisifs. Les nouvelles techniques radiologiques, les traitements (radio)oncologiques néoadjuvants et adjuvants ainsi qu’une meilleure prise en charge périopératoire dans des centres hautement spécialisés constituent la base décisive du succès thérapeutique.
Avec une incidence d’environ 10/100 000 habitants par an, le cancer du pancréas représente la quatrième à la cinquième cause de mortalité liée au cancer dans les pays industrialisés, et la tendance est à la hausse. Alors que la mortalité de nombreuses maladies malignes s’améliore, le cancer du pancréas reste l’un des cancers les plus mortels malgré les nouveaux concepts de traitement. Il faut s’attendre à ce que le cancer du pancréas soit la première cause de mortalité par cancer d’ici 2025.
La difficulté de traitement résulte de la biologie agressive de la tumeur, avec des métastases précoces, ainsi que du diagnostic tardif en l’absence prolongée de symptômes. C’est la raison pour laquelle seuls 20% des patients atteints de cancer du pancréas ont une chance de guérir. Dans l’ensemble, les taux de survie à 5 ans pour le cancer du pancréas approchent tout juste les 5%. Chez les patients pour lesquels une approche chirurgicale est possible, le taux de survie à 5 ans passe à plus de 20% [1]. L’accent devrait donc être mis sur la prévention et la détection précoce de la maladie, de préférence à un stade précoce ou en tant que lésion précurseur, et sur le rattachement rapide du patient concerné à un centre spécialisé.
Détection précoce
La détection précoce du cancer du pancréas est un défi majeur. Il manque des tests de dépistage ainsi que des programmes de détection précoce systématique. Il est essentiel que les symptômes cliniques d’alerte précoce soient reconnus à temps par le médecin généraliste. La Fondation suisse du pancréas mise donc sur des programmes de sensibilisation et met à disposition des fiches d’information (www.pankreasstiftung.ch).
Les symptômes possibles tels que la perte de poids, la réduction de l’état général, des douleurs abdominales non spécifiques ainsi que des douleurs dorsales peu claires dues à une infiltration des plexus nerveux rétropéritonéaux doivent faire penser à un cancer du pancréas. Un diabète sucré nouvellement apparu et, classiquement, un ictère indolore peuvent également être les premières manifestations. Si une tumeur maligne est détectée à un stade précoce et qu’elle peut être complètement enlevée, un taux de survie à 5 ans de 50% est possible en cas de biologie tumorale favorable [2].
La taille de la tumeur au moment du diagnostic est un facteur pronostique important. C’est pourquoi, lors des examens radiologiques, il convient de contrôler l’évolution des plus petites lésions ou des tumeurs kystiques du pancréas, car il pourrait déjà s’agir d’un carcinome ou de son précurseur. Les marqueurs tumoraux seuls ne sont pas appropriés comme test de dépistage, car aucun antigène tumoral spécifique n’est connu à ce jour. Toutefois, en combinaison avec l’anamnèse, la clinique et l’examen radiologique, les marqueurs tumoraux peuvent être utiles à l’évaluation.
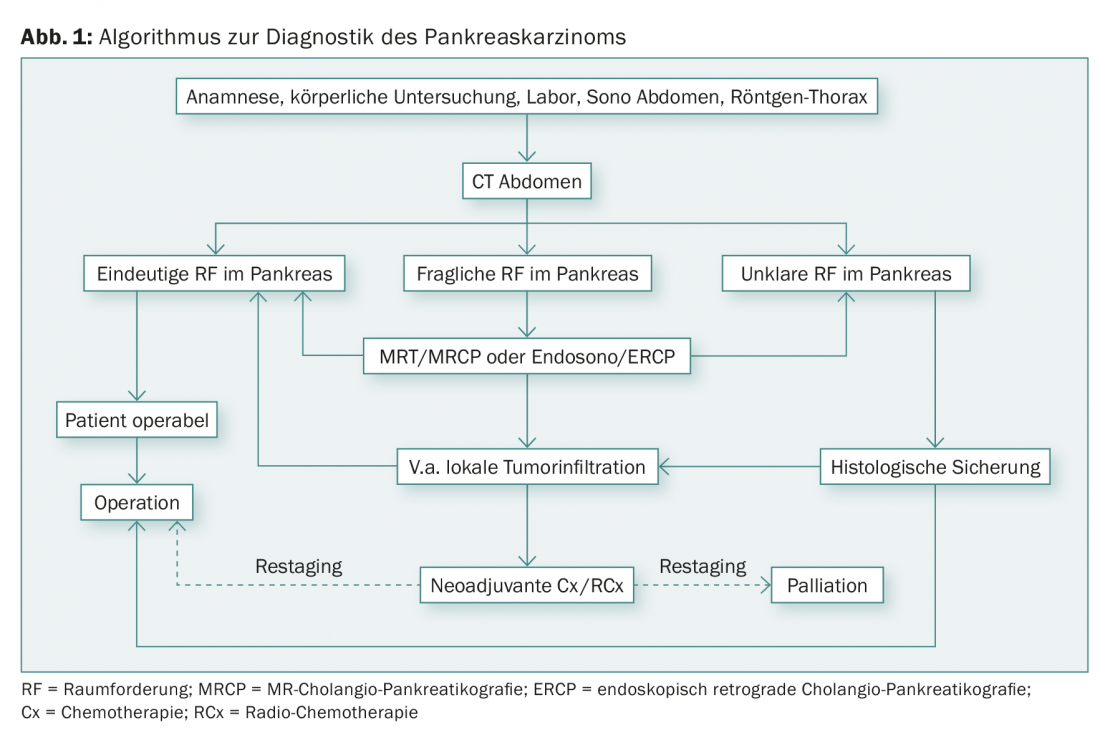
Algorithme de diagnostic
L’échographie, examen simple et peu coûteux, peut confirmer la congestion des voies biliaires. Cependant, l’évaluation de l’organe est souvent difficile en raison de sa position rétropéritonéale. Pour l’évaluation de la résécabilité et le staging, la tomodensitométrie du thorax et de l’abdomen est le gold standard [3].
L’imagerie par résonance magnétique combinée à l’angio-IRM et à la MRCP (=cholangio-pancréatographie par résonance magnétique) peut aider à différencier les tumeurs kystiques du pancréas et les métastases hépatiques douteuses.
L’endosonographie peut compléter d’autres techniques d’imagerie. Les petites tumeurs, en particulier, peuvent être facilement différenciées. Parallèlement, la biopsie à l’aiguille fine guidée par endosonographie est la meilleure méthode de confirmation histologique, par exemple avant une chimiothérapie palliative. Une biopsie de routine avant résection n’est pas recommandée.
La cholangio-pancréatographie rétrograde endoscopique (CPRE) occupe une place importante en raison de ses possibilités diagnostiques et thérapeutiques (pose de stents). La pose préopératoire d’un stent pour soulager les voies biliaires congestionnées est de plus en plus controversée. Une étude randomisée menée aux Pays-Bas a révélé des taux de complications périopératoires plus élevés chez les patients ayant bénéficié d’un drainage préopératoire des voies biliaires par rapport aux patients ayant subi une intervention chirurgicale immédiate [4]. Il est donc important de faire appel rapidement à un chirurgien spécialisé en cas d’obstruction des voies biliaires afin de déterminer le meilleur régime thérapeutique de manière interdisciplinaire. La laparoscopie diagnostique est utilisée en cas de suspicion de carcinose péritonéale (ascite, taux de CA-19-9 très élevé) ou de métastases hépatiques. Dans environ 30% des cas, les résultats obtenus excluent une résection curative.
Parmi les marqueurs sériques connus pour les tumeurs du pancréas (CA 19-9, CEA et NSE), le CA 19-9 a la plus grande sensibilité (80%) avec une spécificité de 75% pour un carcinome. Il convient de noter qu’un taux élevé de CA 19-9 peut également être lié à une cholestase. Le CA 19-9 dépend également des antigènes de groupe sanguin selon Lewis : chez les patients antigènes a et b négatifs (5-7% de la population), le CA 19-9 n’est pas exprimé. La figure 1 donne un aperçu de la procédure diagnostique en cas de suspicion de cancer du pancréas.
Risque opérationnel
Le traitement chirurgical reste la seule chance potentielle de guérison pour les patients atteints de cancer du pancréas. La résection à risque doit être effectuée dans des centres interdisciplinaires disposant d’une expertise appropriée afin de réduire au minimum la morbidité et la mortalité périopératoires. Les résultats chirurgicaux et oncologiques dépendent dans une large mesure du nombre de cas [5]. La morbidité postopératoire est d’environ 40% dans les centres expérimentés [6]. Les principaux problèmes postopératoires sont les fistules (5-30%), les fuites biliaires (0,4-8%), les hémorragies postopératoires (1-8%) et le retard de vidange gastrique avec difficulté de s’alimenter (19-23%), qui est généralement réversible après 14 jours. Dans environ 5% des cas, une relaparotomie est nécessaire. Une chirurgie pancréatique réussie passe donc par une bonne gestion des complications. L’expérience du chirurgien, en collaboration avec les anesthésistes, les gastroentérologues et les radiologues interventionnels, joue ici un rôle crucial. Le taux de mortalité après une intervention sur le pancréas est de 2 à 4 % dans les centres de référence.
Chirurgie du pancréas
La majorité des patients atteints de cancer du pancréas présentent des métastases à distance au moment du diagnostic, de sorte que seul un traitement palliatif est possible. Les tumeurs du pancréas qui sont localisées et ne présentent pas d’infiltration vasculaire ni de métastases à distance sont considérées comme résécables. Le cancer du pancréas localement avancé doit faire l’objet d’une discussion interdisciplinaire concernant un traitement multimodal. Dans chaque cas, il s’agit de choisir entre une résection primaire et un traitement néoadjuvant préalable (chimiothérapie ou radiochimiothérapie) (fig. 2) [7].
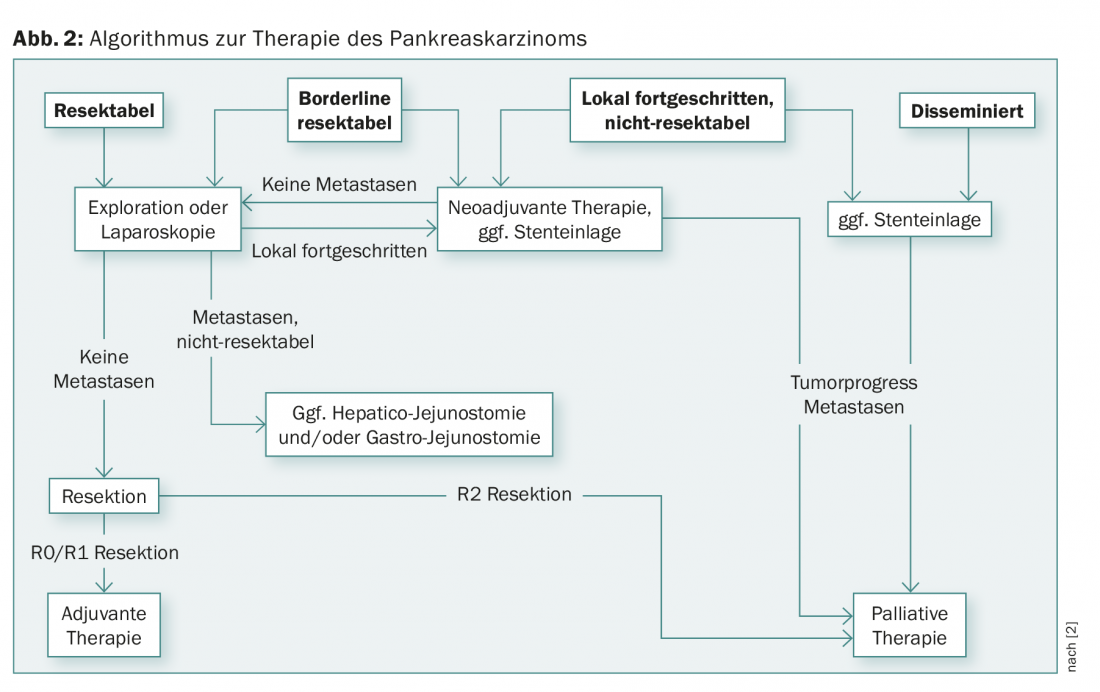
Les tumeurs localement avancées infiltrent souvent la veine porte, l’artère mésentérique supérieure ou le tronc coeliaque. Contrairement à la résection artérielle, la résection veineuse (veine porte ou veine mésentérique supérieure) peut être réalisée dans des centres spécialisés avec une morbidité et une mortalité comparables à celles de la résection pancréatique sans résection vasculaire [8]. Dans des cas isolés sélectionnés, une résection artérielle peut également être réalisée dans une intention curative, mais elle s’accompagne d’une morbidité et d’une mortalité périopératoires élevées [9].
Thérapie curative
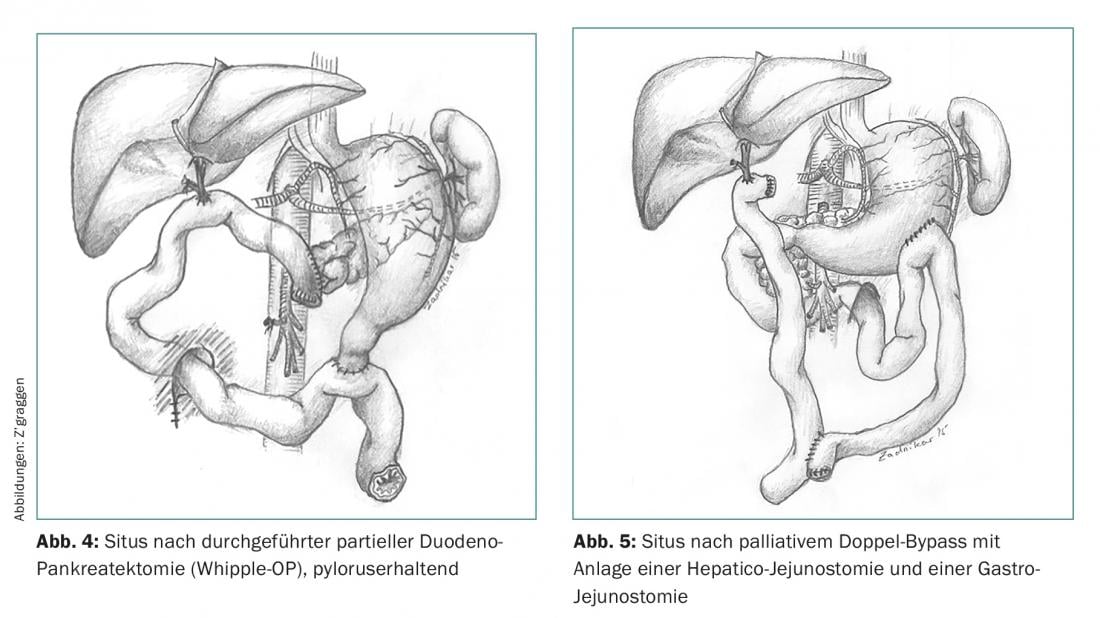
La résection d’une tumeur de la tête du pancréas nécessite une duodéno-pancréatectomie partielle (opération de Whipple) (fig. 3), qui peut être réalisée soit de manière classique en incluant l’estomac distal, soit en conservant le pylore (fig. 4). Les cancers du pancréas distal sont opérés par une résection en bloc de la queue du pancréas avec inclusion de la rate pour compléter la lymphadénectomie. La pancréatectomie totale est une troisième option thérapeutique, en particulier pour les cancers du pancréas localement avancés ou en cas de lésions précurseurs étendues ou multiples (par ex. IPMNs). L’atteinte des ganglions lymphatiques étant un facteur pronostique fort, une lymphadénectomie standardisée est toujours pratiquée dans le cadre de la chirurgie oncologique du pancréas.

Thérapie palliative
Le traitement palliatif du cancer du pancréas est le domaine de la chimiothérapie systémique. Des interventions endoscopiques ou chirurgicales sont souvent nécessaires en raison de sténoses tumorales des voies biliaires et/ou du duodénum. Dans tous les cas, le choix de la procédure (stent vs chirurgie) doit être effectué de manière interdisciplinaire en fonction de l’état général du patient. Si l’exploration chirurgicale d’un cancer du pancréas révèle une contre-indication à l’opération de Whipple prévue (métastases à distance), la mise en place d’une “double dérivation” est recommandée à des fins palliatives (Fig. 5).
Suivi des patients
Pour les patients qui ne se plaignent pas (bien-être, pas de douleur, pas de perte de poids), aucun suivi n’est établi après une résection du pancréas. Il est néanmoins utile de procéder à un examen clinique régulier des patients (par exemple tous les trois à six mois) et à un contrôle en laboratoire des paramètres initialement pathologiques.
Malnutrition et maldigestion
En pré- et péri-opératoire, de nombreux patients perdent beaucoup de poids [10]; cette perte de poids ne peut souvent être compensée qu’insuffisamment en post-opératoire. L’absence de prise de poids est due à une récidive du cancer du pancréas, à un apport calorique insuffisant, à une intolérance alimentaire ou à une insuffisance pancréatique exocrine.
Insuffisance pancréatique exocrine
Le dosage des enzymes digestives dépend de la gravité de l’insuffisance et de la teneur en graisse des aliments. En règle générale, on peut commencer par 2000 unités de lipase par gramme de graisse alimentaire et augmenter encore la dose si les symptômes persistent. La dose quotidienne ne doit pas dépasser 15 000 à 20 000 unités de lipase par kg de poids corporel. La préparation enzymatique doit être prise pendant les repas. En ce qui concerne l’efficacité, il convient de noter que l’acide gastrique est normalement neutralisé par le bicarbonate produit par le pancréas. Si cette neutralisation n’a pas lieu, le bol alimentaire reste acide dans l’intestin. Cela entraîne une activité limitée des enzymes pancréatiques, y compris celles qui sont substituées par des médicaments. L’inhibition de la pompe à protons (IPP) doit être discutée. De plus, il faut savoir que chez les patients ayant subi une résection gastrique ou prenant des IPP, l’absence ou l’insuffisance d’alcalinisation entraîne une dissolution incomplète ou tardive de la protection contre l’acidité, ce qui empêche les médicaments d’être suffisamment efficaces. Dans ce cas, soit il faut administrer des enzymes pancréatiques non protégées contre les acides, soit le patient ouvre la capsule et en ingère le contenu pendant le repas.
En outre, la duodéno-pancréatectomie classique et la duodéno-pancréatectomie avec conservation du pylore entraînent toutes deux une asynchronie pancréatico-colique. Cela signifie que les enzymes pancréatiques sont sécrétées au bon moment, mais qu’en raison de l’absence de duodénum, elles n’entrent en contact avec le chyme qu’au niveau du jéjunum moyen, elles courent en quelque sorte derrière le chyme. A cela s’ajoute la “rupture iléale”, une libération des hormones GLP-1 et PYY induite par le passage rapide des aliments dans l’iléon, qui entraîne une inhibition de la sécrétion pancréatique et une diminution de l’appétit [11].
Carence en vitamines et en fer
Une consommation continue d’alcool, une insuffisance exocrine marquée et/ou un apport en graisses très limité peuvent entraîner un déficit en vitamines liposolubles [12]. Pour éviter des carences qui entraîneraient à long terme l’ostéoporose et l’ostéomalacie, mais aussi des modifications de la vision et de la peau, il est nécessaire de contrôler chaque année les taux de vitamines et, le cas échéant, de les remplacer. La détection est possible par le dosage de la 25-OH-vitamine D3 dans le sérum. Une carence en vitamine K peut être évaluée par l’INR. Les taux sériques de vitamines A et E ne sont malheureusement pas fiables, la mesure du β-carotène peut éventuellement être utile dans ce cas. La prise de vitamines sous forme de comprimés n’est utile que si l’absorption est sûre. Si une opération classique de Whipple avec antrectomie a été réalisée, une injection intramusculaire mensuelle de vitamine B12 peut être nécessaire. Une éventuelle carence en fer (absence d’absorption duodénale) doit généralement être substituée par voie parentérale.
Insuffisance pancréatique endocrine
Un diabète sucré pancréatique peut se manifester en postopératoire. Celui-ci peut également se développer de manière retardée, c’est pourquoi des contrôles de l’évolution de l’HbA1c sont indiqués tous les trois à six mois.
Littérature :
- Neoptolemos JP, et al : Chimiothérapie adjuvante avec fluorouracil plus acide folique vs gemcitabine après résection d’un cancer du pancréas. Un essai contrôlé randomisé. J Am Med Ass 2010 ; 304 : 1073-1081.
- Hartwig W, et al : La chirurgie du cancer du pancréas dans le nouveau millénaire. Meilleure prédiction des résultats. Ann Surg 2011 ; 254 : 311-319.
- Callery MP, et al : Pretreatment assessment of resectable and borderline resectable pancreatic cancer. Déclaration de consensus d’experts. Ann Surg Oncol 2009 ; 16 : 1727-1733.
- van der Gaag NA, et al : Drainage biliaire préopératoire pour le cancer de la tête du pancréas. N Engl J Med 2010 ; 362(2) : 129-137.
- Gooiker GA, et al : Systematic review and meta-analysis of the volume-outcome relationship in pancreatic surgery. Br J Surg 2011 ; 98 : 485-494.
- Hüttner FJ, et al. : Pylorus-preserving pancreaticoduodenectomy (pp Whipple) versus pancreaticoduodenectomy (classic Whipple) for surgical treatment of periampullary and pancreatic carcinoma. Cochrane Database Syst Rev 2016.
- Werner J, et al : Advanced-stage pancreatic cancer : therapy options. Nat Rev Clin Oncol 2013 ; 10(6) : 323-333.
- Müller SA, et al : Résection vasculaire dans la chirurgie du cancer du pancréas. Déterminants de la survie. J Gastrointest Surg 2009 ; 13(4) : 784-792.
- Mollberg N, et al : Résection artérielle lors d’une pancréatectomie pour cancer du pancréas. A systematic review and meta-analysis. Ann Surg 2011 ; 254(6) : 882-893.
- Bachmann J, et al : La cachexie diminue le pronostic chez les patients atteints d’un cancer du pancréas résécable. J Gastrointest Surg 2008 ; 12 : 1193-1201.
- Maljaars PW, et al. : Bris de l’iléon. Une cible alimentaire sensible pour le contrôle de l’appétit. Une revue de la question. Physiol Behav 2008 ; 95 : 271-281.
- Marotta F, et al. : Concentration de vitamines liposolubles dans la pancréatite chronique induite par l’alcool. Relation avec la stéatorrhée. Dig Dis Sci 1994 ; 39 : 993-998.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(2) : 34-38