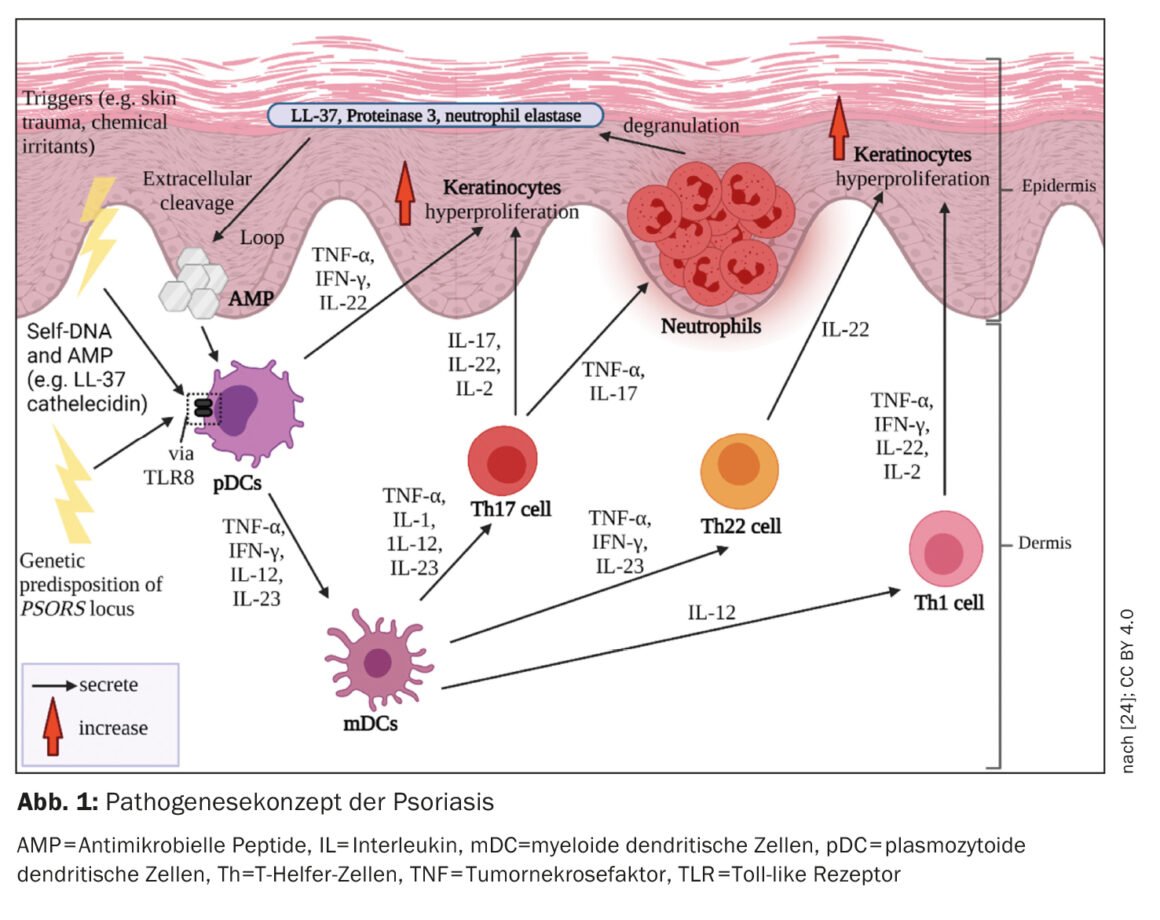
Les traitements systémiques innovants du psoriasis sont un exemple parfait de médecine translationnelle. Dans une revue publiée l’année dernière dans le Journal of Investigative Dermatology, le professeur Peter van de Kerkhof, ancien président de l’European Society for Dermatological Research (ESDR) et directeur médical de l’International Psoriasis Council, donne un aperçu actuel des concepts immunopathogéniques pertinents pour le traitement du psoriasis.
Au cours des dernières décennies, des progrès considérables ont été réalisés dans l’élucidation de la pathogenèse complexe et multifactorielle du psoriasis, ce qui a servi de base au développement d’options thérapeutiques très efficaces [1]. Aujourd’hui, au niveau cellulaire et moléculaire, une réaction immunitaire médiée par les cellules T et un environnement cytokinique caractéristique qui l’accompagne sont considérés comme le mécanisme pathologique essentiel [2]. Au niveau génétique, de nombreux loci associés au psoriasis ont été identifiés. Le HLA-C*06:02 est considéré comme l’allèle à risque principal du psoriasis vulgaire [3]. Celui-ci est situé sur le locus de susceptibilité au psoriasis PSORS1. Une preuve des mécanismes pathologiques auto-immuns dans le psoriasis a été apportée par la découverte que HLA-C*06:02 provoquait une réponse auto-immune contre ADAMTSL5, un auto-antigène mélanocytaire [17,18]. Outre ADAMTSL5, LL-37/cathélicidine et PLA2G4D sont deux autres auto-antigènes potentiels qui semblent jouer un rôle dans l’initiation ou le maintien des lésions psoriasiques [19].
Le psoriasis en tant que maladie auto-immune à médiation par les cellules T
L’immunopathogénèse du psoriasis implique des processus du système immunitaire inné et acquis (Fig. 1). Ies cellules du système immunitaire inné sont impliquées dans le début de la cascade inflammatoire. Les cellules dendritiques (DC) et les macrophages semblent jouer un rôle clé dans l’établissement d’une réponse immunitaire dominée par les cellules T auxiliaires 1 (Th1) et Th17. L’activation de DC dans la peau entraîne la libération d’interleukine-12 (IL-12) et d’IL-23, qui stimulent les cellules T naïves pour qu’elles se différencient en cellules Th1 (par l’IL-12) et Th17 (par l’IL-23) [4]. Les cellules T helper (Th) coordonnent la réponse immunitaire adaptative à médiation cellulaire. Les cellules Th1 et Th17 activées sécrètent les cytokines IFN-γ et TNF-α ou IL-17 et IL-22, qui favorisent la poursuite de la pathogenèse [5,6].
Milieu pro-inflammatoire
Dans le psoriasis, la réponse immunitaire est principalement médiée par les cellules Th1. alors que dans la dermatite atopique, il y a une dominance Th2. Les populations de lymphocytes T dans les biopsies de lésions psoriasiques, qui ont montré des infiltrats de lymphocytes T différents par rapport aux lésions dans le cadre de la dermatite atopique chez le même patient, confirment le paradigme Th1/Th2 [1,8]. Le TNF-α, l’IFN-γ, l’IL-17A, l’IL-17F, l’IL-22, et l’IL-6 forment un réseau de cytokines dans les lésions psoriasiques, qui induit notamment l’hyperprolifération des kératinocytes [1]. Le processus de différenciation accéléré des kératinocytes réduit leur temps de transit de la couche basale à la couche cornée d’environ 30 à 5-8 jours [9]. Cela se traduit par une desquamation et un épaississement de l’épiderme, caractéristiques du psoriasis. Les kératinocytes activés produisent également des médiateurs pro-inflammatoires et expriment des molécules d’adhésion à la surface des cellules, ce qui entraîne une amplification et une chronicité de la réponse immunitaire [10].
Mémoire immunologique : “Tissue Resident Memory T cells” (cellules T résidentes de la mémoire tissulaire)
Les lésions psoriasiques présentent un nombre total de cellules immunitaires plus élevé par rapport à la peau saine [11]. Même dans la peau de patients atteints de psoriasis qui ne présentent pas de lésions cliniques, un nombre plus élevé de cellules T a été détecté que dans la peau saine [11]. L’accumulation intraépidermique de cellules CD8 est cruciale pour le développement de lésions psoriasiques [1]. Mais comment en arrive-t-on là ? Une fois que les auto-antigènes ont été présentés aux cellules dendritiques, une activation des cellules T se produit. Les cellules T activées migrent dans l’épiderme, des processus complexes étant nécessaires pour atteindre l’épiderme – on pense que les intégrines α1β1 jouent un rôle important dans ce processus. Le blocage de α1β1 par un anticorps monoclonal a entraîné l’accumulation de cellules T épidermiques et le développement de lésions psoriasiques dans le modèle murin [12].
Les cellules T, qui se trouvent dans l’épiderme, jouent un rôle extrêmement important dans la pathogenèse du psoriasis. Dans les plaques psoriasiques, les cellules CD4-positives se trouvent principalement dans le derme et les cellules CD8-positives principalement dans l’épiderme [13]. Une grande partie des cellules CD8 positives dans l’épiderme font partie des “cellules T de la mémoire des tissus” (cellules TRM, CD8+ TRM). Il s’agit de cellules T mémoires qui restent dans les lésions psoriasiques disparues et qui conservent une mémoire immunologique, ce qui explique pourquoi les lésions psoriasiques réapparaissent souvent aux mêmes endroits [14]. Les TRM CD8+ sont un biomarqueur potentiel de l’activité résiduelle de la maladie [15,16].
Rétrospective historique de la médecine : les thérapies systémiques antipsoriasiques
Dans les années 1980, des études menées avec l’immunosuppresseur ciclosporine A, qui s’est avéré efficace dans le traitement du psoriasis, ont confirmé qu’il s’agissait d’une maladie à médiation par les cellules T [26,27]. La ciclosporine inhibe la phosphatase calcineurine dans le cytoplasme et bloque ainsi la phosphorylation du facteur nucléaire des cellules T (NFATc), qui est responsable de l’activation des gènes de plusieurs cytokines pro-inflammatoires [1]. Les effets antipsoriasiques des Ig anti-CD4 et CTLA-4 [28,29] ont apporté un soutien supplémentaire à la thèse selon laquelle les cellules T sont une cible thérapeutique importante. Dans les années 1990, une équipe américaine a montré que des lésions psoriasiques pouvaient être induites par l’injection de cellules T autologues sur une peau psoriasique non malade transplantée sur des souris SCID [30]. Dans le même modèle, il a été montré que les lymphocytes T CD4+ induisent des lésions psoriasiques dans la peau psoriasique non malade [31].
| Anticorps monoclonaux et “petites molécules Les produits biologiques ont révolutionné les options de traitement du psoriasis. Les agents biologiques disponibles aujourd’hui permettent d’obtenir un contrôle efficace et sûr de la maladie à long terme. Alors que l’utilisation d’anticorps anti-TNF-α permet d’obtenir un PASI75# chez une majorité de patients, les anticorps anti-IL17A et anti-IL-23 permettent d’obtenir un PASI100** chez environ la moitié des patients, ce qui illustre la pertinence de la voie de signalisation IL-23/IL-17 dans le psoriasis. L’efficacité des produits biologiques a été comparée dans des méta-analyses en réseau [20]. Selon les caractéristiques du patient, y compris les comorbidités éventuelles, il est préférable d’opter pour l’une ou l’autre classe de substances. En Suisse, outre les inhibiteurs du TNF-α et l’ustekinumab, un anticorps anti-IL12-/23, plusieurs substances actives appartenant aux groupes des anticorps anti-IL17A (secukinumab, ixekizumab) et des anticorps anti-IL-23 (guselkumab, risankizumab, tildrakizumab) sont actuellement autorisées [25]. Le bimekizumab, un inhibiteur de l’IL17A/17F, a également franchi les obstacles à l’enregistrement [25]. Dans le domaine des “petites molécules”, l’inhibiteur de la PDE-4, l’aprémilast, est un médicament oral autorisé. En outre, le deucravacitinib (TYK2-i oral), le roflumilast (PDE-4-i topique) et le tapinarof (agoniste AHR topique) sont actuellement en cours d’évaluation clinique [21–23]. |
| # PASI75 = une amélioration d’au moins 75% du PASI (Psoriasis Area and Severity Index) ** PASI 100 = une amélioration de 100% du PASI (Psoriasis Area and Severity Index) |
Les cellules Th CD4+ sont connues pour sécréter différentes cytokines. L’importance de ces messagers dans la pathogenèse du psoriasis est confirmée par la très bonne réponse thérapeutique lors de la neutralisation ciblée de cytokines individuelles du système immunitaire. On a d’abord constaté que le blocage du TNF-α contribuait à soulager le psoriasis [32,33]. L’ustékinumab, un médicament biologique ciblant la sous-unité p40 commune à l’IL-12 et à l’IL-23, a ensuite été approuvé et a montré une bonne efficacité dans le psoriasis [1]. Les anticorps monoclonaux qui ciblent sélectivement la sous-unité p19 de l’IL-23 (guselkumab, risankizumab, tildrakizumab) se sont révélés encore plus efficaces (encadré). Les biothérapies ciblant l’IL-17A (sécukinumab, ixekizumab) et celles qui inhibent à la fois l’IL-17A et l’IL17F (bimekizumab) sont également très efficaces (encadré).
Outre les différentes classes de produits biologiques (antagonistes du TNFα, de l’IL-17, de l’IL-12/23 ou de l’IL-23) et les traitements systémiques conventionnels (ciclosporine A, méthotrexate, acitrétine ou esters d’acide fumarique), les agents de faible poids moléculaire jouent également un rôle dans le traitement médicamenteux du psoriasis. L’aprémilast est un inhibiteur oral de la PDE-4 (phosphodiestérase-4) approuvé, entre autres, pour le traitement du psoriasis. Les effets anti-inflammatoires de l’aprémilast sont induits par une augmentation du taux d’AMPc intracellulaire. En outre, un inhibiteur de la PDE-4 à usage topique, le roflumilast, fait actuellement l’objet d’essais cliniques [34]. Il en va de même pour d’autres représentants des “petites molécules ” (encadré).
Littérature :
- van de Kerkhof PC: From Empirical to Pathogenesis-Based Treatments for Psoriasis. J Invest Dermatol 2022; 142(7): 1778–1785.
- Di Meglio P, Villanova F, Nestle FO: Psoriasis. Cold Spring Harb Perspect Med 2014; 4(8): 1–30.
- Prinz JC: Human Leukocyte Antigen-Class I Alleles and the Autoreactive T Cell Response in Psoriasis Pathogenesis. Front Immunol 2018; 9: 954.
- Schäkel K, Schön M, Ghoreschi K: Pathogenese der Psoriasis vulgaris. Der Hautarzt 2016; 67(6): 422–431.
- Di Cesare A, Di Meglio P, Nestle FO: The IL-23/Th17 axis in the immunopathogenesis of psoriasis. Journal of Investigative Dermatology 2009; 129(6): 1339–1350.
- Lynde CW, et al.: Interleukin 17A: toward a new understanding of psoriasis pathogenesis. Journal of the American Academy of Dermatology 2014; 71(1): 141–150.
- Johansen C, et al.: Inverse regulation of the nuclear factor-κB binding to the p53 and interleukin-8 κB response elements in lesional psoriatic skin. Journal of investigative Dermatology 2005; 124(6): 1284–1292.
- Eyerich S, et al.: Mutual antagonism of T cells causing psoriasis and atopic eczema.N Engl J Med 2011; 365: 231–238.
- Schneider S, Li L, Zink A: Psoriasis – Differentialdiagnosen und Therapie. Akt Rheumatol 2022; 47: 324–332.
- Greb JE, et al.: Psoriasis. Nature Reviews Disease Primers 2016; 2: 16082.
- Lowes MA, et al.: Increase in TNF-alpha and inducible nitric oxide synthase-expressing dendritic cells in psoriasis and reduction with efalizumab (anti-CD11a). Proc Natl Acad Sci U S A 2005; 102: 19057–19062.
- Conrad C, et al.: Alpha1beta1 integrin is crucial for accumulation of epidermal T cells and the development of psoriasis. Nat Med 2007; 13: 836–842.
- Bovenschen HJ, Seyger MM, van de Kerkhof PC: Plaque psoriasis vs. atopic dermatitis and lichen planus: a comparison for lesional T-cell subsets, epidermal proliferation and differentiation. Br J Dermatol 2005; 153: 72–78.
- Clark RA: Resident memory T cells in human health and disease. Sci Transl Med. 2015 Jan 7; 7(269): 269rv1.
- Cheuk S, et al. Epidermal Th22 and Tc17 cells form a localized disease memory in clinically healed psoriasis. J Immunol 2014; 192: 3111–3120.
- Benezeder T, Wolf P: Resolution of plaque-type psoriasis: what is left behind (and reinitiates the disease). Semin Immunopathol 2019; 41: 633–644.
- Prinz JC: Melanocytes: Target Cells of an HLA-C*06:02-Restricted Autoimmune Response in Psoriasis. J Invest Dermatol 2017; 137(10): 2053–2058.
- Arakawa A, et al.: Melanocyte antigen triggers autoimmunity in human psoriasis. J Exp Med 2015; 212(13): 2203–2212.
- Hawkes JE, Chan TC, Krueger JG: Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol 2017; 140(3): 645–653.
- Armstrong AW, et al.: Comparison of biologics and oral treatments for plaque psoriasis: a meta-analysis. JAMA Dermatol 2020; 156: 258–269.
- Papp K, et al.: Phase 2 trial of selective tyrosine kinase 2 inhibition in psoriasis. N Engl J Med. 2018; 379: 1313–1321.
- Lebwohl MG, et al.: Trial of roflumilast cream for chronic plaque psoriasis. N Engl J Med. 2020; 383: 229–239.
- Robbins K, et al.: Phase 2, randomized dose-finding study of tapinarof (GSK2894512 cream) for the treatment of plaque psoriasis. J Am Acad Dermatol 2019; 80: 714–772.
- Mohd Noor AA, Azlan M, Mohd Redzwan N: Orchestrated Cytokines Mediated by Biologics in Psoriasis and Its Mechanisms of Action. Biomedicines. 2022 Feb 20;10(2): 498. www.mdpi.com/2227-9059/10/2/498, (dernière consultation 15.03.3023)
- Information sur les médicaments, www.swissmedicinfo.ch,(dernière consultation 15.03.2023)
- Ellis CN, et al.: Cyclosporine improves psoriasis in a double-blind study. JAMA 1986; 256: 3110–3116
- Griffiths CE, et al.: Clearance of psoriasis with low dose cyclosporin. Br Med J (Clin Res Ed) 1986; 293: 731–732.
- Abrams JR, et al.: Blockade of T lymphocyte costimulation with cytotoxic T lymphocyte-associated antigen 4-immunoglobulin (CTLA4Ig) reverses the cellular pathology of psoriatic plaques, including the activation of keratinocytes, dendritic cells, and endothelial cells. J Exp Med 2000; 192: 681–694.
- Nicolas JF, et al.: CD4 antibody treatment of severe psoriasis. Lancet 1991; 338: 321
- Wrone-Smith T, Nickoloff BJ: Dermal injection of immunocytes induces psoriasis. J Clin Invest. 1996; 98: 1878–1887.
- Nickoloff BJ, Wrone-Smith T: Injection of pre-psoriatic skin with CD4+ T cells induces psoriasis. Am J Pathol 1999; 155: 145–158.
- Zaba LC, et al. : Amelioration of epidermal hyperplasia by TNF inhibition is associated with reduced Th17 responses [published correction in J Exp Med 2008;205:1941]. J Exp Med. 2007; 204: 3183–3194.
- Zaba LC, et al.: et al. Effective treatment of psoriasis with etanercept is linked to suppression of IL-17 signalling, not immediate response TNF genes. J Allergy Clin Immunol. 2009; 124: 1022–1030.E395
- Lebwohl MG, et al.: Trial of roflumilast cream for chronic plaque psoriasis. N Engl J Med. 2020; 383: 229–239.
DERMATOLOGIE PRAXIS 2023; 33(2): 20–22