Les trois piliers fondamentaux du traitement des patients atteints de fibrillation auriculaire (FAV) sont la réduction du risque d’attaque cérébrale, la prévention de la tachycardiomyopathie et l’amélioration de la qualité de vie par la réduction des symptômes. L’ablation par cathéter de la fibrillation auriculaire est supérieure au traitement antiarythmique en termes de contrôle du rythme et de qualité de vie [1,2]. Les directives actuelles laissent une marge de manœuvre relativement importante dans l’indication de l’isolation des veines pulmonaires. Les meilleures chances de succès sont enregistrées chez les patients sans cardiopathie structurelle avec une fibrillation auriculaire paroxystique symptomatique ou persistante depuis moins d’un an. Plus le traitement intervient tôt dans l’évolution de la maladie, plus les taux de réussite de l’ablation par cathéter sont élevés. Grâce aux grandes avancées technologiques, les taux de complications sont très faibles dans les centres expérimentés, ce qui permet de parler d’une procédure très sûre.
Avec une prévalence de 1,5 à 2 %, la fibrillation auriculaire est l’un des troubles du rythme cardiaque les plus fréquents dans la pratique clinique quotidienne. La prévalence augmente avec l’âge. Chez les personnes âgées de 80 ans, plus de 8% sont touchées [3,4], les hommes un peu plus souvent que les femmes. La fibrillation auriculaire idiopathique, qui n’est pas associée à une cardiopathie structurelle, a une prévalence allant jusqu’à 30% [5].
Selon la durée, la fibrillation auriculaire est classée en paroxystique (≤48 heures), persistante (>7 jours), persistante de longue durée (>1 an) et permanente. Dans ce dernier cas, le trouble du rythme est accepté et on ne cherche plus à contrôler le rythme. Comme pour le score NYHA, la charge arythmique est attribuée à un score de symptômes (EHRA I-IV).
La mortalité des patients atteints de fibrillation auriculaire est multipliée par environ 1,5 chez les hommes et par 1,9 chez les femmes. C’est ce que révèlent les analyses de l’étude de Framingham. D’une part, il existe un risque accru d’insuffisance cardiaque avec un risque de décompensation cardiaque multiplié par trois, et d’autre part, on constate un risque multiplié par cinq d’accident cérébrovasculaire ou d’embolie systémique. Le score CHA2DS2-VASc permet d’évaluer le risque d’accident vasculaire cérébral de manière individuelle et un peu plus précise.
Options de traitement et indication du contrôle du rythme
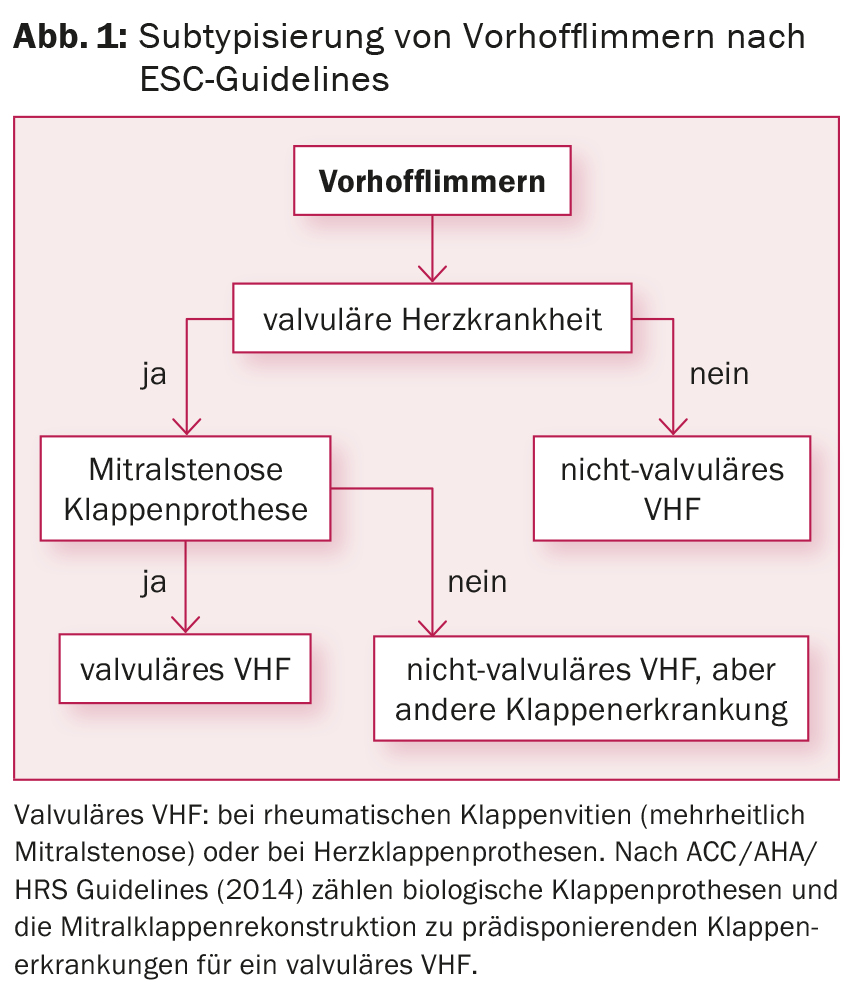
En tenant compte de la stratification du risque par le score CHA2DS2-VASc, une anticoagulation orale (ACO) par Marcoumar® ou, en cas de fibrillation auriculaire non valvulaire (figure 1), par l’un des nouveaux anticoagulants (dits ” ACO “) doit être prescrite chez tous les patients présentant un ≥1 point, quel que soit le sous-type de fibrillation auriculaire et même si le rythme est contrôlé. anticoagulants oraux directs [DOAK], p. ex. rivaroxaban, dabigatran, apixaban, edoxaban). Pour réduire les symptômes et éviter une tachycardiomyopathie (en cas de fréquences persistantes >120 bpm), il faut également s’efforcer de contrôler la fréquence. Les études menées jusqu’à présent n’ont pas montré de différence entre le contrôle de la fréquence et le contrôle du rythme en termes de réduction de la morbidité et de la mortalité [6]. Si le traitement médicamenteux ne donne pas de résultats, l’ablation du nœud AV avec mise en place d’un pacemaker permanent est une option possible pour le contrôle de la fréquence, en particulier en présence de comorbidités.
Le contrôle du rythme a une importance déterminante dans la fibrillation auriculaire paroxystique et persistante, en particulier chez les patients symptomatiques malgré un contrôle strict de la fréquence. Deux méthodes de base peuvent être utilisées : le traitement médicamenteux continu par antiarythmiques et l’approche invasive par ablation. Dans la situation aiguë avec instabilité hémodynamique, celle-ci peut également être obtenue par électroconversion (ECV). Si un traitement rythmique est préféré à un contrôle de la fréquence, il doit être initié le plus rapidement possible après le diagnostic, car le maintien du rythme sinusal devient plus difficile avec la durée de la fibrillation auriculaire [7,8].
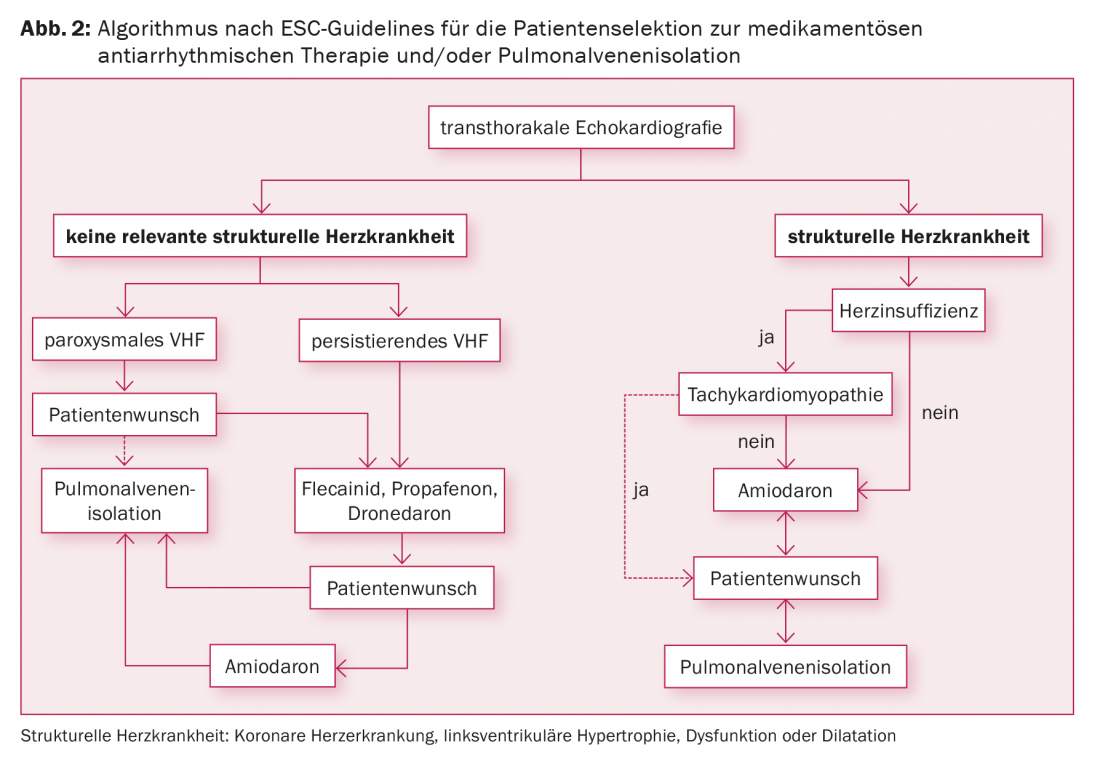
Les indications de l’isolation des veines pulmonaires sont la fibrillation auriculaire symptomatique malgré un traitement antiarythmique, la fibrillation auriculaire symptomatique et le souhait du patient de ne pas avoir à prendre d’antiarythmiques, ainsi que la fibrillation auriculaire symptomatique associée à des contre-indications aux antiarythmiques (Fig. 2). Les données montrant une prévention des événements cardio-emboliques par l’ablation par cathéter font actuellement défaut. Selon les études actuelles, le souhait d’arrêter l’ACO n’est donc pas une indication pour l’isolation des veines pulmonaires, car l’ACO doit être poursuivie même après une ablation réussie, en fonction du score CHA2DS2-VASc.
Isolation des veines pulmonaires
Depuis la fin des années 1990, on sait que plus de 90% des foyers ectopiques (appelés déclencheurs) à l’origine d’une fibrillation auriculaire sont localisés au niveau des veines pulmonaires. Initialement, on a tenté d’éliminer ces foyers actifs par ablation locale directe. Or, il n’était pas rare que cela entraîne des sténoses des veines pulmonaires. On sait aujourd’hui qu’il suffit d’isoler les veines dans la région où elles se jettent dans l’oreillette gauche (antrum), ce qui est plus doux. Sur la base de ces connaissances, l’isolation des veines pulmonaires s’est imposée comme une stratégie thérapeutique invasive grâce au développement réussi de différentes techniques d’ablation et de cartographie, avec une amélioration consécutive de l’efficacité et de la sécurité au cours des 10 à 15 dernières années.
En règle générale, les patients entrent à l’hôpital la veille de l’examen. Le même jour, une échocardiographie transoesophagienne est réalisée et, si nécessaire, un scanner ou une IRM du cœur. Ces images peuvent faciliter la reconstruction tridimensionnelle de l’oreillette gauche.
Sous analgosédation (une anesthésie générale n’est pas obligatoire), plusieurs cathéters sont introduits dans l’oreillette droite via la veine cave inférieure par un accès veineux dans l’aine et sont finalement placés dans l’oreillette gauche par une ponction transseptale (Fig. 3) .
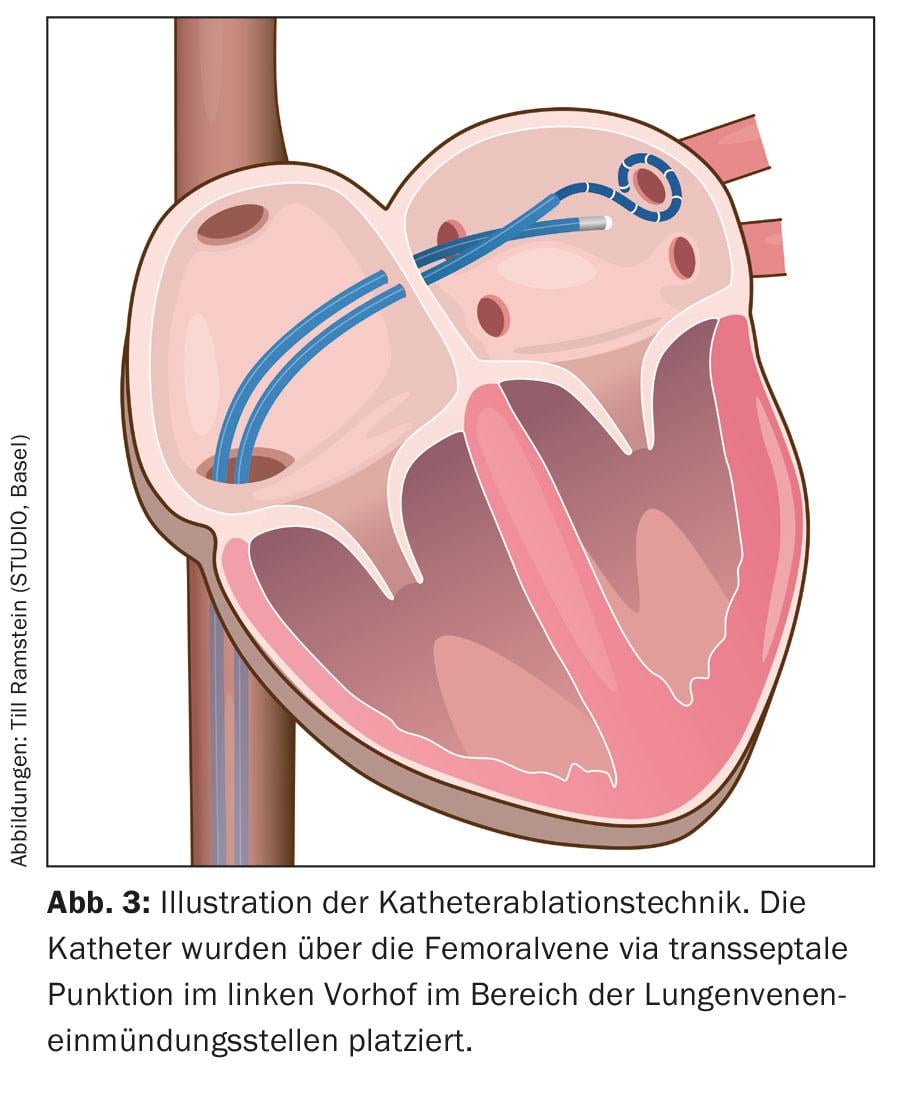
Ces cathéters permettent de reconstruire la zone d’ablation en trois dimensions, ce que l’on appelle la cartographie 3D (fig. 4). Outre les méthodes radiographiques utilisant uniquement des cathéters de cartographie pour représenter la connexion entre les veines pulmonaires et l’oreillette gauche, des méthodes dites de “cartographie électro-anatomique”, qui utilisent un système tridimensionnel et non principalement radiographique, ont été intégrées à la procédure.
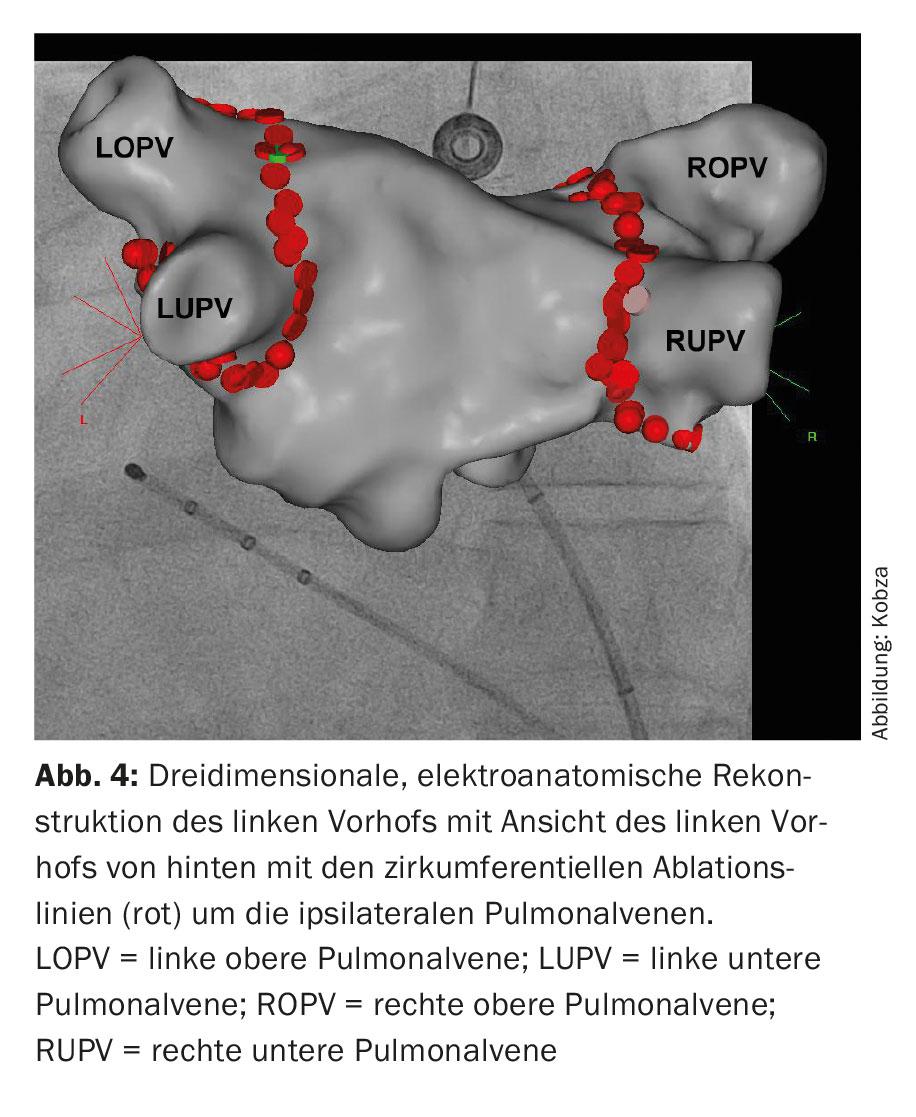
Une intégration d’images de l’anatomie reconstruite de l’oreillette gauche basée sur le scanner et l’IRM est possible. L’ablation est ensuite réalisée. L’ablation circonférentielle point à point est réalisée par paires autour des ostia des veines pulmonaires ipsilatérales à l’aide d’une énergie radiofréquence, un courant alternatif haute fréquence (“wide area circumferential radiofrequency catheter ablation”, WACA) (Fig. 4). Une autre méthode consiste à isoler le cathéter par congélation, appelée ablation par cryoballon (Fig. 5). De nouveaux cathéters d’ablation circulaires et multipolaires sont également utilisés. Les procédures au laser, qui sont également réalisées à l’aide d’un cathéter assisté par ballonnet, sont de plus en plus répandues. Toutefois, l’asymétrie et la variabilité de taille possibles des orifices des veines pulmonaires ainsi que leurs variations anatomiques peuvent compliquer la conception “taille unique” des cathéters d’ablation assistée par ballonnet. L’ablation par radiofréquence reste la méthode la plus répandue. Un cathéter de cartographie circulaire permet de contrôler l’isolation électrique obtenue. L’isolement des quatre veines pulmonaires est le principe fondamental et l’objectif premier de l’intervention, faute de quoi des récidives de fibrillation auriculaire peuvent survenir et conduire à l’échec du traitement.
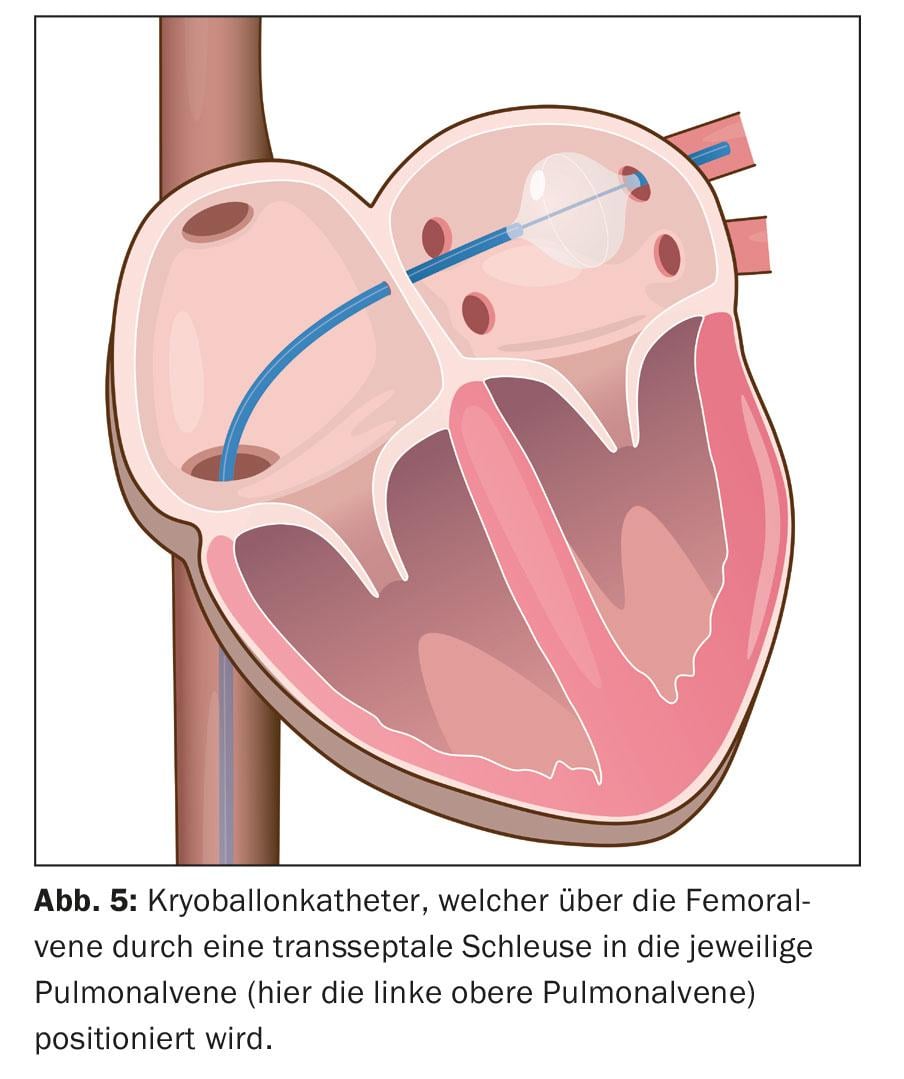
L’intervention dure généralement de 90 à 180 minutes. Après le retrait de tous les cathéters, un pansement compressif est appliqué. La plupart du temps, les patients peuvent quitter l’hôpital le lendemain.
Les ACO ne sont pas arrêtés en péri-intervention, car cette stratégie est associée à moins de complications [9]. En post-intervention, l’ACO est maintenue pendant au moins trois mois (en raison de la formation de cicatrices dans la zone de l’ablation), puis ajustée en fonction du risque individuel selon le score CHA2DS2-VASc.
Succès du traitement
Aucune méthode optimale ne s’est encore établie comme gold standard pour le diagnostic d’éventuelles récidives de fibrillation auriculaire. Selon le centre, des contrôles ECG à long terme (24 heures à 7 jours) sont effectués après l’intervention à des intervalles variables, généralement à trois, six et douze mois, puis tous les ans.
Le succès dépend en grande partie de l’expérience du centre qui l’effectue. Au cours des trois premiers mois, on observe parfois encore des troubles du rythme cardiaque (extrasystoles auriculaires et fibrillation auriculaire) qui ne doivent pas être considérés comme une récidive (“blanking period”). Si un rythme sinusal continu est ensuite obtenu, la procédure peut être considérée comme un succès. Le taux de réussite est de 80-90% chez les patients atteints de fibrillation auriculaire paroxystique sans cardiopathie structurelle, 20-30% nécessitant une répétition de la procédure. En cas de fibrillation auriculaire persistante ou de présence d’une cardiopathie structurelle, le taux de réussite est de 60 à 70%. Le traitement par ablation a donc pris une place très importante, car même l’amiodarone, l’antiarythmique le plus efficace, permet d’obtenir une préservation du rythme d’environ 40 à 50% à long terme.
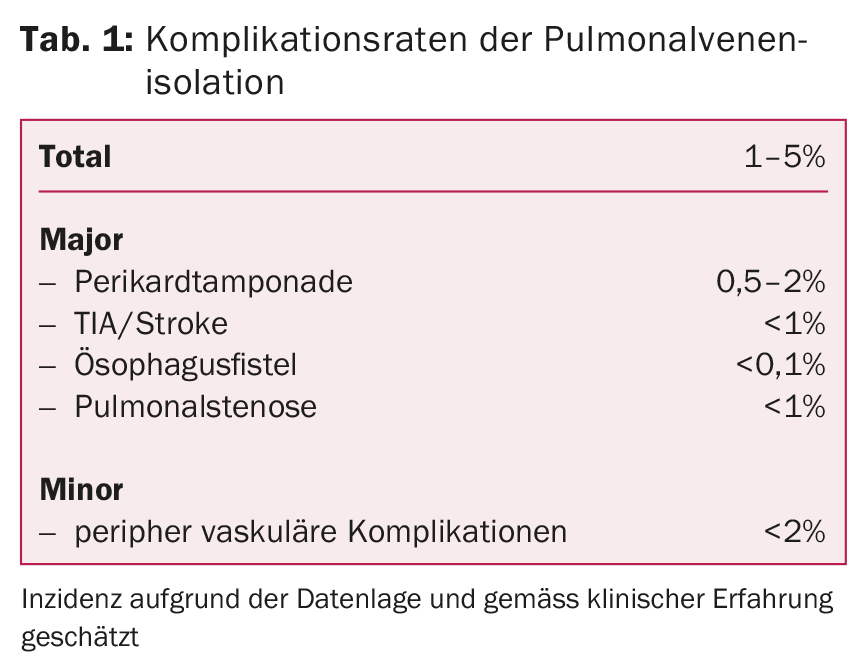
Dans les centres expérimentés, ce traitement est très sûr et associé à peu de complications. Les complications les plus dangereuses sont les événements thromboemboliques (AIT, accident vasculaire cérébral), la tamponnade péricardique, la sténose des veines pulmonaires ou les fistules œsophago-atriales. Des complications plus fréquentes peuvent survenir au niveau du site d’injection, telles que des hémorragies secondaires, des hématomes ou des lésions vasculaires (tableau 1).
Remerciements : Un grand merci à Till Ramstein (STUDIO, Bâle) pour la réalisation des figures 3 et 5.
Littérature :
- Cosedis Nielsen J, et al : Ablation par radiofréquence comme traitement initial de la fibrillation auriculaire paroxystique. N Engl J Med 2012 ; 367(17) : 1587-1595.
- Wazni OM, et al : Radiofrequency ablation vs antiarrhythmic drugs as firstline treatment of symptomatic atrial fibrillation : A randomized trial. JAMA 2005 ; 293 : 2634-2640.
- Feinberg WM, et al : Prévalence, répartition par âge et par sexe des patients atteints de fibrillation auriculaire. Analyse et implications. Arch Intern Med 1995 ; 155 : 469-473.
- Heeringa J, et al : Prévalence, incidence et risque à vie de fibrillation auriculaire : l’étude de Rotterdam. Eur Heart J 2006 ; 27 : 949-953.
- Sankaranarayanan R, et al. : Comparaison de la fibrillation auriculaire chez les jeunes par rapport à celle chez les personnes âgées : une revue. Cardiol Res Pract 2013 ; 2013 : 976976.
- The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators : A comparison of rate control and rythm control in patients with atrial fibrillation. N Engl J Med 2002 ; 347 : 1825-1833.
- Cosio FG, et al : Le retard dans le contrôle du rythme de la fibrillation auriculaire peut être une cause de l’échec à prévenir les récurrences : les raisons pour changer pour un traitement antiarythmique actif au moment ou le premier épisode détecté. Europace 2008 ; 10 : 21-27.
- Kirchhof P : Peut-on améliorer les résultats chez les patients atteints de fibrillation auriculaire grâce à un traitement précoce ? BMC Med 2009 ; 7 : 72.
- Cappato R, et al : rivaroxaban non interrompu vs. antagonistes de la vitamine K non interrompus pour l’ablation par cathéter dans la fibrillation auriculaire non valvulaire. Eur Heart J 2015 Jul 21 ; 36(28) : 1805-1811.
CARDIOVASC 2015 ; 14(5) : 3-6