En Suisse, environs 10% des personnes âgées de plus de 35 ans souffrent d’insuffisance rénale chronique (IRC). L’IRC est en général asymptomatique, et souvent mise en évidence lors d’un contrôle laboratoire de routine. L’IRC est un facteur de risque indépendant de la mortalité globale et cardiovasculaire. Il n’est pas toujours très clair pour le médecin de premier recours de savoir exactement quand doit-il référer le patient au néphrologue, et quelles sont les mesures à entreprendre pour stabiliser la fonction rénale. C’est ce que nous discuterons dans cet article, en plus du diagnostic et des causes de l’IRC.
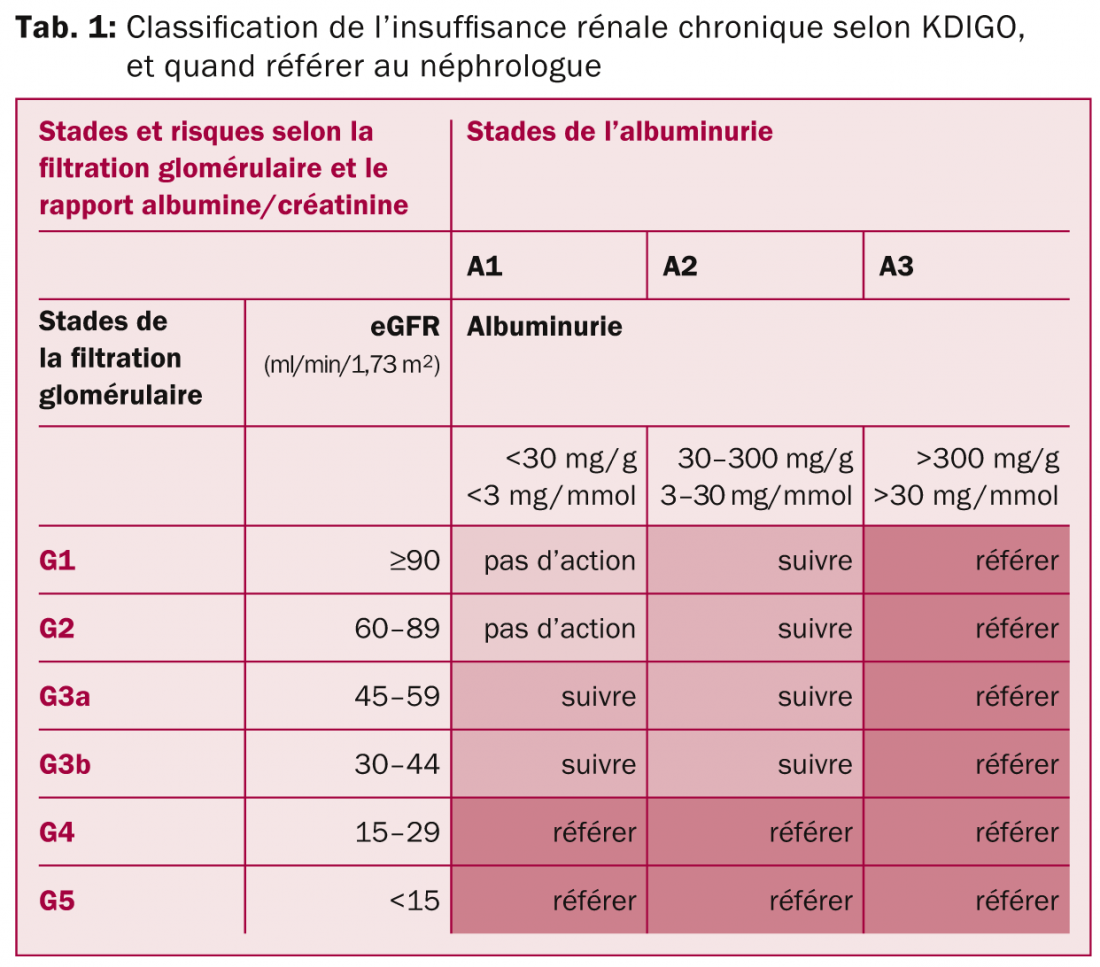
Chaque médecin est, dans sa pratique quotidienne, confronté à des patients qui présentent une valeur élevée de créatinine. Le premier réflexe sera de vérifier cette valeur et d’estimer la filtration glomérulaire (eGFR) avec l’utilisation de formules spécifiques, dont les plus fiables et les plus couramment utilisées sont le CKD-EPI et le MDRD. Depuis plusieurs années, la majorité des laboratoires d’analyses médicales déterminent l’eGFR parallèlement au dosage de créatinine. Selon la définition d’une insuffisance rénale chronique (IRC), l’eGFR doit être inférieure à 60 ml/min/1,73 m2 sur une période de trois mois minimum. Des questions évidentes s’imposeront alors d’elles-mêmes: s’agit-il réellement d’une maladie rénale, quelle en est la cause, quel bilan le médecin de premier recours peut-il effectuer, et quand doit-il référer le patient au néphrologue? Voir tableau 1 pour avoir les informations d’une forme synthètique. Dans cet article nous essayerons de répondre à ces questions. De plus, nous décrirons brièvement de quelles mesures disposent le néphrologue en 2014 pour stabiliser la fonction rénale. L’approche médicale de l’insuffisance rénale aiguë, qui est hors contexte à ce travail, ne sera donc pas discutée.
Cas clinique
Vous suivez depuis cinq ans Monsieur M., âgé de 64 ans, pour une hypertension artérielle, qui est traité par de l’amlodipine. Il présente également une obésité avec un IMC de 31 kg/m². Il y a cinq ans, sa créatininémie était de 90 μmol/l (eGFR: 80 ml/min/1,73 m²). Vous décidez de contrôler sa fonction rénale, et sa créatininémie est alors de 115 μmol/l (eGFR: 56 ml/min/1,73 m²). Lors d’un contrôle trois mois plus tard sa créatininémie est à 117 μmol/l (eGFR: 54 ml/min/1,73 m²), et sa pression artérielle au cabinet est de 140/88 mmHg. Que faites-vous?
Epidémiologie de l’insuffisance rénale chronique
Selon la définition citée dans l’introduction, ce patient a une IRC. Ce diagnostic s’impose également en cas de tout autre signe d’atteinte rénale, soit anatomique (par exemple: polykystose rénale), et/ou fonctionnelle (albuminurie/hématurie glomérulaire), même si l’eGFR est >60 ml/min/1,73 m² [1]. Nous vivons actuellement une épidémie de l’insuffisance rénale chronique. Une étude récente a ainsi estimé à 10% la prévalence de l’IRC en Suisse chez des personnes âgées de plus de 35 ans, chiffre correspondant aux estimations internationales [2]. Cette épidémie est particulièrement inquiétante car l’IRC est un facteur indépendant de la mortalité globale et cardiovasculaire [3]. Les causes principales de cette hausse sont le vieillissement de la population, l’augmentation de l’hypertension artérielle, l’obésité et le diabète. Par ailleurs, des études génétiques à grande échelle nous ont permis d’identifier certains facteurs génétiques prédisposant, bien que ces derniers expliquent, de nos jours, qu’une petite partie de la variabilité interindividuelle de la fonction rénale.
L’absence d’un marqueur idéal pour mesurer la fonction rénale est très souvent discutée dans la littérature. En effet, les limitations de la créatininémie sont maintenant bien connues et sont liées aux oscillations alimentaires et un manque d’harmonie entre les différents laboratoires d’analyses médicales; la créatininémie dépend aussi de la masse musculaire.Les formules actuellement les plus utilisées pour le calcul de l’eGFR sont le «CKD-EPI» et le «MDRD». Le CKD-EPI est plus précis en présence d’une fonction rénale peu altérée, alors que le MDRD est lui plus précis en cas d’une insuffisance rénale avancée. Ces deux formules tiennent compte du sexe, de l’ethnie et l’âge de la personne. Ainsi même si la créatininémie reste stable, l’eGFR déclinera avec l’âge du patient. C’est pourquoi beaucoup de personnes âgées de plus de 75 ans ont, selon la définition, une IRC, bien qu’elles ne développent probablement pas d’IRC avancée. En 2014, le dosage de la cystatine C peut, dans ces cas, nous permettre de trancher pour une IRC ou non. La cystatine C est produite de façon continue par toutes les cellules mononuclées, et n’est pas influencée par la masse musculaire ou l’alimentation [4].
Quand référer au néphrologue?
Dans l’idéal, chaque patient avec une IRC devrait être vu au moins une fois par un néphrologue. Quelques études suggèrent que référer un patient tôt au néphrologue («early referral») est bénéfique, et permet ainsi d’améliorer le contrôle de la pression artérielle et de ralentir le déclin de la fonction rénale [5,6].
Néanmoins, il faut bien définir le terme «tôt» mentionné ci-dessus. Il est peu probable que vous adressiez le patient mentionné ci-dessus d’emblée au néphrologue, et d’ailleurs, les sociétés médicales comme le «kidney disease initiative and global outcome» (KDIGO) ou encore la société américaine de néphrologie ne le préconisent pas [7]. Même si ce patient ne doit probablement pas être référé au néphrologue, un minimum d’analyses s’impose avant de conclure à une «néphropathie ischémique et hypertensive», qui est le diagnostic le plus probable dans ce cas.
Une anamnèse approfondie mérite d’être réalisée, en se focalisant (vu l’âge du patient) sur un éventuel prostatisme, sur l’utilisation de médicaments hors prescription (tels que des anti-inflammatoires non-stéroïdiens [AINS], des préparations de la médecine alternative ou des compléments alimentaires comme l’acide aristolochique ou des suppléments de créatine), ainsi que sur des symptômes évoquant un éventuel syndrome néphrotique (œdèmes palpébraux et/ou des membres inférieurs, prise de poids, urine «mousseuse»). Ensuite, l’analyse de l’urine est primordiale. Une bandelette urinaire et une mesure quantitative de l’albuminurie par immuno-néphélométrie suffisent, mais pourront toutefois être complétées par une imagerie des voies urinaires en cas de prostatisme, afin de ne pas manquer une cause post-rénale. Une hématurie détectée par la bandelette urinaire doit être suivie par un examen microscopique de l’urine (sédiment urinaire). Le patient devra être référé à un néphrologue en cas de sédiment urinaire pathologique (hématurie >20 globules rouge de type glomérulaire par champ ou présence de cylindres érythrocytaires et/ou leucocytaires) ou en cas d’une albuminurie >300 mg/24h (ACR [albumine-créatinine ratio] >30 mg/mmol). En absence de ces anomalies, un contrôle annuel de l’eGFR et de l’urine suffira.
Selon les directives internationales, nous recommandons également de référer un patient au néphrologue en cas d’insuffisance rénale aiguë, d’eGFR <30 ml/min/1,73 m2, d’un déclin accéléré de la fonction rénale (>5 ml/min/1,73 m2/année), d’albuminurie >300 mg/24h (ACR >30 mg/mmol), d’une IRC avec pression artérielle non contrôlée malgré la prescription d’au moins trois antihypertenseurs, avec des troubles électrolytiques (hyperkaliémie, hyperphosphatémie, acidose métabolique) et/ou avec une anémie normocytaire [7].
Que fait le néphrologue?
Etablir le diagnostic: Le néphrologue essayera d’abord d’établir la cause de l’IRC. Bien qu’il s’agisse souvent d’une néphropathie diabétique ou hypertensive, il faut rester vigilant pour ne pas manquer une autre maladie rénale sous-jacente. Dans le cadre de patients diabétiques par exemple, certains auteurs estiment qu’environ 20% des sujets diabétiques ont une insuffisance rénale d’une autre origine que le diabète. Le plus souvent, il s’agit dans ce cas d’une hyalinose focale et segmentaire (HSF), d’une maladie de Berger (néphropathie à IgA) ou d’une glomérulonéphrite extra-membraneuse, mais quelques maladies génétiques comme des mutations dans l’HNF1β font aussi partie du diagnostic différentiel. Un patient de 40 ans avec une IRC, souffrant de crises de goutte à répétition, d’une hyperuricémie et de troubles de la concentration urinaire, nous suggère une maladie liée à l’uromoduline (ces maladies font partie des «ADTKD» (autosomal dominant tubulo-interstitial kidney disorders).
Chez les personnes âgées, des maladies myéloprolifératives ou oncologiques peuvent se manifester, dans un premier temps, au niveau rénal par une protéinurie disproportionnée (causée par un excès de chaines légères), une glomérulonéphrite de type hyalinose focale et segmentaire à lésions minimes ou extra-membraneuse. Un ultrason rénal est en règle générale à effectuer chez tous les patients avec une IRC. L’ultrason, d’une part, nous permettra d’exclure une cause post-rénale ou structurelle de l’IRC (hydronéphrose, polykystose), et d’autre part, la taille et l’echogénicité des reins nous donneront une idée sur le pronostic et la réversibilité de l’IRC (cf. Figure 1 pour quelques exemples).

Une ponction biopsie rénale (PBR) est souvent, mais pas toujours, effectuée pour poser le diagnostic final. Une analyse risques-bénéfices est nécessaire avant d’effectuer un tel geste, car même si des complications sont rares, une PBR représente toujours un risque d’hématurie macroscopique à 3,5, de néphrectomie à 0,01, et de décès de 0,02%.
Instaurer des mesures de «néphroprotection»: Une fois le diagnostic posé, le néphrologue débutera, si possible, un traitement ciblant la cause spécifique (par exemple un traitement immunosuppresseur, une substitution enzymatique, etc.). En parallèle, le néphrologue instaurera des mesures de «néphroprotection» (tableau 2). Ces mesures peuvent d’ailleurs également être introduites par le médecin de premier recours.
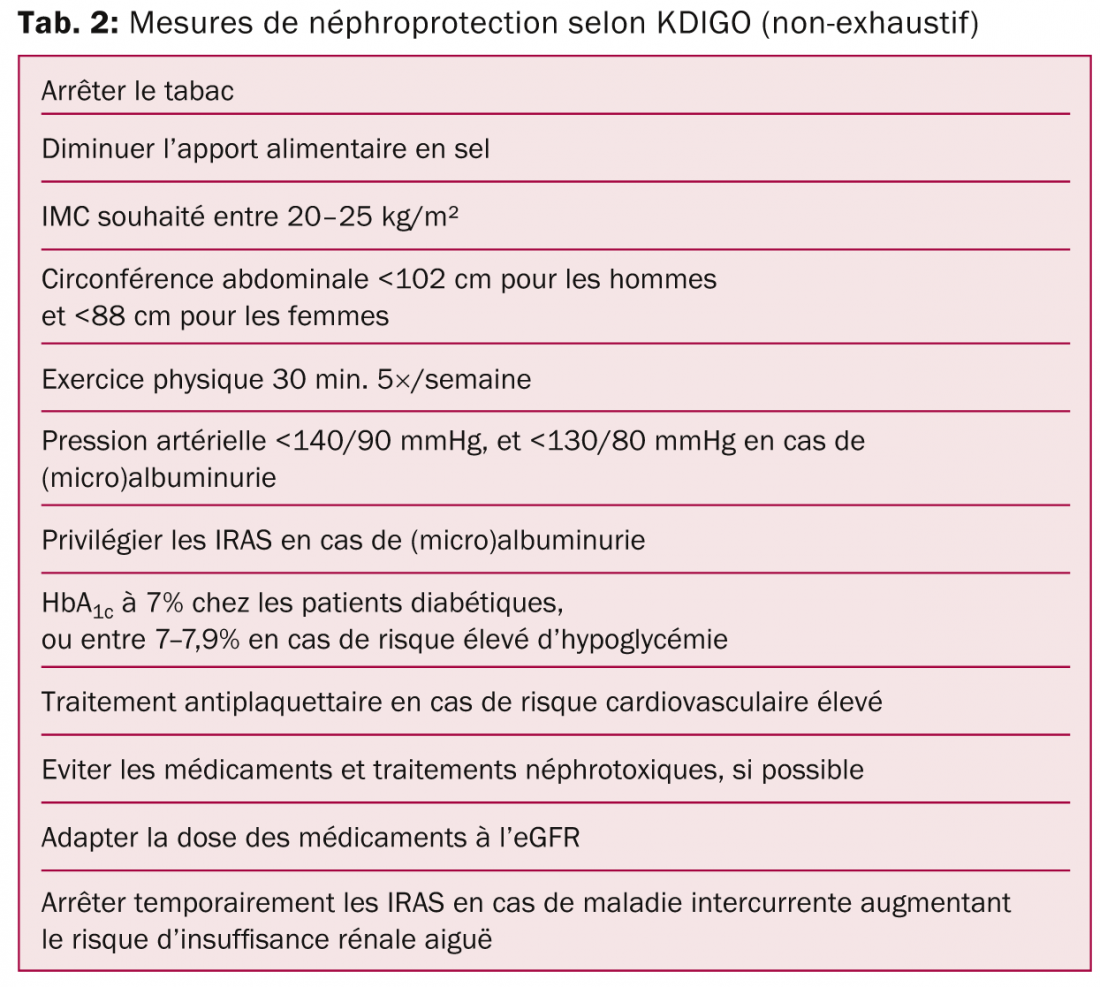
Premièrement, l’hygiène de vie est primordiale avec l’arrêt du tabac, la perte de poids en cas d’obésité, la modération de la consommation d’alcool et la pratique d’une activité physique (30 min. 5×/semaine au minimum). L’IRC est un facteur de risque cardiovasculaire indépendant et la plupart des patients décèdent d’un événement cardiovasculaire avant de développer une insuffisance rénale terminale. Hormis l’amélioration du style de vie, il est conseillé d’introduire un traitement antiplaquettaire en cas de risque cardiovasculaire élevé, et de demander un avis cardiologique au moindre doute d’une cardio- ou coronaro-pathie sous-jacente.
Deuxièmement, le type et la dose des médicaments quotidiennement pris par le patient doivent être vérifiés. Les AINS et antibiotiques néphrotoxiques sont généralement contre-indiqués. Les médicaments qui méritent également toute notre attention sont les antidiabétiques oraux: la metformine, les dérivées de la sulfonylurée (excepté le répaglinide) et les inhibiteurs de DPP-4 (excepté le linagliptine) sont contre-indiqués en cas d’un eGFR <30 ml/min/1,73 m², et nécessitent une réduction de leur dose en cas d’une eGFR entre 45 – 60 ml/min/1,73 m². Certains hypolipémiants, somnifères et antidépresseurs nécessitent aussi une diminution de leur dose, tout comme les opiacés. Une question fréquente des patients est la quantité d’eau qu’ils doivent boire par jour pour protéger leurs reins. Actuellement, nous n’avons pas de preuves scientifiques qu’un apport hydrique abondant soit bénéfique pour les reins. Nous conseillons donc, de façon pragmatique, de boire en fonction de la soif, en évitant les extrêmes. Ceci correspond en général à 1,5–2 litres/jour. Par contre, les patients souffrant de ADPKD et/ou de néphrolithiase récidivante doivent impérativement boire plus de 3 litres/jour, de sorte à supprimer l’hormone antidiurétique (impliquée dans la croissance des kystes) en cas de ADPKD, et de diluer au maximum les concentrations des composants des calculs (oxalate, calcium, acide urique, phosphate, etc.) en cas de néphrolithiase.
Le contrôle de la pression artérielle est primordial pour ralentir la progression d’une atteinte rénale et pour diminuer la protéinurie, si présente [8]. Selon les derniers directives, la pression artérielle doit alors être <140/90 mmHg pour les patients avec une IRC sans diabète, <140/85 mmHg pour les patients avec une IRC et un diabète, et <130/80 mmHg pour les patients avec une IRC et une (micro)albuminurie [9]. De nombreuses études ont démontré que les inhibiteurs du système rénine angiotensine (IRAS) diminuent la pression glomérulaire et ainsi la microalbuminurie et sa progression vers une macroalbuminurie. Les IRAS sont donc à privilégier par rapport aux autres classes de médicaments chez tous les patients atteints d’une IRC et (micro)albuminurie. La majorité des patients avec une IRC et une hypertension artérielle nécessiteront une bi- voire une tri-thérapie anti hypertensive. Un traitement par anticalcique, béta bloquant et/ou diurétique sera ajouté selon les comorbidités [10]. Le double blocage du système RAS n’est plus recommandé comme le montre de récentes études: risque d’hyperkaliémie et d’insuffisance rénale aiguë malgré une diminution de la protéinurie [11].
Traiter les complications de l’IRC: Lors d’un eGFR <30 ml/min/1,73 m2 (ou <45 ml/min en cas de déclin accéléré de la fonction rénale), un avis néphrologique est primordial. Le néphrologue, en étroite collaboration avec une diététicienne, contrôlera par des mesures diététiques et médicamenteuses, l’hyperkaliémie et l’acidose métabolique si présentes. Le bilan ferrique sera optimisé, et l’anémie corrigée avec de l’EPO, sans pour autant viser une hémoglobine normale.
Le taux d’hémoglobine a été revu à la baisse et se trouve actuellement à 100–110 g/dl. Le bilan phosphocalcique (calcium, phosphate, vitamine D, iPTH) est à contrôler dès que l’eGFR est <45 ml/min/1,73 m². L’hypervolémie nécessitera en général des doses élevées de diurétiques de l’anse, éventuellement en combinaison avec des thiazidiques. Les thiazidiques (surtout la métolazone) sont effectivement de plus en plus prescrits dans l’insuffisance rénale avancée, contrairement aux idées passées [12].
Préparer et choisir la méthode de l’épuration extra-rénale: En cas de progression de la néphropathie avec une GFR <10 ml/min/1,73 m², une épuration extra-rénale (par hémodialyse, dialyse péritonéale, ou transplantation rénale) s’impose. Comme pour toute autre maladie rénale, la transplantation rénale offre le meilleur pronostic vital, ainsi qu’une meilleure qualité de vie. Le néphrologue consacre une grande partie du temps de sa consultation à établir avec le patient le meilleur projet d’avenir. Il est important que ce sujet difficile soit abordé assez tôt (dès une eGFR entre 20–30 ml/min/1,73 m² en cas de déclin accéléré de la GFR), afin d’impliquer le patient au maximum dans cette décision, qui changera profondément sa vie.
Perspectives: De nos jours, la seule catégorie de médicaments avec des caractéristiques néphroprotecteurs sont les IRAS. Néanmoins, de nouvelles catégories de médicament, potentiellement capable de ralentir le déclin de la fonction rénale, sont en voie d’investigation. Nous citerons ici les inhibiteurs SGLT-2 pour les patients diabétiques, les antagonistes de l’endothéline comme nouvelle catégorie d’antihypertenseurs, et les dérivés synthétiques du triterpénoïde comme le bardoxolone, présentant des propriétés anti-inflammatoire et antioxydantes, ou encore les anti-fibrotiques. Nous nous attendons donc à ce que l’arsenal des médicaments néphroprotecteurs se renforce dans le futur.
Conclusion
En conclusion, l’IRC est un diagnostic dont la prévalence est en hausse de manière inquiétante. En absence de critères de gravité, une partie des patients peut être suivie au cabinet par le médecin généraliste. Le cas clinique mentionné ci-dessus en est un exemple. Son bilan pourra donc être complété par un examen urinaire, qui pourra mettre en évidence une microalbuminurie, mais pas d’hématurie. Il n’y a pas d’argument anamnestique pour un usage de substances hors ordonnance, ou maladie systémique sous-jacente. Vous exclurez aussi un effet «blouse blanche». Votre patient souffre d’une IRC stade G3 à A2, probablement causée par l’HTA. Vous introduirez des mesures de néphroprotection ainsi qu’un IRAS, et contrôlerez la fonction rénale deux semaines après l’introduction de l’IRAS, puis un à deux fois par année. En cas de déclin rapide, ou une eGFR <30 ml/min/1,73 m², vous référerez ce patient à un néphrologue. En dehors de ces critères, il ne faut pas hésiter à contacter un néphrologue en cas de doute pour demander un avis. Une bonne collaboration entre le médecin généraliste, le néphrologue et les autres spécialistes est nécessaire pour offrir aux patients le meilleur pronostic.
Remerciements: Dr méd. Melissa Schneider-Monod et Virginie Philippe, pour leur relecture attentive du manuscrit.
Dr méd. Menno Pruijm, PD
Bibliographie:
- National Kidney F.: K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. American journal of kidney diseases: the official journal of the National Kidney Foundation 2002; 39(2 Suppl 1): S1–266.
- Ponte B, et al.: Determinants and burden of chronic kidney disease in the population-based CoLaus study: a cross-sectional analysis. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association 2013; 28(9): 2329–2339.
- Astor BC, et al.: Lower estimated glomerular filtration rate and higher albuminuria are associated with mortality and end-stage renal disease. A collaborative meta-analysis of kidney disease population cohorts. Kidney international 2011; 79(12): 1331–1340.
- Shlipak MG, Day EC: Biomarkers for incident CKD: a new framework for interpreting the literature. Nature reviews Nephrology 2013; 9(8): 478–483.
- Black C, et al.: Early referral strategies for management of people with markers of renal disease: a systematic review of the evidence of clinical effectiveness, cost-effectiveness and economic analysis. Health technology assessment 2010; 14(21): 1–184.
- Smart NA, et al.: Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. The Cochrane database of systematic reviews 2014; 6: CD007333.
- Levin A, Stevens PE: Summary of KDIGO guideline: behind the scenes, need for guidance, and a framework for moving forward. Kidney Int 2013.
- Maki DD, et al.: Long-term effects of antihypertensive agents on proteinuria and renal function. Archives of internal medicine 1995; 155(10): 1073–1080.
- Wheeler DC, Becker GJ: Summary of KDIGO guideline. What do we really know about management of blood pressure in patients with chronic kidney disease? Kidney international 2013; 83(3): 377–383.
- Vakilzadeh N, et al.: New aspects of hypertension management in patients with chronic kidney disease. Revue medicale suisse 2014; 10(441): 1668–1672.
- Fried LF, et al.: Combined angiotensin inhibition for the treatment of diabetic nephropathy. The New England journal of medicine 2013; 369(20): 1892–1903.
- Agarwal R, Sinha AD: Thiazide diuretics in advanced chronic kidney disease. Journal of the American Society of Hypertension: JASH 2012; 6(5): 299–308.
CARDIOVASC 2015; 14(1): 4–8