Les années 2020 et 2021 ont apporté quelques nouveautés dans le domaine du cancer de la prostate métastatique. Ainsi, deux nouvelles molécules sont disponibles : le 177Lutetium-PSMA-617et l’inhibiteur de PARP Olaparib. Ce dernier est déjà autorisé en Suisse et le traitement par 177Lutetium-PSMA-617est accessible dans le cadre d’un programme d’utilisation compassionnelle. Pour les patients atteints d’un cancer de la prostate métastatique réfractaire à la castration, il existe donc de nouvelles options après l’échec du traitement de première ligne, ce qui augmente également l’importance du test génétique dans cette entité.
Les années 2020 et 2021 ont apporté quelques nouveautés dans le domaine du cancer de la prostate métastatique (mPCa). Lors de la réunion annuelle de la Société américaine d’oncologie (ASCO) de cette année, une étude sur le cancer de la prostate métastatique réfractaire à la castration (mCRPC) a été présentée en séance plénière (essai VISION sur le 177Lutetium-PSMA). De même, une étude (PROfound) sur l’olaparib, un inhibiteur de PARP, a été présentée au congrès de la Société européenne d’oncologie médicale(ESMO) 2020 et a déjà donné lieu à une autorisation de mise sur le marché. Cela représente un apport scientifique important pour cette entité tumorale. Les nouvelles connaissances et les options thérapeutiques qui en découlent permettent désormais à un grand nombre de patients de survivre longtemps malgré une maladie métastasée.
Malheureusement, comme cela a été rapporté dans diverses études menées dans le cadre d’un traitement hormono-sensible, tous les patients ne répondent pas jusqu’à deux ans au traitement systémique combiné par déprivation androgénique (ADT) plus agent ciblant les récepteurs androgènes (AR) [1– 4] ou ADT plus docétaxel [5]. On observe également des évolutions rapides avec une progression dès six mois. Pour ces patients, il est également nécessaire de développer des traitements puissants au stade du mCRPC. Ici, deux nouvelles thérapies ont été ajoutées à l’arsenal en 2020 et 2021. L’une d’entre elles, celle par l’olaparib, est déjà autorisée dans le setting mCRPC, chez des patients sélectionnés sur le plan moléculaire et mutés BRCA1/2, après échec d’un Novel Hormonal Agent (NHA) ou en complément d’une chimiothérapie à base de taxanes (CHT) (non obligatoire) [6,7].
Nouveautés Cancer de la prostate métastasé résistant à la castration (mCRPC)
1. ciblage PSMA – PSMA PET CT et lutétium-PSMA(177Lu-PSMA-617)
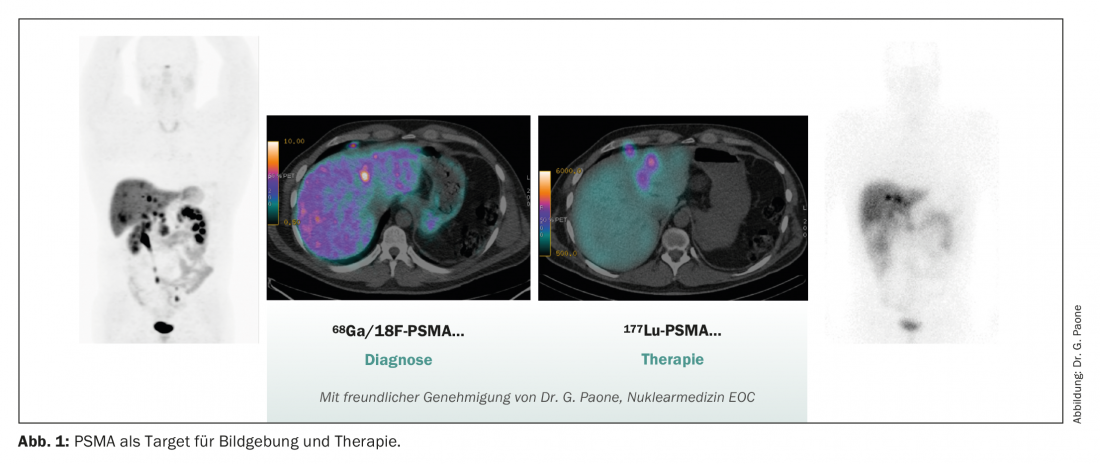
L’antigène membranaire spécifique de la prostate (PSMA) est une glycoprotéine liée à la membrane qui est fortement exprimée dans le mCRPC chez une proportion élevée de patients (jusqu’à 75%) [8]. Il a également été démontré que l’expression de la PSMA augmente au cours de l’évolution de l’hyperplasie bénigne de la prostate (HBP) vers le cancer invasif de la prostate et qu’elle est corrélée au score de Gleason et à l’agressivité de la maladie [9]. L’expression de la PSMA est fortement dépendante de la voie de signalisation AR et peut être régulée à la hausse par l’ADT et les agents modernes de ciblage AR comme l’enzalutamide [10,11]. Des protocoles d’essais cliniques correspondants étudient actuellement la combinaison d’un traitement ciblant le 177PSMAet d’agents de ciblage AR oraux (ENZA-p, NCT04419402).
L’imagerie PSMA PET-CT avec 66Ga-PSMAest aujourd’hui largement utilisée en Suisse et a donc été mise en œuvre et approuvée pour le staging des cancers de la prostate localisés à haut risque ou en récidive biochimique après un traitement local définitif et pour l’évaluation de l’éligibilité à un traitement par 177Lu-PSMA. Une nouveauté est l’application au cancer de la prostate localisé à haut risque. Dans ce cas, une étude de phase III a montré que le PSMA PET-CT présentait une sensibilité et une spécificité significativement plus élevées pour la positivité des ganglions lymphatiques et la détection des métastases à distance, par rapport au staging conventionnel par scanner ou scintigraphie osseuse. Dans l’étude, cela a eu un impact significatif sur la gestion du traitement.
Dans environ un quart des cas, on est passé d’un traitement potentiellement curatif à un traitement palliatif après la découverte de métastases à distance au PSMA PET-CT [12]. Des recherches sont en cours pour déterminer si ces connaissances supplémentaires, grâce au PSMA PET-CT, souvent avec upstaging, ont une influence sur la survie ou sont rentables.
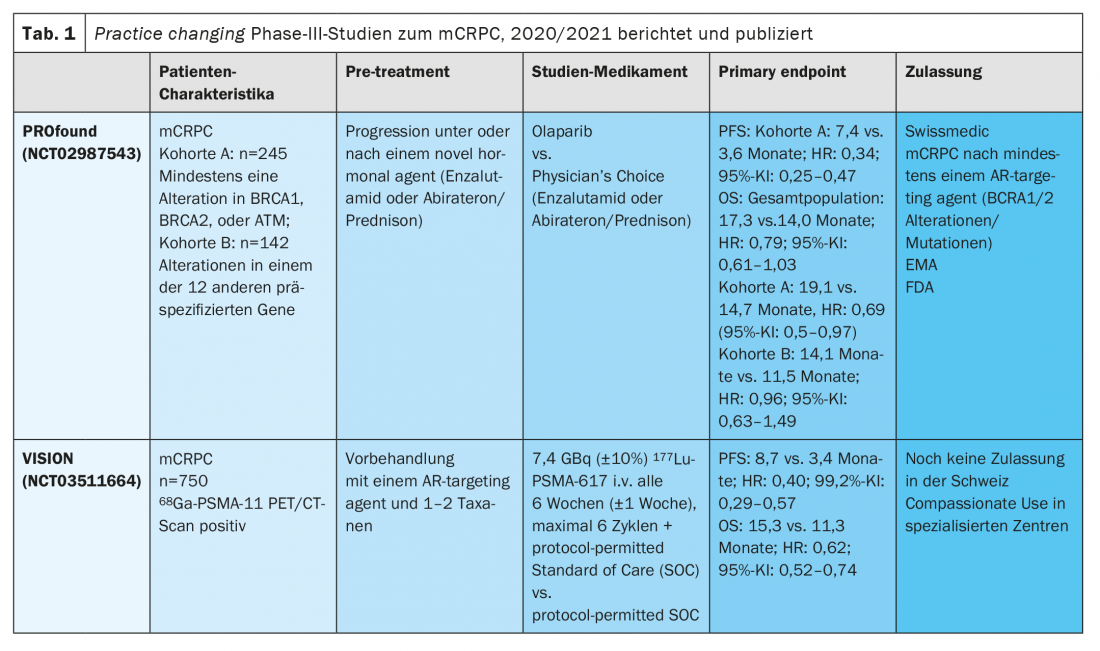
La PSMA joue un rôle de plus en plus important non seulement dans le diagnostic, mais aussi dans la thérapie. Avec les résultats positifs de la phase III de l’étude VISION sur le 177LutetiumPSMA-617, une autre option de traitement sera bientôt disponible pour les patients atteints de mCRPC prétraités [13]. L’étude a porté sur 831 patients atteints de mCRPC présentant des lésions positives au PSMA PET et prétraités par au moins un NHA (nouvel agent hormonal) et une ligne de chimiothérapie à base de taxane. Après randomisation, les patients ont reçu jusqu’à six cycles de 177Lu-PSMA-617en perfusion toutes les six semaines avec un traitement standard autorisé par le protocole (SOC) par rapport au SOC seul (composé principalement de glucocorticostéroïdes ou d’un second NHA, le cabazitaxel, le radium-223 ou les médicaments expérimentaux n’étant pas autorisés). L’étude a atteint son critère principal de survie globale (SG) avec une SG médiane de 15,3 mois contre 11,3 mois (HR 0,62, IC à 95% : 0,52 à 0,74 ; p<0,001). Les effets secondaires > Grade 3 ont été observés chez 52,7% des patients. Les cas les plus fréquents étaient la thrombocytopénie (8% de grade 3) et l’anémie (13% de grade 3). En général, les effets indésirables des médicaments ont été bien gérés, de sorte que la qualité de vie n’a généralement pas été affectée.
En Suisse, il existe quelques centres sélectionnés, dont notre service de médecine nucléaire à Bellinzone, qui ont la possibilité depuis un an de proposer aux patients le traitement par 177LutetiumPSMA-617 dans le cadre d’un programme d’utilisation compassionnelle. Cela nous a déjà permis d’acquérir une bonne expertise dans la pratique clinique quotidienne. Il faut encore attendre les autorisations réglementaires de Swissmedic en Suisse et de l’EMA dans l’UE. C’est pourquoi le traitement personnalisé, réservé aux patients présentant des métastases exprimant fortement le PSMA, est actuellement considéré comme la nouvelle norme de traitement des patients atteints de mCRPC prétraités.
Selon les premiers résultats de l’étude, l’intensité de l’expression de la PSMA devrait avoir une valeur pronostique pour la réponse au traitement par le 177LutetiumPSMA-617. Une faible expression moyenne de la PSMA s’est avérée défavorable à la réponse, mais il n’existe pas encore de définition précise du seuil de SUV. [14]Dans l’étude TheraP de phase II, les participants devaient également subir une TEP au FDG dans le cadre du dépistage, afin de détecter les lésions discordantes qui enregistrent le FDG et les lésions négatives au PSMA PET, qui excluent la participation à l’étude. [15]. Dans l’étude Vision Trial, environ 20% des patients ont été exclus du traitement en raison de lésions ne stockant pas suffisamment de données au PET PSMA-CT. En clinique, les patients doivent être bien sélectionnés, car les personnes atteintes d’une maladie très avancée (superscanner de la scintigraphie osseuse ou métastases hépatiques étendues) et ayant une faible réserve de moelle osseuse ne bénéficient pas du traitement par le 177LutetiumPSMA-617, qui est pourtant très complexe et coûteux.
2. inhibiteurs de la poly-ADP ribose polymérase (PARP) chez des patients mCRPC sélectionnés présentant des défauts de gènes de réparation homologues (HRD) somatiques ou génomiques – focalisation sur les gènes du cancer du sein (BRCA) 1 et 2
Les inhibiteurs de la PARP font partie intégrante du paysage thérapeutique de certaines tumeurs solides, comme le cancer de l’ovaire ou le cancer du sein. En raison de son utilisation répandue, il est possible d’acquérir depuis longtemps de l’expérience en matière de profil d’effets secondaires et d’efficacité. Des modifications dans les gènes de réparation de l’ADN tels que BRCA1 et BRCA2 sont également présentes chez un nombre significatif de patients atteints de cancer de la prostate et servent de cible.
La littérature a récemment rapporté que les mutations somatiques BRACA1 sont présentes dans environ 9% du mCRPC et que les mutations somatiques BRCA2 sont présentes dans environ 2% [16]. Les mutations germinales sont plus fréquentes chez les patients atteints de PCa avancée (11,8%) que dans la population générale de PCa [17]. C’est pourquoi les lignes directrices actuelles recommandent une recherche précoce d’altérations ou de mutations des gènes de réparation de l’ADN (au moins BRCA1/2) dans le tissu tumoral – et donc un dépistage somatique. Un tel traitement devrait être effectué au plus tard au début du stade réfractaire à la castration, car à partir de ce moment, un traitement par l’inhibiteur de la PARP, l’olaparib, est désormais autorisé par Swissmedic. Des autorisations de l’EMA et de la FDA sont également disponibles, à condition qu’une mutation BRCA1 ou 2 puisse être détectée.

L’autorisation de mise sur le marché de l’olaparib en Suisse a été accordée au début de cette année sur la base des résultats de l’étude randomisée PROfound de phase III. Dans cette étude randomisée et contrôlée, les patients atteints de mCRPC ont reçu soit un traitement par olaparib, soit un traitement du choix de l’investigateur (enzalutamide ou abiratérone/prednisone).
L’étude a atteint son critère principal de survie sans progression (PFS) et son critère secondaire principal de survie sans progression (OS) chez les patients présentant des défauts dans 15 gènes HRR prédéfinis [6,7]. L’étude PROfound a été conçue avec deux cohortes dans le bras olaparib, la cohorte A comprenant des patients présentant les défauts les plus courants dans les gènes de réparation de l’ADN tels que BRCA1 et 2 et ATM, et la cohorte B comprenant des personnes atteintes de défauts de réparation de l’ADN dans 12 autres gènes précédemment spécifiés. Après progression radiologique dans le bras contrôle, un crossover vers l’olaparib a été autorisé. Si l’étude s’est révélée positive pour tous les critères d’évaluation dans la cohorte A (OS médiane de 19,1 vs 14,7 mois ; HR : 0,69 (IC à 95% : 0,5-0,97), l’analyse génétique exploratoire n’a montré un bénéfice significatif que chez les patientes présentant des mutations ou des modifications de BRCA1/2 (HR 0,63, IC à 95% : 0,42 – 0,95). Le hazard ratio (HR) pour l’olaparib en cas de mutations ATM était de 0,93 (IC à 95% : 0,53-1,75). Il en résulte que le bénéfice est faible en présence d’une mutation ATM. En fin de compte, ces résultats ont conduit à l’approbation réglementaire de l’olaparib uniquement pour les patients atteints de mCRPC avec des mutations BRCA1/2 et au moins un traitement préalable avec un agent de ciblage AR. Le profil de toxicité était conforme aux rapports précédents.
Messages Take-Home
- Grâce au 177Lutetium-PSMA-617et à l’inhibiteur de PARP Olaparib, deux nouvelles substances actives sont disponibles pour le traitement du carcinome de la prostate métastatique réfractaire à la castration.
- Il n’existe pas encore d’autorisation de mise sur le marché pour le traitement par 177Lutetium-PSMA.
- en Suisse, mais elle est accessible dans le cadre d’un programme d’utilisation compassionnelle dans des centres spécialisés. Le traitement du carcinome de la prostate métastatique réfractaire à la castration par l’olaparib est possible depuis 2020 après autorisation.
- Le traitement par 177Lutetium-PSMAest utilisé après l’échec d’un agent de ciblage AR et d’un taxane (docetaxel). La séquence thérapeutique idéale avec le cabazitaxel (un standard établi après l’échec du docétaxel) n’est pas encore claire à l’heure actuelle et doit être évaluée individuellement.
- L’inhibiteur de la PARP, l’olaparib, est autorisé pour le traitement du cancer de la prostate métastatique réfractaire à la castration et porteur d’une mutation BRCA1/2, après un traitement préalable par au moins un agent hormonal novateur. La recherche de mutations somatiques et/ou germliniques des gènes de réparation de l’ADN est indiquée dans le mCRPC au plus tard au moment où le patient serait éligible pour un traitement par olaparib.
Littérature :
- Fizazi K, et al. : Abiraterone plus prednisone dans le cancer de la prostate métastatique et sensible à la castration. New England Journal of Medicine. 2017 ; 377 : 352-360.
- Chi KN, et al. : TITAN : Un essai de phase 3 randomisé, en double aveugle, contrôlé par placebo, d’apalutamide (ARN-509) plus traitement par privation d’androgènes (ADT) dans le cancer de la prostate hormono-sensible métastatique (mHSPC). Annales d’oncologie. 2016 ; 27 : vi265.
- Davis ID, et al : Enzalutamide avec le traitement standard de première ligne dans le cancer métastatique de la prostate. New England Journal of Medicine. 2019 ; 381 : 121-131.
- James ND, et al : Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. New England Journal of Medicine. 2017 ; 377 : 338-351.
- Sweeney CJ, et al : Traitement chimio-hormonal dans le cancer de la prostate métastatique hormono-sensible. New England Journal of Medicine. 2015 ; 373 : 737-746.
- de Bono J, et al : Olaparib pour le cancer de la prostate métastatique résistant à la castration. New England Journal of Medicine. 2020 ; 382 : 2091-2102.
- Hussain M, et al : Survival with Olaparib in Metastatic Castration-Resistant Prostate Cancer. New England Journal of Medicine. 2020 ; 383 : 2345-2357.
- Vlachostergios PJ, et al : Prostate-Specific Membrane Antigen Uptake and Survival in Metastatic Castration-Resistant Prostate Cancer. Frontiers in Oncology. 2021 ; 11.
- Sweat SD, et al : L’expression de l’antigène de la membrane spécifique de la prostate est la plus importante dans l’adénocarcinome de la prostate et les métastases des ganglions lymphatiques. Urologie. 1998 ; 52 : 637-640.
- Wright GL, et al : Upregulation of prostate-specific membrane antigen after androgen-deprivation therapy. Urologie. 1996 ; 48 : 326-34.
- Rosar F, et al. : New insights in the paradigm of upregulation of tumoral PSMA expression by androgen receptor blocking : Enzalutamide induces PSMA upregulation in castration-resistant prostate cancer even in patients having previously progressed on enzalutamide. Eur J Nucl Med Mol Imaging. 2020 ; 47 : 687-694.
- Hofman MS, et al : Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA) : a prospective, randomised, multicentre study. The Lancet. 2020 ; 395 : 1208-1216.
- Sartor O, et al : Lutetium-177-PSMA-617 pour le cancer de la prostate métastatique résistant à la castration. New England Journal of Medicine. 2021. doi : 10.1056/NEJMoa2107322. Epub ahead of print.
- Seifert R, et al : Analyse de l’expression et des résultats de la PSMA chez des patients atteints de cancer de la prostate avancé et recevant un traitement par 177Lu-PSMA-617 Radioligand. Théranostique. 2020 ; 10 : 7812-7820.
- Hofman MS, et al. : 177Lu-PSMA-617 versus cabazitaxel chez les patients atteints de cancer de la prostate métastatique résistant à la castration (TheraP) : un essai randomisé de phase 2, en ouvert. The Lancet. 2021 ; 397 : 797-804.
- Mahal BA, et al : Différences raciales dans le profilage génomique du cancer de la prostate. New England Journal of Medicine. 2020 ; 383 : 1083-1085.
- Pritchard CC, et al : Inherited DNA-Repair Gene Mutations in Men with Metastatic Prostate Cancer. N Engl J Med. 2016 ; 375 : 443-453.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(4) : 6-9