Des facteurs tels que le traitement antérieur, l’âge, les capacités et les comorbidités du patient déterminent le traitement de la récidive du myélome multiple. Les combinaisons triples avec un inhibiteur de protéasome et/ou un IMID sont la norme. Les traitements par anticorps occupent également une place importante dans le traitement du myélome.
Chez les patients en bonne santé atteints d’un myélome multiple nouvellement diagnostiqué, un traitement d’induction suivi d’une chimiothérapie de consolidation à haute dose avec autogreffe de cellules souches (ASZT) est effectué. Afin d’obtenir un bon contrôle de la maladie sur une période aussi longue que possible, un traitement de consolidation et/ou un traitement d’entretien sont associés. L’objectif thérapeutique est une rémission complète, si possible moléculaire. Chez les patients âgés et/ou en mauvaise santé, la priorité est d’obtenir la meilleure réponse possible au traitement de première ligne, avec peu d’effets secondaires et en préservant la qualité de vie.
Presque tous les patients subissent une récidive par la suite. Dans cette situation, les combinaisons lénalidomide/dexaméthasone (RD) ou bortézomib/dexaméthasone (VD) ont longtemps été les traitements de référence [1–3]. Cependant, ces deux substances sont aujourd’hui largement utilisées en première ligne de traitement, ce qui augmente le nombre de patients réfractaires à ces médicaments. Depuis quelques années, de nombreux nouveaux médicaments sont disponibles pour ces patients. Le choix du traitement tient compte des traitements antérieurs (changement de classe de substances, réponse, tolérance), de l’âge, des performances, des comorbidités et, bien entendu, de l’autorisation de mise sur le marché en Suisse. Chez les patients en bonne santé avec une période sans progression d’au moins douze mois après une première TCSA, une deuxième TCSA devrait être envisagée, car les résultats après TCSA de sauvetage chez ces patients sont équivalents ou supérieurs à ceux des combinaisons de trois traitements les plus efficaces, pour une durée de traitement plus courte et un coût total moyen plus faible (tableau 1) [4,5].
Première récidive après un traitement à base de bortézomib
Après un traitement de première ligne à base de bortézomib, un traitement par lénalidomide/dexaméthasone était proposé aux patients jusqu’à il y a quelques années [1,2]. Aujourd’hui, en deuxième ligne, en cas de meilleure survie sans progression (PFS), une triple association devrait être mise en avant.
L’association de la RD à l’anticorps monoclonal SLAMF7 (“signaling lymphocytic activation molecule F7”) élotuzumab a montré une PFS médiane de 19,4 mois (contre 14,9 mois sous RD) dans l’étude ELOQUENT-2. 646 patients avec une médiane de deux traitements antérieurs ont été inclus. Le traitement par ERD a été poursuivi jusqu’à progression ou effets secondaires inacceptables. Le “taux de réponse global” (ORR) sous ERD était de 79% (vs. 66%). Le délai avant le prochain traitement (“time to next treatment”, TTNT) a été prolongé d’un an (33 vs. 21 mois), la survie médiane dans le groupe ERD était de 43,7 mois (vs. 39,6 mois). Les effets secondaires de grade 3 ou 4 les plus fréquents étaient des effets secondaires hématologiques (neutropénie 34% vs. 44% et lymphopénie 77% vs. 49%). Les avantages cliniques s’accompagnaient d’infections plus fréquentes (88% vs 74%), en particulier l’herpès zoster [6,7]. En Suisse, l’association d’elotuzumab avec le lénalidomide et la dexaméthasone (ERD) est autorisée à partir de la deuxième ligne de traitement.
Une autre trithérapie autorisée à partir de la deuxième ligne de traitement est l’association de lénalidomide/dexaméthasone avec le carfilzomib, un inhibiteur du protéasome de deuxième génération. Dans l’étude ASPIRE, cette combinaison a montré une prolongation de la PFS médiane de 8,7 mois (26,3 vs 17,6 mois) chez 792 patients par rapport à la RD seule. Le carfilzomib avec RD (KRD) a été administré pendant un maximum de 18 cycles, RD jusqu’à la progression. L’ORR a atteint le chiffre impressionnant de 87,1% (vs 66,7%), avec un taux de RC pour la RC de 31,8% (vs 9,3% dans le groupe RD). La survie à 2 ans dans le groupe KRD était de 73,3% (vs. 65%). Le carfilzomib est administré dans cette combinaison jusqu’à un maximum de 27 mg/m2 deux fois par semaine. Le taux d’effets secondaires, y compris en ce qui concerne la neuropathie, est comparable. Les problèmes cardiaques sous carfilzomib étaient d’un intérêt particulier : dyspnée (2,8% vs 1,8%), insuffisance cardiaque (3,8% vs 1,8%), cardiopathie ischémique (3,3% vs 2,1%), hypertension (4,3% vs.1,8%) et insuffisance rénale aiguë (3,3% vs. 3,1%) [8].
Première récidive après un traitement basé sur IMID
Après un traitement de première ligne basé sur l’IMID, un traitement contenant un inhibiteur de protéasome est recommandé en deuxième ligne. Pour cela, on utilise traditionnellement l’association bortézomib/dexaméthasone (VD) [3]. Dans l’étude ENDEAVOR, l’association du carfilzomib et de la dexaméthasone (KD) s’est révélée plus efficace. La PFS médiane était significativement plus longue par rapport à la VD, avec 18,7 mois contre 9,4 mois. 54% des 929 patients de cette étude étaient prétraités par le bortézomib, même s’ils n’étaient pas réfractaires. Chez ces patients également, la PFS était plus longue grâce au KD, avec 15,6 mois contre 8,1 mois. Le carfilzomib a été administré à la dose de 56 mg/m2 deux fois par semaine. Les effets secondaires les plus fréquents à cette dose comprenaient l’anémie (14% vs. 10%), l’hypertension (9% vs. 3%), la thrombocytopénie (8% vs. 9%) et la pneumonie (7% vs. 8%), alors que l’apparition de polyneuropathies de grade 2 ou plus était significativement moins fréquente sous carfilzomib (6% vs. 32%) [9]. A ce dosage, le carfilzomib n’est pas autorisé en Suisse.
La norme en cas de première récidive devrait être, si possible, une triple combinaison. Une combinaison plutôt favorable est celle du bortézomib/dexaméthasone en association avec le cyclophosphamide (VCD ou CyBorD). Cependant, ce traitement n’est autorisé en Suisse que dans le cadre d’un traitement d’induction avant une ASZT planifiée. En revanche, le schéma KRD, nettement plus coûteux, est autorisé à partir de la deuxième ligne de traitement.
Traitement d’autres récidives
A partir de la troisième ligne de traitement (après échec du bortézomib et du lénalidomide), l’association de pomalidomide et de dexaméthasone (Pom/D) est autorisée en Suisse [10]. En raison de son coût élevé, la posologie autorisée (4 mg/j) a récemment été remise en question au profit d’un schéma alterné (4 mg un jour sur deux), ce qui est potentiellement important en termes d’économie de la santé [11]. Comme pour le carfilzomib, les questions relatives au dosage optimal dans le traitement du myélome ne sont pas résolues de manière satisfaisante dans la précipitation du lancement du produit.
Un autre médicament autorisé à partir de la troisième ligne est le panobinostat, un inhibiteur de l’histone déacétylase, en combinaison avec la VD. Dans l’étude PANORAMA-1, 768 patients fortement prétraités ont reçu respectivement du panobinostat/VD et du panobinostat/VD. placebo/VD. Le panobinostat est administré par voie perorale trois jours par semaine aux semaines 1 et 2, dans un cycle de 21 jours, en plus de la VD. Une amélioration de la PFS médiane de près de quatre mois (12 vs. 8 mois) a été observée, avec une survie globale identique. Le TRO sous panobinostat/VD était de 60,7%, une réponse complète a été obtenue chez 11% des patients et une très bonne réponse partielle chez 17%. Les effets secondaires non hématologiques les plus fréquents ont été la diarrhée (68% vs 42%), l’asthénie ou la fatigue (57% vs 41%) et la neuropathie périphérique (61% vs 67%). Des effets secondaires hématologiques significatifs ont également été plus fréquents sous panobinostat [12].
L’ixazomib, premier inhibiteur de protéasome disponible par voie perorale, est autorisé en Suisse en association avec le lénalidomide et la dexaméthasone à partir de la troisième ligne de traitement (ou de la deuxième ligne de traitement en présence de caractéristiques à haut risque). L’étude TOURMALINE-MM1 a comparé l’ixazomib en association avec la RD à un placebo/RD. La PFS médiane était significativement plus longue dans le groupe ixazomib (20,6 vs. 14,7 mois). La tolérance hématologique des deux traitements était comparable. Une neuropathie périphérique est apparue chez 27% des patients sous ixazomib (vs 22%) [13]. En tant que traitement entièrement per os, cette combinaison est sans aucun doute bénéfique pour le patient.
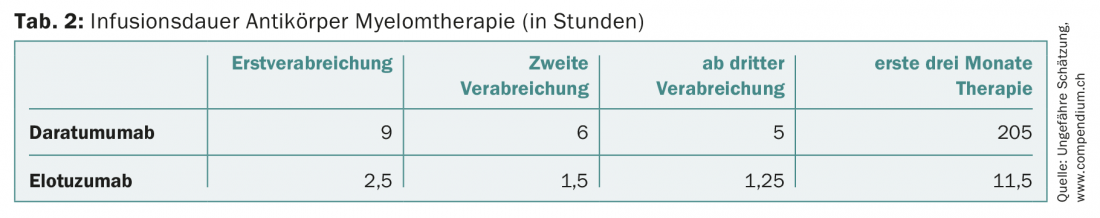
Chez les patients réfractaires à au moins un inhibiteur du protéasome et à un agent immunomodulateur, ou ayant reçu au moins trois traitements antérieurs, il est également possible d’administrer en Suisse l’anticorps monoclonal CD38 daratumumab. En monothérapie, le daratumumab présente des taux de réponse d’environ 30% [14]. L’anticorps, qui doit être administré initialement chaque semaine, représente un défi pour les services ambulatoires d’oncologie en raison de la longue durée de perfusion de neuf heures lors de la première administration (et toujours au moins cinq heures à partir de la troisième administration) en cas d’utilisation plus large. De plus, le daratumumab est désormais autorisé en deuxième ligne, en association avec la dexaméthasone et le bortézomib ou le lénalidomide.
Autres options thérapeutiques
La littérature, qui s’étoffe rapidement, fait état d’un certain nombre d’autres schémas thérapeutiques pour le traitement du myélome multiple récidivant.
Dans l’étude CASTOR, 498 patients avec une médiane de deux traitements antérieurs ont été randomisés pour recevoir daratumumab/VD (Dara/VD) ou VD seul. Dans les deux bras de traitement, VD a été arrêté après huit cycles chacun, le daratumumab pouvant être poursuivi jusqu’à la progression. Après un suivi médian de 7,4 mois, une PFS significativement plus longue a été observée dans le groupe daratumumab. Le TRO était nettement plus élevé dans le bras daratumumab (82,9% vs 63,2%) et, en particulier, les taux de très bonnes rémissions partielles ou meilleures étaient presque doublés (59,2% vs 29,1%) [15].
Dans l’étude POLLUX, 569 patients prétraités par au moins un traitement ont reçu la RD ou l’association avec le daratumumab. Après un suivi médian de 13,5 mois, l’analyse intérimaire a montré une PFS prolongée dans le groupe expérimental (non atteinte vs 18,4 mois). Le TRO était également plus élevé dans le bras daratumumab (92,9% vs 76,4%), tout comme le taux de rémission complète (43,1% vs 19,2%) [16]. Les principaux problèmes liés à l’utilisation de cet anticorps sont les réactions à la perfusion et les thrombopénies.
Il existe également des données sur les combinaisons de Pom/D avec une troisième substance pour le myélome récidivant, par exemple en association avec 400 mg hebdomadaires de cyclophosphamide per os (PomCyDex) ou de bortézomib (PVD) [17,18]. Les deux études ont inclus des patients atteints de myélome réfractaire au lénalidomide. Une monothérapie par bendamustine peut également être utilisée, en particulier chez les patients insuffisants rénaux ou sous dialyse [19]. Ce dernier n’est pas autorisé en Suisse dans cette indication.
Le Groupe Suisse de Recherche Clinique sur le Cancer (SAKK) a évalué dans deux études innovantes de phase II l’association du nelfinavir avec le VD et le VD-30, respectivement. RD examiné. Cette décision a été prise sur la base d’observations selon lesquelles ce médicament contre le VIH pouvait restaurer la sensibilité aux deux médicaments contre le myélome. Dans l’étude SAKK 39/13, un ORR prometteur de 65% a été atteint dans une population très fortement prétraitée et souvent réfractaire au bortézomib et au lénalidomide [20]. D’autres études du SAKK portant sur des combinaisons de nelfinavir sont en cours de planification.
Perspectives
Les données actuelles sur les inhibiteurs de points de contrôle dans le myélome multiple sont peu prometteuses. En revanche, après l’approbation par la FDA du traitement par cellules CAR-T pour les jeunes patients atteints de LAL récidivante ou réfractaire, cette option thérapeutique est devenue le centre d’intérêt des patients atteints de myélome également. Les données des premières études cliniques menées chez des patients atteints de myélome et utilisant des cellules T BCMA-CAR (“B-cell maturation antigen”), avec des taux de rémission de l’ordre de 100%, constituent la base de cette approche [21–23].
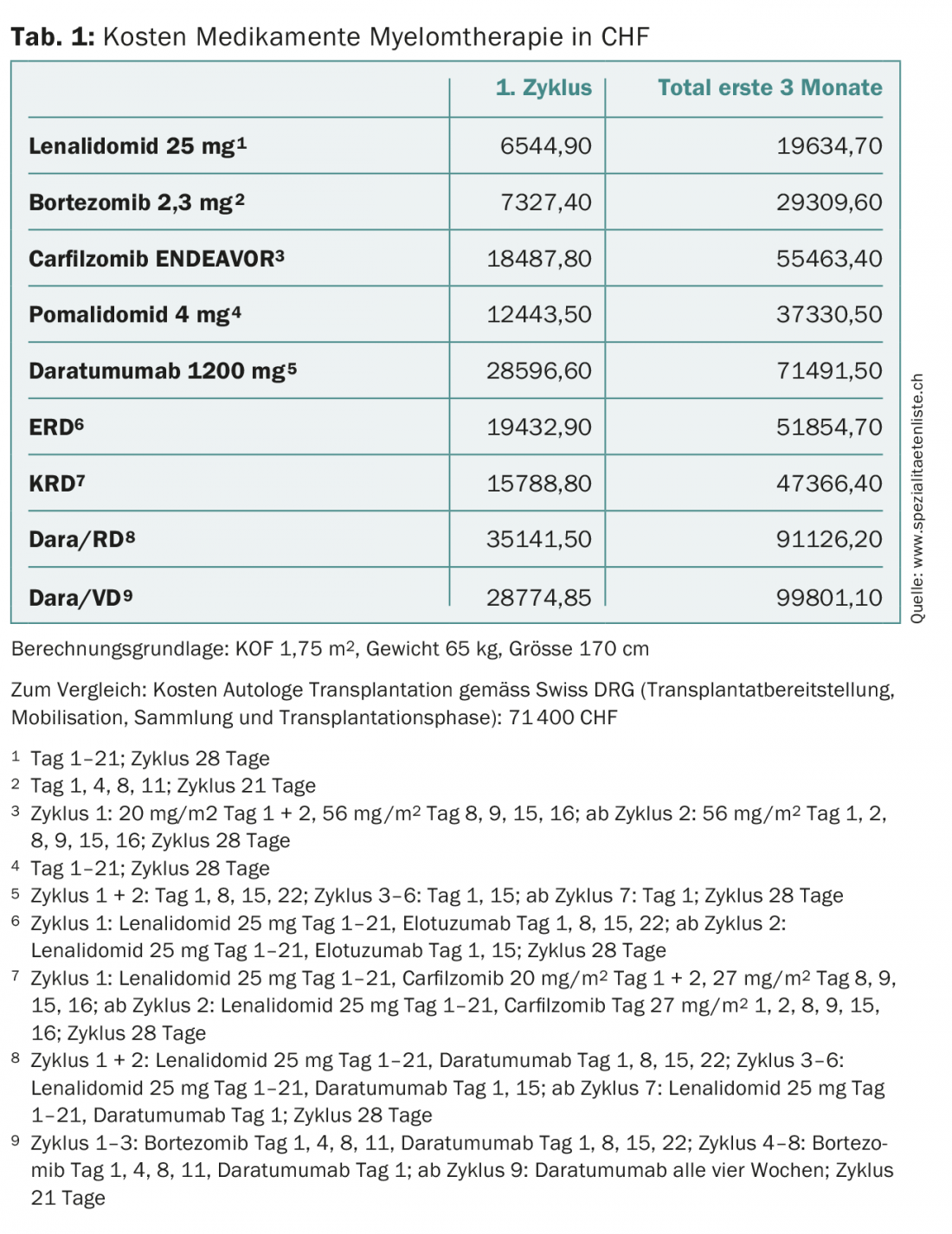
Des progrès sans précédent ont été réalisés dans le traitement du myélome. Alors que la durée de survie moyenne était de deux à trois ans il y a 15 ans, un peu plus de 40% des patients atteints de myélome vivent aujourd’hui dix ans ou plus. Toutefois, cette amélioration s’est également répercutée sur les coûts des traitements (tableau 1). Ces derniers devraient être pris en compte par les différents acteurs de la santé, d’autant plus que les nouveaux médicaments très coûteux vont se retrouver en première ligne. Pour reprendre l’exemple du daratumumab, la longue durée de la perfusion augmentera la pression sur l’organisation, l’infrastructure et le personnel des services d’oncologie ambulatoire et des cabinets médicaux (tableau 2). L’administration sous-cutanée de cet anticorps permettrait d’atténuer le problème [24].
Outre son efficacité, le traitement des maladies non curables devrait en premier lieu améliorer la qualité de vie. Pour les nouveaux médicaments, ces données font encore défaut ou la qualité de vie n’était qu’un critère secondaire [25].
En résumé, les patients atteints de myélome disposent aujourd’hui d’une multitude de nouvelles options de traitement. Dans la mesure du possible, les patients doivent être inclus dans des études (par ex. du SAKK). Il serait souhaitable que les protocoles étudient de plus en plus les séquences thérapeutiques et la qualité de vie.
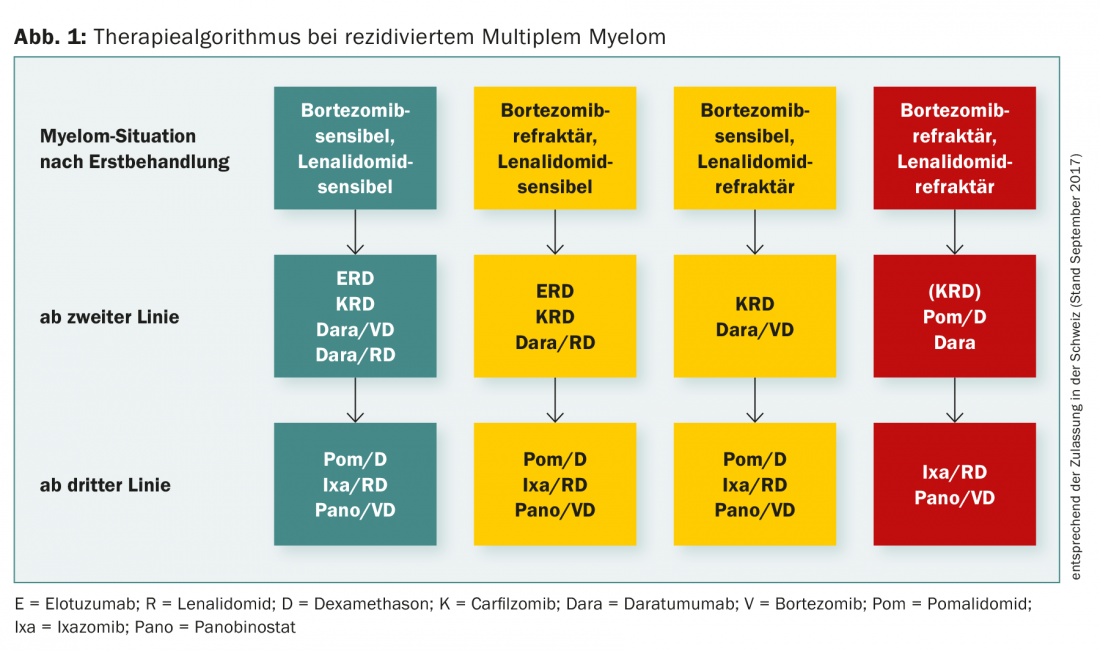
La figure 1 résume l’algorithme de traitement du myélome multiple récidivant.
Messages Take-Home
- Le choix du traitement de la récidive dépend des traitements antérieurs (classe de substances, réponse et tolérance), de l’âge, des capacités et des comorbidités des patients ainsi que de l’autorisation de mise sur le marché des médicaments.
- La norme dans le traitement des récidives est, selon le traitement antérieur, une combinaison de trois médicaments avec un inhibiteur de protéasome et/ou un IMID.
- Les traitements par anticorps occupent une place importante dans le traitement du myélome.
- Les patients atteints de myélome devraient toujours, dans la mesure du possible, être traités dans le cadre de protocoles (par exemple, le SAKK).
- La thérapie par cellules CAR-T pourrait devenir une option prometteuse dans le myélome.
Littérature :
- Weber DM, et al : Lenalidomide plus dexamethasone pour le myélome multiple en rechute en Amérique du Nord. N Engl J Med 2007 ; 357(21) : 2133-2142.
- Dimopoulos M, et al : Lenalidomide plus dexamethasone pour les myélomes multiples en rechute ou réfractaires. N Engl J Med 2007 ; 357(21) : 2123-2132.
- Richardson PG, et al : Bortezomib ou dexaméthasone à haute dose pour le myélome multiple en rechute. N Engl J Med 2005 ; 352(24) : 2487-2498.
- Grovdal M, et al : Transplantation de cellules souches autologues versus nouveaux médicaments ou chimiothérapie conventionnelle pour les patients atteints de myélome multiple en rechute après une ASCT antérieure. Bone Marrow Transplant 2015 ; 50(6) : 808-812.
- Giralt S, et al : American Society of Blood and Marrow Transplantation, European Society of Blood and Marrow Transplantation, Blood and Marrow Transplant Clinical Trials Network, and International Myeloma Working Group Consensus Conference on Salvage Hematopoietic Cell Transplantation in Patients with Relapsed Multiple Myeloma. Biol Blood Marrow Transplant 2015 ; 21(12) : 2039-2051.
- Dimopoulos MA, et al : Elotuzumab plus lénalidomide/dexaméthasone pour les myélomes multiples en rechute ou réfractaires : suivi ELOQUENT-2 et analyses post-hoc sur la survie sans progression et la croissance tumorale. Br J Haematol 2017 ; 178(6) : 896-905.
- Lonial S, et al : Elotuzumab Therapy for Relapsed or Refractory Multiple Myeloma. N Engl J Med 2015 ; 373(7) : 621-631.
- Stewart AK, et al : Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015 ; 372(2) : 142-152.
- Dimopoulos MA, et al : Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR) : a randomised, phase 3, open-label, multicentre study. Lancet Oncol 2016 ; 17(1) : 27-38.
- Dimopoulos MA, et al. : Sécurité et efficacité du pomalidomide plus dexaméthasone à faible dose dans STRATUS (MM-010) : une étude de phase 3b dans le myélome multiple réfractaire. Blood 2016 ; 128(4) : 497-503.
- Zander T, et al : Spotlight on pomalidomide : could less be more ? Leukemia 2017 ; 31(9) : 1987-1989.
- San-Miguel JF, et al : Panobinostat plus bortezomib et dexamethasone versus placebo plus bortezomib et dexamethasone chez les patients atteints de myélome multiple en rechute ou en rechute et réfractaire : un essai de phase 3 multicentrique, randomisé, en double aveugle. Lancet Oncol 2014 ; 15(11) : 1195-1206.
- Moreau P, et al : Ixazomib oral, lénalidomide, et dexaméthasone pour le myélome multiple. N Engl J Med 2016 ; 374(17) : 1621-1634.
- Usmani SZ, et al : Efficacité clinique de la monothérapie par daratumumab chez les patients atteints de myélome multiple relapsed ou refractory fortement préretraité. Blood 2016 ; 128(1) : 37-44.
- Palumbo A, et al : Daratumumab, Bortezomib, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016 ; 375(8) : 754-766.
- Dimopoulos MA, et al : Daratumumab, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016 ; 375(14) : 1319-1331.
- Baz RC, et al : Étude randomisée multicentrique de phase 2 sur le pomalidomide, le cyclophosphamide et la dexaméthasone dans le myélome réfractaire en rechute. Blood 2016 ; 127(21) : 2561-2568.
- Paludo J, et al : Pomalidomide, bortezomib, et dexamethasone pour les patients atteints de myélome multiple réfractaire au lénalidomide en rechute. Blood 2017 ; 130(10) : 1198-1204.
- Hoy SM : Bendamustine : a review of its use in the management of chronic lymphocytic leukaemia, rituximab-refractory indolent non-Hodgkin’s lymphoma and multiple myeloma. Drogues 2012 ; 72(14) : 1929-1950.
- Driessen C, et al : The HIV Protease Inhibitor Nelfinavir in Combination with Bortezomib and Dexamethasone (NVd) Has Excellent Activity in Patients with Advanced, Proteasome Inhibitor-Refractory Multiple Myeloma : A Multicenter Phase II Trial (SAKK 39/13). Blood 2016 ; 128 : Abstract 487.
- Ali SA, et al : Les cellules T exprimant un récepteur d’antigène chimérique de maturation des cellules B provoquent des rémissions de myélome multiple. Blood 2016 ; 128(13) : 1688-1700.
- Berdeja J, et al : First-in-human multicenter study of bb2121 anti-BCMA CAR T-cell therapy for relapsed/refractory multiple myeloma : Updated results. J Clin Oncol 2017 ; 35(15 suppl) : 3010.
- Fan F, et al : Rémissions durables avec des cellules T modifiées par des récepteurs d’antigènes chimériques (CAR) spécifiques de la BCMA chez des patients atteints de myélome multiple réfractaire/relaxé. J Clin Oncol 2017 ; 35(18 suppl) : 3001.
- Usmani S, et al : Open-Label, Multicenter, Dose Escalation Phase 1b Study to Assess the Subcutaneous Delivery of Daratumumab in Patients (pts) with Relapsed or Refractory Multiple Myeloma (PAVO). Blood 2016 ; 128 : Abstract 1149.
- Kvam AK, Waage A : Qualité de vie liée à la santé chez les patients atteints de myélome multiple – est-ce que cela compte ? Haematologica 2015 ; 100(6) : 704-705.
InFo ONKOLOGIE & HÄMATOLOGIE 2017 ; 5(5) : 16-20











