Un plus grand nombre de donneurs volontaires et un conditionnement moins intensif rendent aujourd’hui la transplantation de cellules souches allogéniques accessible à une plus grande population de patients. Les greffes de cellules souches autologues, quant à elles, stoppent également les maladies auto-immunes via un “redémarrage” du système immunitaire.
La transplantation de moelle osseuse allogénique a fêté ses 60 ans l’année dernière. A l’époque (1957), E. Donnall Thomas et ses collègues prélevaient des cellules de moelle osseuse sur les côtes de cadavres adultes ou fœtaux, les filtraient, les mettaient en suspension dans un milieu de culture, les congelaient à -80°C et les perfusaient ensuite à des patients irradiés. Chez une partie des patients, une croissance passagère des cellules du donneur a pu être démontrée, mais tous les patients sont décédés dans les 100 premiers jours suivant la transplantation. Bien que de nombreux progrès aient été réalisés depuis, la transplantation de cellules souches allogéniques (allo-SZT, par transfert de moelle osseuse, de sang périphérique mobilisé ou de sang de cordon ombilical) reste aujourd’hui encore un traitement complexe, intensif et riche en complications. Compte tenu des nouvelles substances ciblées et des immunothérapies, certains experts affirment que la TCS allo a dépassé son zénith et que, dans quelques années, elle ne sera plus nécessaire pour guérir de nombreuses maladies malignes du sang et du système lymphatique. Les chiffres réels ne le confirment pas – la tendance à l’augmentation annuelle du nombre de greffes de cellules souches allogéniques et autologues se poursuit [1]. L’objectif de cet article est d’illustrer, à l’aide d’exemples choisis, les développements de la transplantation de cellules souches au cours des dernières années et de se projeter dans l’avenir.
Choix du donneur et disponibilité
Les premières allogreffes de moelle osseuse ont eu lieu avant la découverte des antigènes leucocytaires humains (HLA). Dans les années 1960, les connaissances se limitaient essentiellement à des observations selon lesquelles le sang ou les leucocytes de certains patients réagissaient entre eux et qu’une “sensibilisation du système immunitaire” était possible. Dans les années 1970, R. Zinkernagel et P. Doherty ont découvert le principe fondamental de l’activation des cellules T par la présentation d’antigènes et la restriction HLA. Ce n’est qu’à la fin des années 1980 que la structure protéique du HLA a été représentée. Aujourd’hui, on connaît deux classes HLA, avec chacune 7678 allèles de classe I et 2268 allèles de classe II. Aujourd’hui, les allo-SZT sont réalisées en tenant compte des caractéristiques HLA, car on sait que les “mismatches” dans le HLA sont la cause la plus importante d’une réaction de rejet inversée (maladie du greffon contre l’hôte, GVHD). En outre, il est également connu – mais pas encore mis en œuvre en clinique – que le niveau d’expression de certaines variantes alléliques HLA disparates peut être associé à la gravité de la GVHD [2], et que certaines variantes alléliques disparates peuvent également influencer la probabilité de récidive de la maladie [3]. La prise en compte de ces “mismatches” permissifs (pour la GVHD ou les effets du greffon contre la leucémie, GVL) dans le choix des donneurs est tout à fait envisageable à l’avenir, compte tenu du nombre croissant de donneurs enregistrés. Actuellement, plus de 32 millions de donneurs de cellules souches sont enregistrés dans le monde (123 471 en Suisse au 12.08.2018 et >8 millions en Allemagne, www.wmda.info), ce qui signifie que malgré la diminution de la taille de la famille et du nombre de frères et sœurs, un donneur étranger HLA-identique peut être trouvé pour plus de 70% des patients d’origine caucasienne. Cependant, pour d’autres groupes ethniques, cette probabilité est nettement plus faible [4], et les personnes d’origine ethnique mixte ont généralement peu de chances de réussir à trouver un donneur étranger.
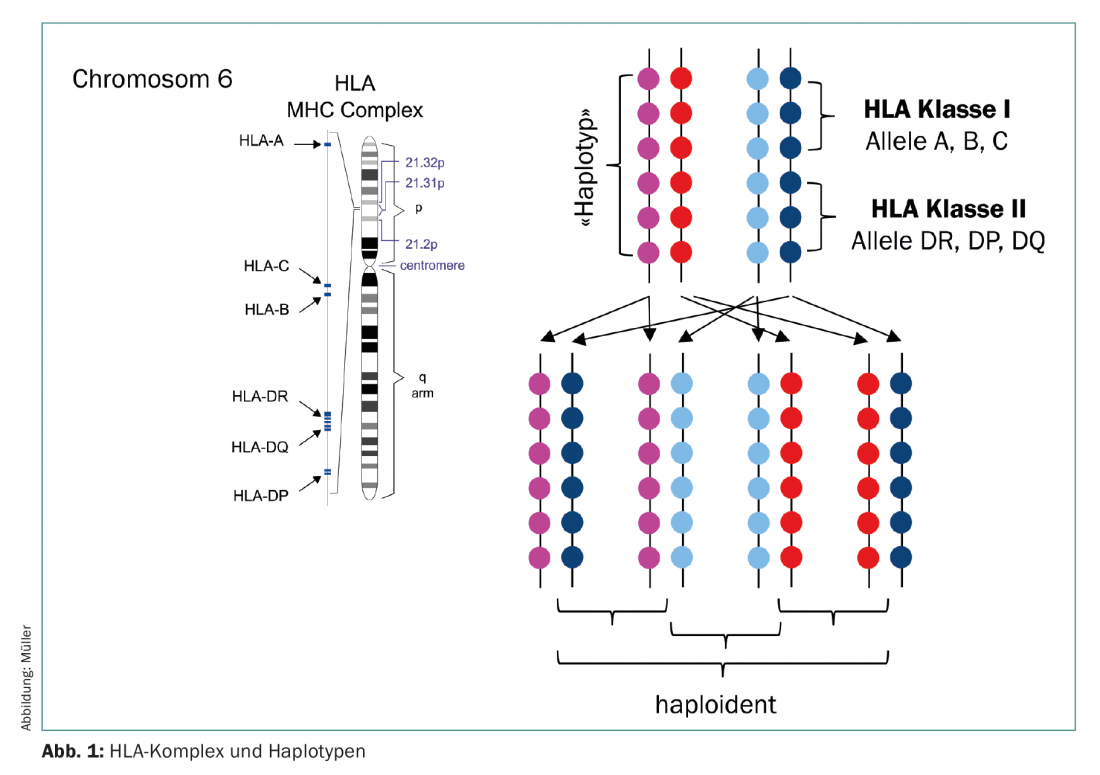
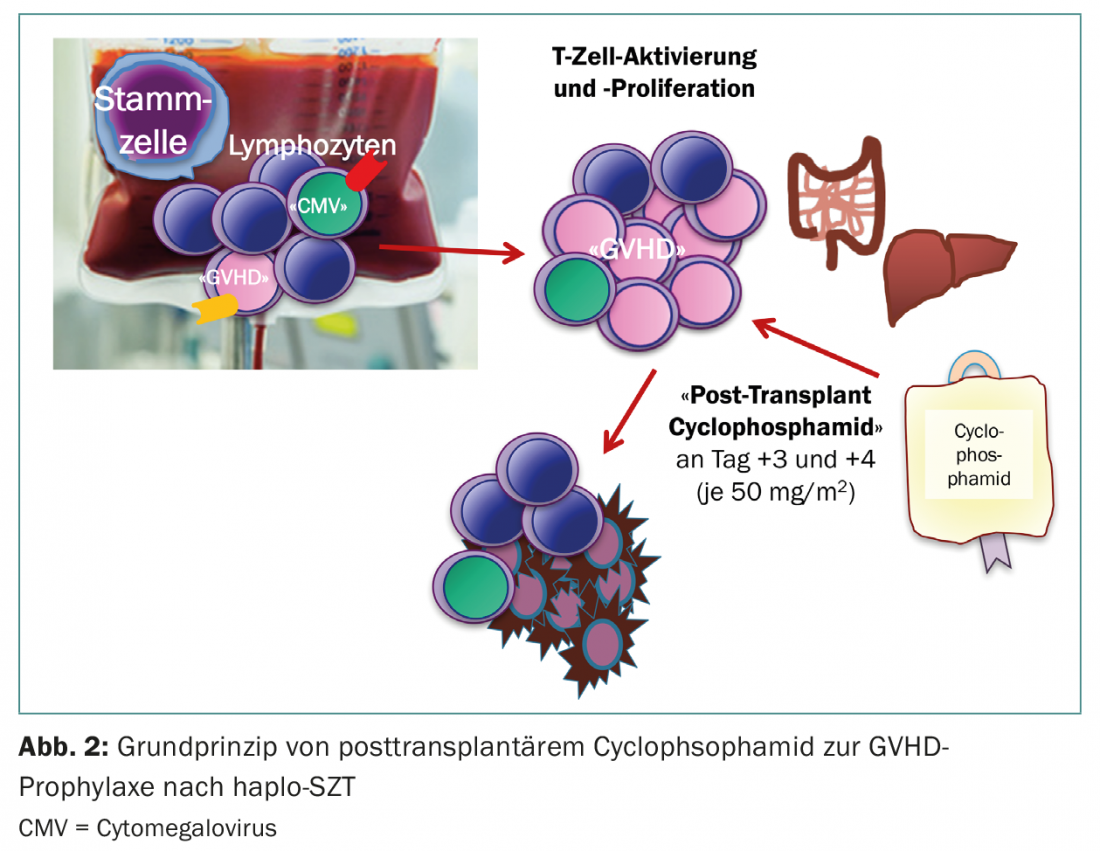
Les donneurs haploïdes (semi-appariés) constituent une source alternative de cellules souches ( Fig. 1). Jusqu’à il y a quelques années, les greffes haploïdes étaient utilisées avec autant de réticence que les cordons ombilicaux, car elles présentaient toutes deux un risque élevé de complications graves. Cependant, depuis 2012 environ, la TCS haplo gagne fortement en popularité, car une nouvelle manœuvre thérapeutique a fait son entrée dans la clinique. L’équipe d’E. Fuchs et de L. Luznik a mis au point un régime de conditionnement dans lequel la moelle osseuse non manipulée de donneurs haploïdes présentant un taux complet de cellules T est perfusée aux patients sans immunosuppression concomitante. Il est bien connu qu’une prolifération et une expansion massives des lymphocytes ont lieu dans les premiers jours suivant la transplantation en raison de la lymphopénie chez le receveur (expansion homéostatique). Dans ce cas, ce sont surtout les lymphocytes activés qui prolifèrent, c’est-à-dire les cellules qui ont trouvé leur antigène cible sur les tissus receveurs et qui entraîneraient par conséquent une GVHD aiguë. Dans cette hypothèse, de fortes doses de cyclophosphamide sont administrées les jours 3 et 4 après la SZT haplo, ce qui tue à son tour les lymphocytes en division. En revanche, les lymphocytes dormants sont épargnés, tout comme les cellules souches elles-mêmes, de sorte que la régénération hématopoïétique se déroule sans restriction (figure 2) [5,6]. Le succès de ce régime est désormais prouvé, à la fois dans les études et dans la pratique clinique quotidienne [7,8]. Comme les parents et les enfants sont certains, et que les frères et sœurs ont 50 % de chances d’être haploïdes, il est désormais possible d’identifier un donneur pour presque tous les patients, même ceux dont l’origine ethnique n’est pas suffisamment représentée dans le registre ou dans les pays où un don étranger coûteux ne peut pas être financé.
Conditionnement, effets secondaires et mortalité
Il y a moins de nouvelles dans le domaine des conditionnements et de leurs complications. Avec la prise de conscience que la transplantation allogénique est une immunothérapie et que ce n’est pas tant la chimiothérapie de conditionnement que l’alloréactivité des lymphocytes T dirigée contre les cellules malignes qui permet d’obtenir un contrôle immunologique à long terme de la maladie maligne de base, l’intensité de la chimiothérapie préparatoire a été réduite (“reduced-intensity conditioning”, RIC), ce qui a considérablement réduit sa toxicité et sa mortalité. De ce fait, la transplantation allogénique est aujourd’hui accessible aux patients âgés et à ceux souffrant de comorbidités. Cela se reflète clairement dans le nombre de transplantations, car les néoplasies myéloïdes, en particulier, sont des maladies de l’âge mûr. Les conditionnements RIC ont gagné une place fixe dans la clinique au cours des 10 à 15 dernières années et représentent aujourd’hui environ la moitié des TCS allogéniques. La question de savoir s’il y a plus de récidives après RIC qu’après un conditionnement myéloablatif (MAC) n’a pas encore été résolue pour toutes les entités pathologiques et reste un sujet de discussion permanent.
La globuline antithymocytaire (ATG), qui sert à la déplétion des cellules T in vivo pour la prophylaxie de la GVHD, est devenue un composant courant des régimes de conditionnement réduits et myéloablatifs. Plusieurs études ont montré que l’ATG pouvait réduire non seulement le taux de GVHD aiguë, mais aussi celui de GVHD chronique. Les expériences concernant la probabilité de récidive après une STS sont toutefois contradictoires, ce qui explique pourquoi l’ATG est utilisé avec plus de retenue aux États-Unis qu’en Europe.
L’utilisation de la moelle osseuse (MO) au lieu du sang périphérique mobilisé comme source de cellules souches est associée à une diminution de la GVHD chronique (mais pas aiguë) [9], ce qui est attribué à la teneur plus faible en cellules T de la moelle osseuse. Cependant, en raison de l’investissement nettement plus important pour le donneur et le centre de prélèvement, il semble actuellement peu probable que le nombre de greffes de KM au détriment des greffes de cellules souches du sang périphérique prenne de l’importance dans un avenir proche.
Dans le cas de la GVHD établie, deux “nouvelles” substances prometteuses sont actuellement en cours d’essai clinique – d’une part, le ruxolitinib, un inhibiteur de JAK1/2 qui peut également inhiber l’activité des cellules T via les voies de signalisation STAT [10], d’autre part, l’ibrutinib a été approuvé aux États-Unis pour le traitement de la GVHD chronique. L’ibrutinib est un inhibiteur irréversible (“small-molecule”) de la tyrosine kinase Bruton et de la kinase inductible par l’interleukine 2 (ITK). Cette dernière kinase est largement impliquée dans l’activation des lymphocytes T et donc dans la survenue de l’alloréactivité et de la GVHD [11].
Nouvelles stratégies de thérapie cellulaire contre les récidives
La survie globale après allo-SZT s’est considérablement améliorée au cours des deux ou trois dernières décennies. La mortalité associée au traitement a considérablement diminué en raison de l’amélioration des antimicrobiens (principalement antifongiques et virostatiques). Cependant, malgré tous les progrès, le taux de récidive après allo-SZT ne s’est pas amélioré, entraînant finalement le décès de plus de 25% des patients [12]. Les approches visant à prévenir les récidives post-transplantation à l’avenir incluent les considérations suivantes : L’effet de l’allo-SZT et sa supériorité par rapport à la chimiothérapie à haute dose avec retransfusion de cellules souches autologues (auto-SZT) reposent sur l’effet GVL. Celui-ci peut être durable et protéger contre les récidives de la maladie, mais il a besoin d’un certain temps pour “s’établir”. Dans le cas des leucémies agressives en particulier, il arrive souvent qu’une nouvelle activité de la maladie se produise très tôt après une allo-SZT, avant même qu’un effet GVL puisse se produire. C’est pourquoi des stratégies sont à l’étude, qui prévoient la poursuite d’un traitement médicamenteux prophylactique, par exemple avec des substances hypométhylantes, tôt après l’allo-SZT, et qui les combinent éventuellement avec des lymphocytes de donneurs, afin de contrôler la maladie jusqu’à l’apparition d’un effet GVL suffisant.
Une stratégie alternative pour guérir les néoplasies par immunologie ou par l’activité des cellules T est la manipulation génétique des cellules T en cellules T chimériques antigènes-récepteurs (CAR-T) (fig. 3). Pour les néoplasies lymphoprolifératives CD19-positives, des cellules CAR-T commerciales sont déjà disponibles en clinique – bientôt en Suisse également. Les cellules CAR-T ainsi modifiées reconnaissent leur antigène cible avec la sensibilité d’un anticorps, indépendamment du CMH, et agissent avec l’efficacité potentialisée d’une cellule T [13,14]. Contrairement aux transferts classiques de cellules T fraîches ou expansées in vitro, même un petit nombre de ces cellules CAR-T génétiquement modifiées est capable de produire des réponses immunitaires massives. L’inconvénient est que les cellules CAR-T ne peuvent être développées que contre des antigènes tumoraux connus et “exclusifs” ou que les dommages collatéraux inévitables aux cellules saines doivent être tolérables. Dans le cas des cellules CAR-T ciblées sur CD19 pour les lymphomes agressifs et la leucémie aiguë lymphoblastique B, les cellules B saines sont inévitablement éliminées. La conséquence est une hypogammaglobulinémie, qui peut être substituée de manière pragmatique sur le plan clinique. La situation est plus complexe dans le cas de la leucémie myéloïde aiguë, par exemple. La cellule souche leucémique ne se distingue pas clairement de la cellule souche sanguine saine sur le plan phénotypique. Une immunothérapie dirigée contre la cellule souche leucémique nécessite donc des cellules CAR-T modifiées et innovantes, qui sont soit sûres d’avoir une durée de vie courte (tout en exerçant leur fonction d’effecteur de manière suffisamment forte et sélective), soit qui peuvent être éliminées de manière ciblée. Il faut s’attendre à de graves dommages collatéraux sur la cellule souche hématopoïétique saine avec aplasie prolongée, de sorte que de telles thérapies ne seront peut-être réalisables cliniquement qu’avec le concept de suivi d’une TSE.
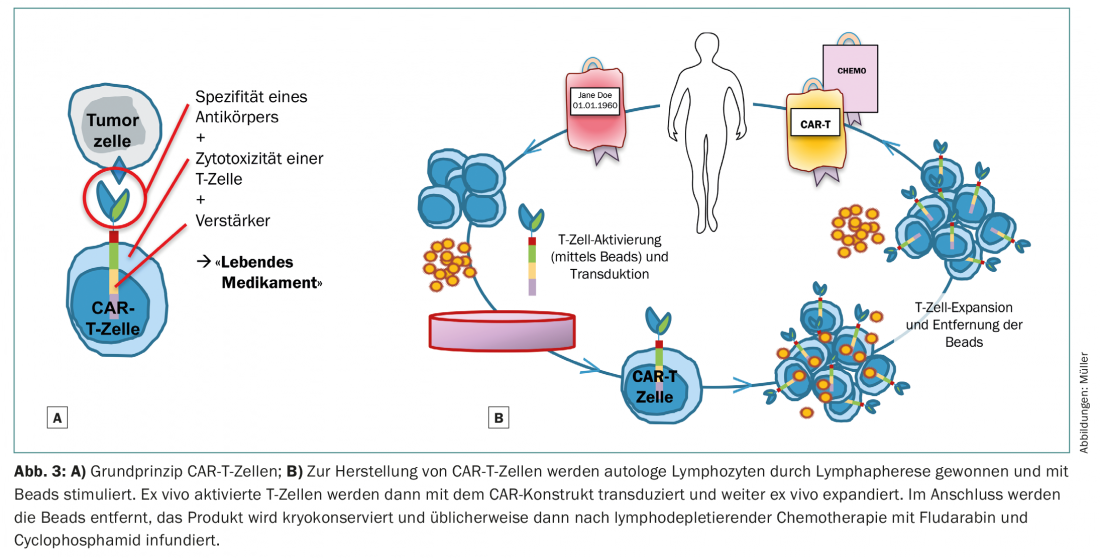
Il n’est pas encore possible d’imaginer que les thérapies cellulaires CAR-T remplaceront bientôt totalement l’allo-SZT. Cependant, pour un petit nombre d’entités telles que les lymphomes agressifs à cellules B et éventuellement les myélomes, il semble envisageable que les thérapies à base de cellules CAR-T puissent être supérieures à la fois à la TCS autologue et à la TCS allogénique.
Autolog – nouveau sur les anciens chemins
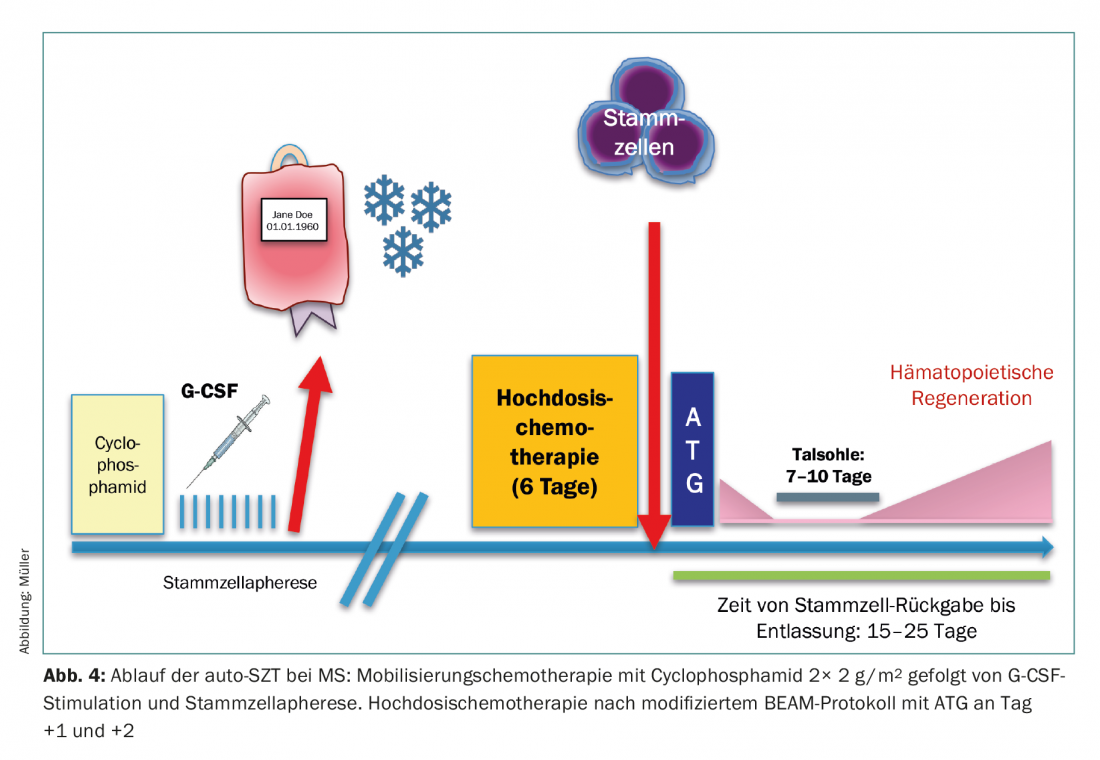
L’utilisation de l’auto-SZT est actuellement étendue à l’Hôpital universitaire de Zurich sous la forme d’une étude de registre pour les patients atteints de sclérose en plaques (SEP). La mobilisation des cellules souches est effectuée par le cyclophosphamide, qui est un puissant lymphodéployeur, afin de réduire au maximum la contamination lymphocytaire de l’aphérèse. Après la chimiothérapie à haute dose, une nouvelle déplétion des cellules T in vivo par ATG est réalisée en post-transplantation (jours 1 et 2) afin d’éliminer les cellules T résiduelles. Après l’éradication complète du système hématopoïétique et lymphatique, le “redémarrage” se fait à partir de la cellule souche sanguine (Fig.4). Des données biologiques sur l’efficacité de ce principe sont disponibles sous la forme de nombreuses observations solides dans des modèles précliniques, mais aussi dans des études cliniques de phase II, qui ont pu montrer que cette manœuvre thérapeutique permet d’arrêter complètement la progression de la SEP dans de nombreux cas. [15,16].
La transplantation classique de cellules souches deviendra-t-elle une forme de traitement superflue dans un avenir proche ? Actuellement, ce n’est certainement pas le cas, mais on peut espérer que le domaine évolue vers des thérapies cellulaires innovantes et sur mesure, qui ont moins d’effets secondaires ou des effets secondaires plus contrôlables, qui durent moins longtemps et qui s’attaquent plus efficacement aux cellules tumorales qu’aux tissus sains.
Messages Take-Home
- Malgré les nouvelles substances ciblées et les immunothérapies, le nombre de greffes de cellules souches réalisées chaque année continue d’augmenter régulièrement.
- Le nombre croissant de donneurs volontaires enregistrés et les régimes de conditionnement moins intensifs permettent aujourd’hui à une population de patients beaucoup plus importante d’avoir accès à la transplantation de cellules souches allogéniques.
- Les récidives après allogreffe de cellules souches restent la principale cause de décès et nécessitent de nouvelles stratégies de prévention des récidives et de renforcement des effets du greffon contre la leucémie.
- Les lymphocytes T récepteurs d’antigènes chimériques sont la forme la plus avancée de thérapie cellulaire, mais ils ne sont actuellement utilisés en clinique que pour un nombre limité d’entités pathologiques.
- Les greffes de cellules souches autologues ne sont pas seulement utilisées dans le traitement des hémopathies malignes, mais aussi dans le traitement des maladies cardiovasculaires.
- peuvent également stopper l’évolution des maladies auto-immunes via un redémarrage du système immunitaire.
Littérature :
- Passweg JR, et al : Is the use of unrelated donor transplantation leveling off in Europe ? The 2016 European Society for Blood and Marrow Transplant activity survey report. Bone Marrow Transplant 2018. DOI : 10.1038/s41409-018-0153-1 [Epub ahead of print].
- Petersdorf EW, et al : Expression HLA-DP élevée et maladie du greffon contre l’hôte. N Engl J Med 2015 ; 373(7) : 599-609.
- Venstrom JM, et al : HLA-C-dependent prevention of leukemia relapse by donor activating KIR2DS1. N Engl J Med 2012 ; 367(9) : 805-816.
- Gragert L, et al : HLA match likelihoods for hematopoietic stem-cell grafts in the U.S. registry. N Engl J Med 2014 ; 371(4) : 339-348.
- Robinson TM, et al : Haploidentical bone marrow and stem cell transplantation : experience with post-transplantation cyclophosphamide. Semin Hematol 2016 ; 53(2) : 90-97.
- Luznik L, O’Donnell PV, Fuchs EJ : Post-transplantation cyclophosphamide for tolerance induction in HLA-haploidentical bone marrow transplantation. Semin Oncol 2012 ; 39(6) : 683-693.
- McCurdy SR, et al : Comparable composite endpoints after HLA-matched and HLA-haploidentical transplantation with post-transplantation cyclophosphamide. Haematologica 2017 ; 102(2) : 391-400.
- Kasamon YL, et al : Étude prospective de BMT non myéloablatif, HLA-mismatched unrelated avec cyclophosphamide à haute dose post-transplantation. Blood Adv 2017 ; 1(4) : 288-292.
- Anasetti C, et al : Cellules souches de sang périphérique versus moelle osseuse de donneurs non apparentés. N Engl J Med 2012 ; 367(16) : 1487-1496.
- Zeiser R, et al : Ruxolitinib dans la maladie du greffon contre l’hôte réfractaire aux corticostéroïdes après une transplantation de cellules souches allogéniques : une enquête multicentrique. Leucémie 2015 ; 29(10) : 2062-2068.
- Miklos D, et al : Ibrutinib pour la maladie chronique du greffon contre l’hôte après l’échec d’un traitement antérieur. Blood 2017 ; 130(21) : 2243-2250.
- Appelbaum FR : Amélioration des résultats avec la transplantation de cellules hématopoïétiques allogéniques. Best Pract Res Clin Haematol 2012 ; 25(4) : 465-471.
- Dai H, et al : Récepteurs d’antigènes chimériques, cellules T modifiées pour le traitement du cancer. J Natl Cancer Inst 2016 ; 108(7).
- Curran KJ, Pegram HJ, Brentjens RJ : Récepteurs antigéniques chimériques pour l’immunothérapie par les cellules T : compréhension actuelle et orientations futures. J Gene Med 2012 ; 14(6) : 405-415.
- Muraro PA, et al : Résultats à long terme après une transplantation de cellules souches hématopoïétiques autologues pour la sclérose en plaques. JAMA Neurol 2017 ; 74(4) : 459-469.
- Mancardi GL, et al : Transplantation de cellules souches hématopoïétiques autologues dans la sclérose en plaques : un essai de phase II. Neurology 2015 ; 84(10) : 981-988.
InFo ONKOLOGIE & HÄMATOLOGIE 2018 ; 6(5) : 26-30











