Souvent, les lymphomes cutanés sont peu pris en compte. Et pourtant, les choses ont évolué ces dernières années. Ainsi, de nouvelles options thérapeutiques telles que les conjugués anticorps-médicaments, l’immunothérapie et les virus oncolytiques donnent également naissance à des traitements innovants pour ces pathologies rares. La caractérisation génétique et immunobiologique de plus en plus précise permet en outre d’établir des diagnostics de plus en plus sophistiqués.
Souvent, les lymphomes cutanés sont peu pris en compte. Et pourtant, les choses ont évolué ces dernières années. C’est ce qu’ont clairement expliqué plusieurs experts de Zurich, Leiden et Birmingham lors du congrès de l’EADO de cette année. Ainsi, de nouvelles options thérapeutiques telles que les conjugués anticorps-médicaments, l’immunothérapie et les virus oncolytiques donnent également naissance à des traitements innovants pour ces pathologies rares. La caractérisation génétique et immunobiologique de plus en plus précise permet en outre un diagnostic de plus en plus différencié, tant pour les lymphomes cutanés primaires à cellules B que pour les lymphomes à cellules T.
Lymphomes cutanés primaires à cellules B : des virus oncolytiques et des points de contrôle immunitaires
Alors que l’on pense plutôt aux néoplasies à cellules T pour les lymphomes cutanés, environ un lymphome cutané primaire sur cinq est un lymphome à cellules B. Les lymphomes à cellules B sont des lymphomes qui se développent dans les tissus cutanés. On distingue trois sous-types : le lymphome cutané primitif de la zone marginale, le lymphome folliculaire cutané primitif et le lymphome cutané primitif à grandes cellules B. Les lymphomes cutanés primitifs de la zone marginale sont les plus fréquents. Selon le Dr Egle Ramelyte de l’Hôpital universitaire de Zurich, de nouvelles possibilités thérapeutiques pourraient apparaître dans un avenir proche pour toutes les entités, par exemple grâce à l’utilisation ciblée de virus oncolytiques. Ce dernier est déjà autorisé depuis 2015 pour le traitement du mélanome malin et a récemment été évalué dans le cadre des néoplasmes cutanés à cellules B [1]. Par injection intralésionnelle du virus de l’herpès simplex 1 génétiquement modifié Talimogene laherparepvec (T-VEC) ont permis d’obtenir des résultats prometteurs.
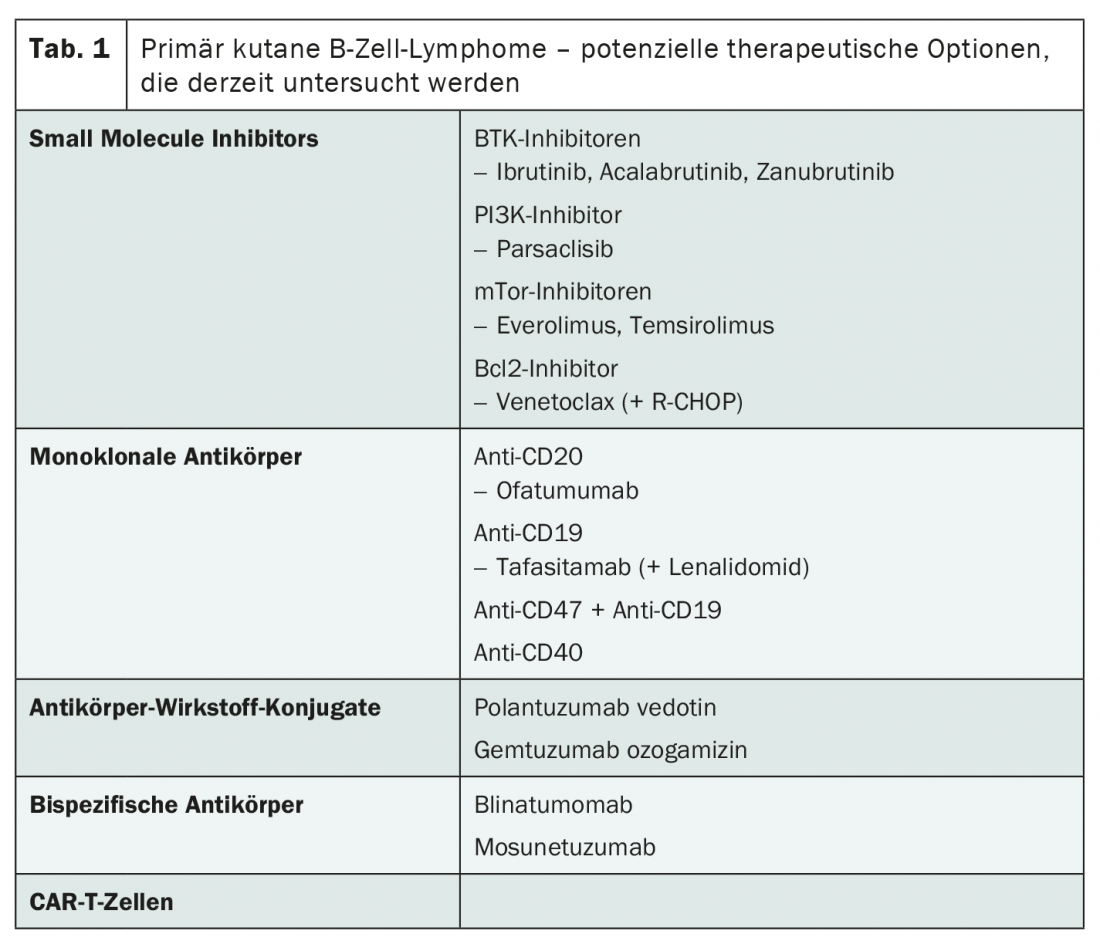
Le paysage de la recherche actuelle a aussi potentiellement beaucoup à offrir en matière de traitement des stades avancés. La plupart des substances sont étudiées sur le lymphome diffus à grandes cellules B (DLBCL), mais les résultats de l’étude devraient également être pertinents pour les lymphomes cutanés primaires à cellules B, estime le Dr Ramelyte. Ainsi, il pourrait bientôt exister des alternatives à la radiothérapie, au rituximab et à la chimiothérapie par R-CHOP. Outre les inhibiteurs de petites molécules et les anticorps monoclonaux, les conjugués anticorps-médicament, les anticorps bispécifiques et les cellules CAR-T entrent notamment en ligne de compte (tab. 1). Ces derniers sont déjà autorisés en Suisse pour le traitement du DLBCL récidivant ou réfractaire – avec un grand succès.
Contrairement à d’autres options immunothérapeutiques telles que les anticorps bispécifiques, qui se lient d’une part à la cellule tumorale et d’autre part aux propres cellules T de l’organisme et mènent ainsi à la lutte contre la tumeur maligne, l’experte considère que les inhibiteurs de points de contrôle ont moins de chances de succès dans le traitement des néoplasies cutanées à cellules B. Elle estime qu’il n’est pas nécessaire de recourir à des médicaments pour traiter ces maladies. Ces derniers ont certes modifié durablement le paysage thérapeutique des tumeurs solides, mais n’ont eu jusqu’à présent que peu de succès dans les néoplasies hématologiques, à l’exception du lymphome hodgkinien. Le taux de réponse au DLBCL à un traitement combiné anti-PD1/anti-CTLA4 est inférieur à 30%, a déclaré Ramelyte. Néanmoins, plusieurs traitements combinés avec des inhibiteurs de points de contrôle sont actuellement à l’étude. En outre, LAG3, un nouveau point de contrôle immunitaire potentiel exprimé par plus de 70% des DLBCL, est à l’étude. Selon une étude récente, le LAG3 devrait être associé à un moins bon pronostic, indépendamment de l’International Prognostic Index [2]. Ce nouveau point de contrôle pourrait donc avoir une pertinence à la fois diagnostique et thérapeutique.
Les découvertes dans les domaines de la génétique tumorale et de l’immunohistochimie pourraient également avoir une importance diagnostique. Actuellement, la valeur des deux marqueurs immunohistochimiques IRTA1 et MNDA, qui ont été utilisés jusqu’à présent principalement pour le diagnostic des lymphomes extracutanés du MALT, est en cours d’évaluation [3]. Ces dernières années, il a également été démontré que la plupart des DLBCL cutanés – près de 80% – portent une mutation dans le gène MYD88. Celle-ci entraîne l’activation du facteur de transcription NF-κB. Dans les tumeurs dont le gène MYD88 n’est pas muté, une autre mutation activant NF-κB peut être détectée dans la plupart des cas [4].
Lymphomes cutanés à cellules T : de la cytométrie de flux à la variance génétique
Selon des recherches récentes, le paysage génétique des lymphomes cutanés à cellules T est nettement plus hétérogène que celui du DLBCL cutané. Celle-ci a pu être analysée plus précisément grâce à l’utilisation du séquençage de nouvelle génération. Dans l’ensemble, de grandes différences génétiques ont été observées entre les personnes concernées, mais aussi au sein d’une même tumeur. Selon le professeur Maarten Vermeer, chef du département de dermatologie de l’hôpital universitaire de Leyde, aux Pays-Bas, les aberrations génomiques affectent en particulier l’intégrité génomique par des mutations de P53, diverses voies de signalisation telles que la voie NF- κB et la voie JAK/STAT, ainsi que le paysage épigénétique. Les changements caractéristiques de la méthylation de l’ADN et de la modification des histones pourraient, malgré la diversité du tableau, avoir une valeur diagnostique et servir potentiellement de marqueurs à l’avenir – avec des noms comme CMTM2, PROM1 ou GNMT [5,6]. En effet, il n’existe actuellement aucun outil de diagnostic fiable permettant d’identifier clairement les lymphomes cutanés à cellules T. Les chercheurs ont donc décidé de mettre au point une méthode d’identification des lymphomes cutanés. Et ce n’est pas le seul inconvénient de la grande variabilité génétique : Vermeer met en garde contre les résistances potentielles aux thérapies ciblées dues à la sélection de sous-populations de cellules tumorales.
Même si une certaine incertitude règne encore aujourd’hui en matière de diagnostic, notamment dans le domaine du diagnostic sanguin, des progrès importants ont été réalisés depuis l’ère de l’identification morphologique des cellules tumorales circulantes. La classification correcte de ces cellules malignes circulantes est importante dans la mesure où elle détermine le stade et donc le pronostic et le traitement. L’introduction généralisée de la cytométrie en flux pour le staging a permis de l’uniformiser et de l’améliorer au cours des dernières années, même si la standardisation de la procédure et l’identification de marqueurs appropriés restent des défis [7].
Pronostic et traitement en évolution
Les facteurs pronostiques des lymphomes cutanés à cellules T restent également incertains. Cependant, au cours des dernières années, de nouveaux marqueurs pronostiques tels que la charge mutationnelle totale et la fréquence de clonage tumoral (TCF) dans la lésion sont apparus. Dans l’étude correspondante, un TCF supérieur à 25% était un facteur prédictif de progression plus fort que tous les autres facteurs pronostiques établis [8]. L’une des conditions préalables à la détermination du TCF est l’identification du clone de cellules T, qui peut aujourd’hui être réalisée grâce au séquençage à haut débit avec une sensibilité nettement supérieure à celle de la PCR traditionnelle (Polymerase Chain Reaction) . Cependant, cette méthode est coûteuse et n’est pour l’instant utilisée que dans quelques centres. Afin de clarifier enfin le domaine du pronostic, l’étude PROCLIPI (Prospective Cutaneous Lymphoma International Prognostic Index Study) a été lancée en 2015, dans le cadre de laquelle des données et des matériaux définis sont collectés en permanence pour une biobanque créée à cet effet. Il est prévu que l’étude dure 10 ans et 1991 patients de 19 pays ont déjà été recrutés.
Outre la recherche de facteurs pronostiques, l’un des objectifs de l’étude PROCLIPI est d’évaluer les traitements courants. Depuis 2017, trois nouvelles substances ont été autorisées dans l’Union européenne pour le traitement des lymphomes cutanés à cellules T : Brentuximab vedotin, mogamulizumab et chlorméthine gel. Le premier est également disponible en Suisse. Alors que le gel de chlorméthine peut être utilisé comme traitement topique à tous les stades du mycosis fongoïde, le conjugué anticorps/principe actif brentuximab vedotin ainsi que l’anticorps monoclonal mogamulizumab servent à traiter les lymphomes cutanés à cellules T récidivants.
Même avec ces évolutions, la transplantation de cellules souches allogéniques, pratiquée depuis 1980, reste la seule option curative. L’amélioration des méthodes de déplétion des cellules T, les régimes moins intensifs et les nouvelles connaissances dans la gestion de la maladie du greffon contre l’hôte (GvHD) ont également permis de mieux la tolérer. Une revue publiée en 2019 fait état d’un taux de mortalité à 1 an de 15% avec un taux de récidive de 50% [9]. Le professeur Julia Scarisbrick, de l’hôpital universitaire de Birmingham (Royaume-Uni), a souligné que l’utilisation précoce de la transplantation de cellules souches allogéniques devrait être davantage évaluée. Une réponse complète à tout traitement est finalement rare dans les stades avancés et les transplantations sur des patients présentant une maladie résiduelle ne se sont pas révélées efficaces. Elle a donc plaidé pour une évaluation de la greffe de cellules souches en première rémission.
Source : Symposium SY13 “Cutaneous lymphomas : what is new ?” par le professeur Maarten Vermeer (Leids Universitair Medisch Centrum), le docteur Egle Ramelyte (Hôpital universitaire de Zurich) et le professeur Julia Scarisbrick (Hôpital universitaire de Birmingham), 15 avril 2021, 10e Congrès mondial du mélanome/17e Congrès mondial du cancer du sein. Congrès EADO, le congrès s’est déroulé de manière virtuelle.
Littérature :
- Ramelyte E, et al : Oncolytic virotherapy-mediated anti-tumor response : a single-cell perspective. Cancer Cell. 2021 ; 39(3) : 394-406. e4.
- Keane C, et al : LAG3 : un nouveau point de contrôle immunitaire exprimé par de multiples sous-ensembles lymphocytaires dans le lymphome diffus à grandes cellules B. Blood Adv. 2020 ; 4(7) : 1367-77.
- Wang Z, Cook JR : Expression d’IRTA1 et de MNDA dans le lymphome de la zone marginale : utilité dans le diagnostic différentiel et implications pour la classification. Am J Clin Pathol. 2019 ; 151(3) : 337-343.
- Zhou XA, et al : Les analyses génomiques identifient des altérations récurrentes dans les gènes d’évasion immunitaire dans le lymphome diffus à grandes cellules B, type Leg. J Invest Dermatol. 2018 ; 138(11) : 2365-2376.
- Qu K, et al : Chromatin Accessibility Landscape of Cutaneous T Cell Lymphoma and Dynamic Response to HDAC Inhibitors. Cancer Cell. 2017 ; 32(1) : 27-41. e4.
- van Doorn R, et al : Epigenomic Analysis of Sézary Syndrome Defines Patterns of Aberrant DNA Methylation and Identifies Diagnostic Markers. J Invest Dermatol. 2016 ; 136(9) : 1876-1884.
- Scarisbrick JJ, et al : Developments in the understanding of blood involvement and stage in mycosis fungoides/Sezary syndrome. Eur J Cancer. 2018 ; 101 : 278-280.
- de Masson A, et al : High-throughput sequencing of the T cell receptor β gene identifies aggressive early-stage mycosis fungoides. Sci Transl Med. 2018 ; 10(440).
- Johnson WT, et al : Allogeneic hematopoietic stem cell transplantation in advanced stage mycosis fungoides and Sézary syndrome : a concise review. Chin Clin Oncol. 2019 ; 8(1) : 12.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(3) : 28-29 (publié le 15.6.21, ahead of print)