L’anticorps monoclonal dupilumab bloque le composant récepteur commun de l’interleukine (IL)-4 et de l’IL-13, les principaux moteurs de l’inflammation de type 2. Il est déjà autorisé en Suisse depuis 2019, et de nouvelles études se sont penchées sur son efficacité et sa sécurité chez les patients atteints de BPCO modérée à sévère avec inflammation en T2 et chez les enfants souffrant d’asthme modéré à sévère non contrôlé. Des résultats ont été présentés lors du congrès DGP 2024.
Les exacerbations de la BPCO sont associées à un risque accru de nouvelles exacerbations, à une détérioration de la fonction pulmonaire et à une morbidité et une mortalité élevées. Les maladies BPCO avec inflammation de type 2 sont particulièrement concernées.
BOREAS était une étude de phase 3, randomisée, contrôlée, en double aveugle, d’une durée de 52 semaines, portant sur l’efficacité et l’innocuité du dupilumab 300mg administré toutes les deux semaines chez des patients atteints de BPCO présentant des éosinophiles sanguins ≥300 cellules/µl. De manière optimale, ils doivent déjà avoir reçu une trithérapie comprenant un corticostéroïde inhalé (CSI), un β2-agoniste de longue durée d’action (LABA) et un antagoniste muscarinique de longue durée d’action (LAMA). C’était le cas pour 98% de la population, comme l’a expliqué le PD Dr Henrik Watz, de l’Institut de recherche pneumologique de la clinique pulmonaire de Grosshansdorf (D) [1]. Dans des cas exceptionnels, par exemple lorsque le CSI était contre-indiqué, la combinaison LAMA/LABA était également autorisée. Les exacerbations doivent avoir déjà eu lieu sous traitement comme indicateur d’un besoin de traitement supplémentaire. Un antécédent de diagnostic d’asthme était un critère d’exclusion.
939 patients présentant des éosinophiles sanguins ≥300 cellules/µl ont été inclus dans BOREAS et randomisés dans un rapport 1:1 pour recevoir du dupilumab 300 mg (n=468) ou un placebo (n=471) par voie sous-cutanée (SC) une fois toutes les 2 semaines (q2w) pendant 52 semaines. Les patients étaient âgés de 40 à ≤80 ans. Le critère d’évaluation principal était le taux annualisé d’exacerbations modérées à sévères entre le début de l’étude et la semaine 52. Les critères d’évaluation secondaires comprenaient le changement du VEMS1-avant bronchodilatation à la semaine 12 et à la semaine 52 par rapport à la valeur initiale (BL), les exacerbations cumulatives au fil du temps et la sécurité ou la qualité de vie liée à la santé des patients sous traitement en tant que Patient Reported Outcome (résultat rapporté par le patient) (PRO).
Réduction de 30% du taux d’exacerbation de la BPCO
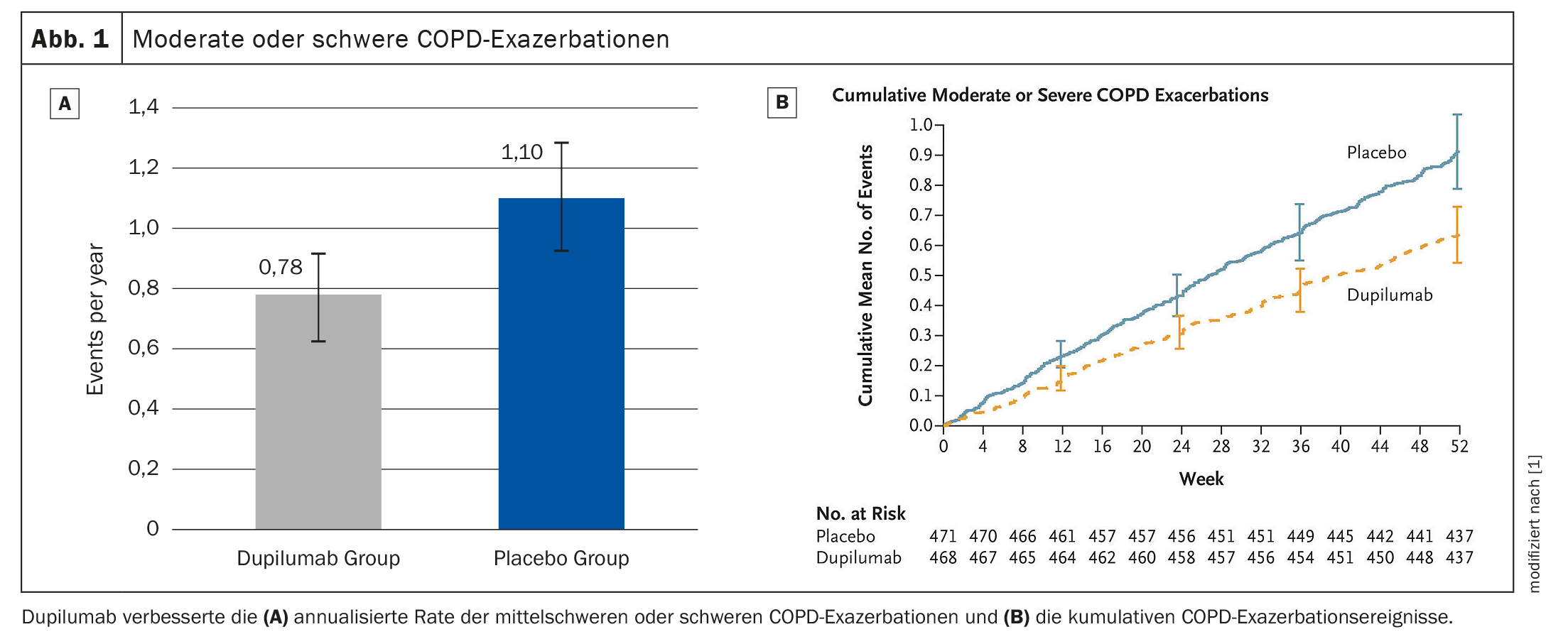
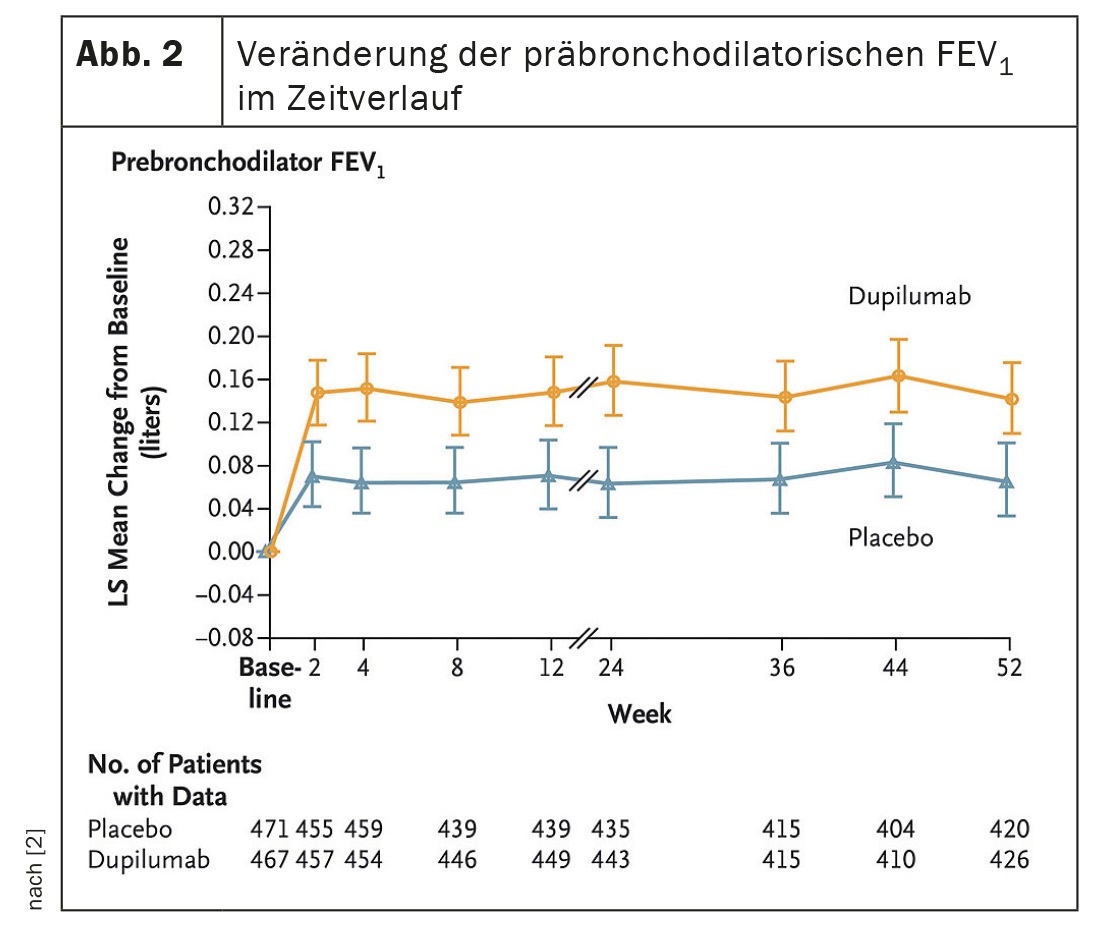
Après 52 semaines, le dupilumab a réduit le taux d’exacerbation de 30% par rapport au groupe placebo (p=0,0005). (Fig. 1A, 1B). L’anticorps IgG4 a augmenté le VEMS pré-BD1 à la semaine 12 (différence LSM vs. placebo : 83 ml, p<0,0001) ; ce qui a persisté jusqu’à la semaine 52 (83ml, p=0,0003) (Fig. 2). Cela a eu tendance à réduire le traitement annuel par corticostéroïdes systémiques (SCS) associé à l’exacerbation chez le patient traité par dupilumab (13,57 jours [SD 13,17] par rapport au bras placebo (19,09 jours [SD 20,65]). L’innocuité était similaire dans les deux groupes, les événements indésirables étant équilibrés.
Dupilumab a donc amélioré de manière significative les exacerbations modérées à sévères, la fonction pulmonaire, la qualité de vie et les symptômes chez les patients atteints de BPCO avec une inflammation en T2, a conclu le Dr Watz. L’utilisation des jours de SCS nécessaires au traitement de l’AECOPD a eu tendance à diminuer avec le dupilumab.
Effet à long terme sur la fonction pulmonaire chez les patients asthmatiques pédiatriques
Dans le traitement de l’asthme pédiatrique, la minimisation de l’altération de la fonction pulmonaire est considérée comme un objectif prioritaire. L’utilisation à long terme du dupilumab dans l’étude Excursion a entraîné une amélioration durable de la fonction pulmonaire chez des patients âgés de 6 à 11 ans souffrant d’asthme modéré à sévère de type 2 non contrôlé et ayant terminé l’étude Voyage ; une amélioration rapide de la fonction pulmonaire a été observée chez les patients passés du placebo (PBO) au dupilumab (DPL).
Dans Voyage, le dupilumab a réduit de manière significative les exacerbations sévères et amélioré la fonction pulmonaire pendant 52 semaines. Excursion était une étude d’extension ouverte, à un seul bras, avec des enfants qui avaient précédemment participé à Voyage. Le Dr Theresa Guilbert, pneumologue pédiatrique au Cincinnati Children’s Hospital and University of Cincinnati (États-Unis), a présenté une analyse post-hoc d’Excursion évaluant les améliorations de la fonction pulmonaire numériquement plus élevées observées dans les bras DPL/DPL par rapport aux bras PBO/DPL dans Excursion [3].
Les enfants ont reçu 100 mg ou 200 mg de dupilumab toutes les deux semaines, en fonction de leur poids corporel, pendant une période d’un an. Les chercheurs ont examiné le changement par rapport à la valeur initiale de l’étude parentale (PSBL) et le pourcentage de VEMS avant bronchodilatation sur 104 semaines, ainsi que l’impact des caractéristiques initiales telles que l’âge au début de l’asthme, le temps écoulé depuis le diagnostic, la dose de corticostéroïdes inhalés (CSI) au début de l’étude et le contrôle de l’asthme sur l’efficacité du dupilumab.
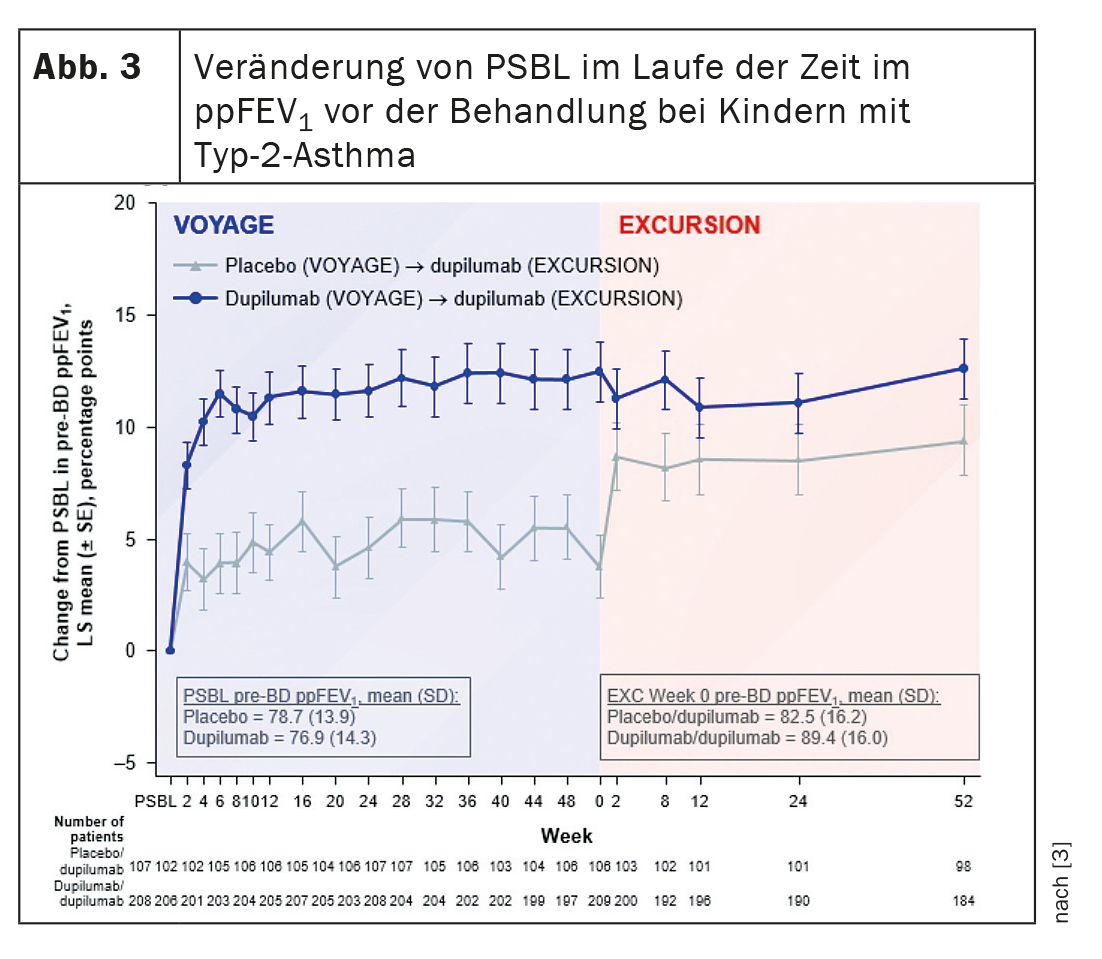
Dupilumab a rapidement amélioré la fonction pulmonaire pendant Voyage, et cette amélioration s’est poursuivie pendant Excursion. Les patients qui avaient reçu un placebo pendant Voyage ont montré dans Excursion une amélioration rapide et durable de leur fonction pulmonaire dès le début du traitement par dupilumab (Fig. 3). Le dupilumab a été capable d’améliorer et de maintenir le pourcentage de VEMS prédit avant la bronchodilatation jusqu’à 104 semaines, a résumé le Dr Guilbert. La réponse de la fonction pulmonaire au médicament biologique sur une période de 1 à 2 ans ne différait pas selon la durée de l’asthme ou l’âge au début du traitement.
Le débat concernant ces données est que les patients qui sont passés du placebo au dupilumab ne rattrapent pas complètement leur fonction pulmonaire, a fait remarquer le professeur Marek Lommatzsch, de la médecine universitaire de Rostock (D). La question est donc la suivante : s’agit-il d’un effet réel et cela signifie-t-il qu’un retard d’un an dans le traitement signifie une perte de la fonction pulmonaire ? Le Dr Guilbert a expliqué que son groupe de recherche avait également eu cette idée au départ. “Il ne s’agit toutefois pas d’une différence statistique. La valeur est numériquement plus élevée, mais elle n’atteint pas la significativité statistique par rapport au groupe placebo”. Il faudrait sans doute des chiffres plus importants pour constater cette différence. En outre, “il y a bien sûr beaucoup de discussions sur le fait de savoir si nous devrions parler de rémission clinique dans le traitement avec l’arrivée des thérapies biologiques”. Il y aurait quelques discussions sur le fait de savoir si cela est approprié ou non en pédiatrie.
Congrès : DGP 2024
Sources :
- Watz H : Efficacité et sécurité du dupilumab pour la BPCO avec inflammation de type 2 indiquée par des éosinophiles élevés. Session “Nouveautés dans les essais cliniques sur l’asthme et la BPCO”. 64e Congrès de la Société allemande de pneumologie et de médecine respiratoire, 20-24 mars 2024, Mannheim (D).
- Bhatt SP, Rabe KF, Hanania NA, et al : Dupilumab for COPD with Type 2 Inflammation Indicated by Eosinophil Counts. N Engl J Med 2023 ; 389 : 205-214 ; doi : 10.1056/NEJMoa2303951.
- Guilbert T : Effet à long terme du dupilumab sur la fonction pulmonaire chez les patients pédiatriques souffrant d’asthme non contrôlé. Session “Nouveautés dans les essais cliniques sur l’asthme et la BPCO”. 64e Congrès de la Société allemande de pneumologie et de médecine respiratoire, 20-24 mars 2024, Mannheim (D).
InFo PNEUMOLOGIE & ALLERGOLOGIE 2024 ; 6(2) : 36-37 (publié le 30.5.24, ahead of print)