L’activité physique réduit probablement le risque d’apparition de la maladie de Parkinson plus tard dans la vie. En conséquence, le traitement non médicamenteux de la maladie de Parkinson prend de plus en plus d’importance. Elle comprend essentiellement la neuromodulation et la neuroréhabilitation chez les patients avancés.
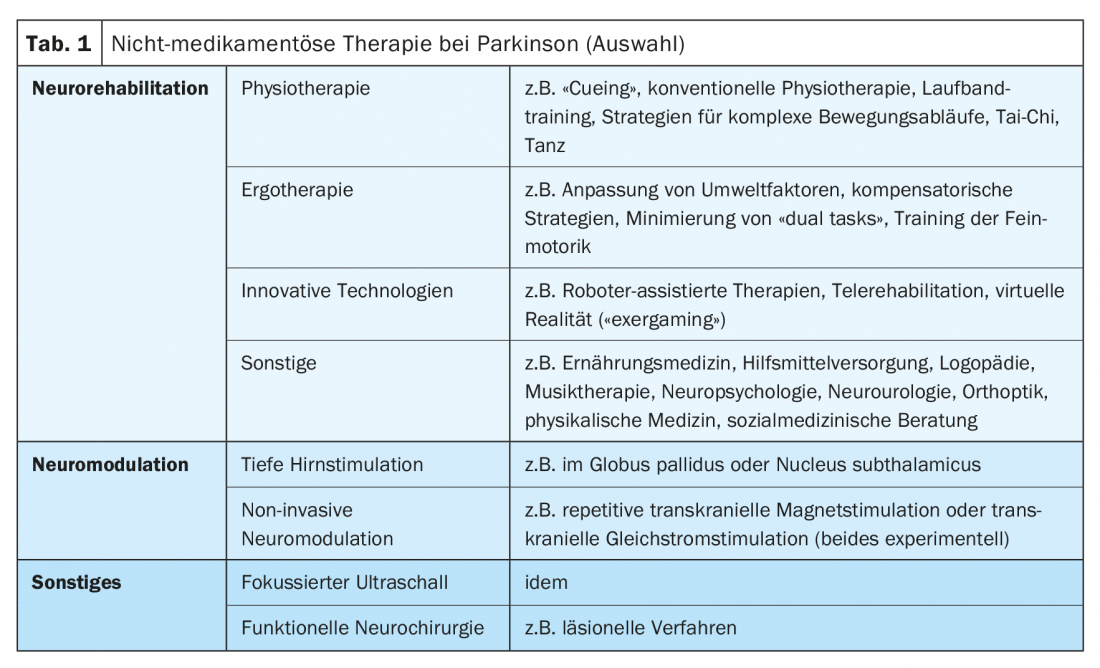
Le traitement non médicamenteux de la maladie de Parkinson comprend essentiellement la neuromodulation et la neuroréhabilitation chez les patients à un stade avancé. L’article se concentre sur le traitement de réadaptation des patients atteints de la maladie de Parkinson, en mettant l’accent sur les problèmes de traitement spécifiques et les approches thérapeutiques innovantes. Les méthodes telles que la stimulation cérébrale profonde ou la neuromodulation non invasive ne sont pas traitées en détail, pas plus que les ultrasons focalisés en tant qu’alternative thérapeutique expérimentale à la stimulation cérébrale profonde. Certains domaines de la neuroréhabilitation comme l’orthophonie, la neuropsychologie et la rééducation visuelle ne sont pas non plus discutés (tableau 1).
Rééducation somatique de la maladie de Parkinson
L’activité physique réduit probablement le risque d’apparition de la maladie de Parkinson plus tard dans la vie. Selon une méta-analyse suédoise portant sur les six études disponibles à l’époque, les personnes physiquement actives ont un risque plus faible (“hazard ratio” : 0,66) de développer une maladie de Parkinson plus tard dans la vie par rapport aux personnes physiquement inactives [1].
En physiothérapie ou en ergothérapie, l’exercice (“exercise”) décrit une activité physique qui est planifiée, structurée et répétée afin de (ré)apprendre ou d’entretenir une fonction motrice. Le feedback peut aider les patients à aller au-delà de leurs capacités perçues ou à prendre conscience de mouvements qui étaient auparavant automatiques ou inconscients. Il existe de nombreuses études sur l’efficacité de la physiothérapie dans toutes ses variantes pour la maladie de Parkinson, dont certaines sont brièvement présentées ci-dessous. Dans les années 90, l’une des premières études contrôlées publiées a montré que la participation à un programme de rééducation de 4 semaines améliorait la mobilité des patients atteints de la maladie de Parkinson [2]. Cependant, cette amélioration ne persistait pas lors du retour à l’activité physique habituelle. Le LSVT®BIGest probablement l’une des méthodes les plus utilisées dans le traitement thérapeutique des patients atteints de la maladie de Parkinson et a été présentée par Farley et Koshland [3]. Dans le cadre de ce traitement intensif, les patients s’entraînent à effectuer des mouvements de grande amplitude pendant 1 heure par jour, 4 fois par semaine, pendant 4 semaines. Dans une étude contrôlée, LSVT®BIGs’est avéré plus efficace que la “marche nordique” ou l’autothérapie à domicile [4]. L’étude PRET-PD a montré que l’entraînement progressif de la force 2× par semaine pendant 24 mois entraînait une réduction des symptômes moteurs mesurés par l’UPDRS-III. Un entraînement sur tapis roulant 3× par semaine à haute intensité (80% de la réserve de fréquence cardiaque) ou à basse intensité (40% de la réserve de fréquence cardiaque) a été comparé à un entraînement de musculation non aérobie [5]. Les trois groupes ont montré une amélioration de la vitesse de marche, tandis que la musculation a également amélioré la force musculaire. Une combinaison d’éléments d’entraînement aérobies et non aérobies a donc été proposée. L’entraînement des pas compensatoires peut être utilisé pour traiter l’instabilité posturale dans la maladie de Parkinson. Dans la maladie de Parkinson, le tai-chi entraîne probablement une amélioration des troubles de l’équilibre et une réduction de la fréquence des chutes [6]. De plus, le programme HiBalance a été développé pour traiter les troubles de l’équilibre dans la maladie de Parkinson. En ce qui concerne l’ergothérapie, un traitement individuel à domicile a entraîné une amélioration subjective dans les activités de la vie quotidienne [7]. De plus, un programme d’ergothérapie à domicile ciblé (HOMEDEXT) améliore probablement les compétences motrices fines chez les patients atteints de la maladie de Parkinson.
Même si de nombreuses études portent sur un nombre relativement faible de cas, il est très probable que la neuroréhabilitation soit efficace dans le traitement des patients atteints de la maladie de Parkinson. En revanche, on ne sait pas exactement sur quels mécanismes repose l’effet symptomatique et si l’activité physique a une influence positive sur l’évolution de la maladie. L’étude SPARX menée chez des patients atteints de la maladie de Parkinson de novo a conclu que l’entraînement sur tapis roulant à haute intensité devait faire l’objet d’une étude plus approfondie en vue d’un effet modificateur de la maladie [8]. L’étude Park-in-Shape a fourni d’autres preuves d’un éventuel effet modificateur de la maladie de l’entraînement aérobie [9].
les troubles de la posture : Camptocormie
Une posture voûtée est l’une des caractéristiques typiques de la maladie de Parkinson. Les formes prononcées sont appelées camptocormie. Les autres troubles posturaux de la maladie de Parkinson sont l’antécollision et le syndrome de Pise. La prévalence de ces troubles posturaux est de 11,2% pour la camptocormie, 8,5% pour le syndrome de Pisa et 6,5% pour l’antécollision, avec des formes mixtes [10].
La camptocormie dans la maladie de Parkinson a été décrite pour la première fois en 1999 chez huit patients chez qui la L-Dopa n’a entraîné aucun changement ou une aggravation de la mauvaise posture. La camptocormie supérieure (≥45°), plus fréquente, présente le point de flexion entre la partie inférieure de la colonne vertébrale thoracique et la partie supérieure de la colonne vertébrale lombaire, alors que dans la camptocormie inférieure (≥30°), plus rare, le point de flexion se situe au niveau de l’articulation de la hanche. Le critère principal pour distinguer la camptocormie d’une cyphoscoliose est la capacité à corriger la mauvaise posture par différentes manœuvres, par exemple en s’allongeant ou en s’appuyant contre un mur. Pour déterminer la camptocormie totale, on utilise l’angle des lignes entre la malléole latérale et l’apophyse épineuse L5 et entre les apophyses épineuses L5 et C7 [11]. La camptocormie supérieure est mesurée à partir des lignes reliant le fulcrum vertébral aux apophyses épineuses L5 et C7. Ces mesures peuvent être effectuées à l’aide de NeuroPostureApp©. Les facteurs étiologiques possibles sont la rigidité musculaire, la dystonie axiale, une faiblesse due à une myopathie, des troubles du schéma corporel avec une perception de soi perturbée et des modifications structurelles de la colonne vertébrale, bien que la pathophysiologie de la camptocormie dans la maladie de Parkinson ne soit pas encore définitivement élucidée.
La réponse à la médication dopaminergique ou à la stimulation cérébrale profonde dépend de différents facteurs tels que la durée de la camptocormie, mais elle est souvent insatisfaisante. Les injections intramusculaires de toxine botulique ou de lidocaïne peuvent aider, mais les données sont insuffisantes et souvent incohérentes. C’est pourquoi la rééducation posturale joue un rôle important dans le traitement de la camptocormie. Il s’agit notamment d’un entraînement postural passif et actif, d’un contrôle postural visuel et proprioceptif et d’exercices fonctionnels [11]. La camptocormie a complètement disparu dans un cas lors de l’utilisation d’un sac à dos de 6 kg suspendu bas et est réapparue après avoir déposé le sac à dos. L’utilisation d’un déambulateur surélevé peut également être utile. Le port d’une orthèse peut également être envisagé. Dans certains cas, la mauvaise position peut être corrigée chirurgicalement, mais les complications et les révisions chirurgicales sont fréquentes.
“Freezing of Gait (FOG)” (congélation de l’estomac)
Le FOG a été défini comme une incapacité épisodique, durant quelques secondes, à générer des pas efficaces en l’absence de causes connues autres qu’un syndrome parkinsonien ou d’autres troubles complexes de la marche. Alternativement, le FOG a été défini comme une brève absence épisodique ou une réduction significative du mouvement des pieds vers l’avant malgré l’intention de marcher. Lorsqu’un patient avance, l’apparition du FOG donne lieu à la séquence d’événements suivante : a) une diminution nette et croissante de la longueur de la foulée ; b) une réduction significative de l’amplitude des mouvements de la hanche, du genou et de la cheville ; c) une coordination perturbée du cycle de la marche, difficile à distinguer d’une festination ; et d) Mouvements alternatifs à haute fréquence de type tremblement [12].
Cliniquement, on peut distinguer trois formes différentes de FOG : a) de très petits pas ; b) Mouvements de type tremblement au même endroit ; c) l’akinésie. Le FOG se produit le plus souvent au décollage, lors des manœuvres, dans les espaces confinés, en cas de stress ou de distraction. Une coordination bilatérale de la marche perturbée prédispose probablement à l’apparition de FOG, en particulier dans les activités nécessitant un haut niveau de coordination gauche-droite. Le retournement à 360° combiné à une “double tâche” a été décrit comme le principal déclencheur de FOG. Pendant le retournement, les “non-freezers” et les témoins ont réduit leur cadence, tandis que les “freezers” l’ont augmentée. L’étiologie du FOG n’est pas encore définitivement établie. Pendant un épisode de FOG, l’activité du noyau subthalamique et de la région locomotrice mésencéphalique est réduite. Une connectivité accrue des régions sous-corticales et corticales impliquées dans le traitement des signaux sensoriels et spatio-visuels soutient l’hypothèse d’une surcharge dans la boucle des ganglions de la base, qui conduit finalement à l’apparition du FOG [13].
En matière de traitement, il convient de distinguer le FOG qui survient pendant l’état on- ou off médicamenteux des patients atteints de la maladie de Parkinson. Le FOG pendant l’état off s’améliore généralement en optimisant le traitement médicamenteux. Une attention focalisée et des stimuli externes (“cues”) peuvent aider à briser le FOG. Un entraînement par le biais du “cueing” à domicile a eu des effets positifs sur le FOG, la marche et l’équilibre [14]. La diminution de l’efficacité après la fin de cette intervention démontre le besoin de dispositifs de “cueing” utilisables de manière permanente. Les dispositifs “en boucle ouverte”, qui offrent des stimuli visuels ou sonores à un rythme fixe, peuvent améliorer la démarche, mais ont souvent un effet peu fiable ou peuvent aggraver la FOG chez certains patients. Un dispositif portable de détection en temps réel du FOG qui, lorsqu’il est détecté, fournit automatiquement un stimulus sonore qui dure jusqu’à ce que la personne recommence à marcher, a déjà été développé en 2010. Cet appareil a détecté le FOG en ligne avec une sensibilité de 73,1% et une spécificité de 81,6%. L’efficacité d’un autre dispositif portable “en boucle fermée” utilisant des stimuli visio-acoustiques a été étudiée chez treize patients parkinsoniens atteints de FOG en état d’arrêt médicamenteux [15]. Après un entraînement et le retrait du dispositif, la vitesse de marche et la longueur des pas étaient améliorées. Le nombre d’appareils dédiés à la prédiction ou à la détection du FOG a considérablement augmenté depuis. Selon une revue récente, 68 dispositifs de ce type ont été décrits jusqu’à présent [16]. Jusqu’à ce que les appareils “en boucle fermée” soient utilisés dans la pratique clinique quotidienne, les techniques de “cueing” traditionnelles continueront à jouer le rôle le plus important dans le cadre du traitement physiothérapeutique et de la fourniture d’aides.
Thérapies assistées par robot
En ce qui concerne les thérapies assistées par robot, l’entraînement à la marche chez les patients atteints de la maladie de Parkinson a notamment été étudié. Dans le cadre de l’entraînement à la marche assisté par robot, on distingue la technologie basée sur l’exosquelette de celle basée sur l’effecteur terminal (Fig. 1). La première utilise un exosquelette adapté au corps, qui déplace directement les membres. En revanche, les robots basés sur des effecteurs terminaux déplacent les membres inférieurs via des plaques de pied. Des appareils appartenant aux deux groupes, tels que le Lokomat®, le “Gait Trainer” et le robot G-EO, ont été étudiés jusqu’à présent. Dans la plupart des études, l’entraînement à la marche assisté par robot a été comparé à un entraînement sur tapis roulant. Bien que dans certaines études, l’entraînement à la marche assisté par robot ait obtenu de meilleurs résultats que l’entraînement sur tapis roulant à certains égards, les données restent insuffisantes et parfois incohérentes. Cependant, plusieurs études indiquent que l’entraînement à la marche assisté par robot est supérieur à l’entraînement sur tapis roulant dans le traitement du FOG [17].
Réalité virtuelle
La réalité virtuelle est de plus en plus utilisée dans la neuroréhabilitation, notamment pour les troubles de la marche et de l’équilibre chez les patients atteints de la maladie de Parkinson. Dans ce cadre, la WiiTM avec “balance board” de Nintendo et la Xbox Kinect™ de Microsoft ont souvent été étudiées. Les deux systèmes semblent être adaptés à la neuroréhabilitation des patients atteints de la maladie de Parkinson [18]. Les entreprises de technologie médicale dans le domaine de la neuroréhabilitation ont également de plus en plus recours à l’intégration de la réalité virtuelle ou augmentée dans leurs produits. Malgré les indications selon lesquelles la réalité virtuelle conduit à une rééducation plus efficace et moins longue que les thérapies conventionnelles, il existe actuellement peu de données pour étayer cette affirmation [19]. On peut néanmoins s’attendre à ce que l'”exergaming” continue à s’imposer dans le domaine de la neuroréhabilitation, avec l’espoir que des effets positifs sur la cognition puissent être obtenus en même temps.
Messages Take-Home
- Les thérapies non médicamenteuses gagnent en importance, en particulier dans la maladie de Parkinson avancée.
- On espère que l’activité physique aura un effet positif sur l’évolution de la maladie de Parkinson.
- Les symptômes axiaux tels que la camptocormie ou le FOG constituent un problème thérapeutique particulier dans la maladie de Parkinson.
- Les technologies innovantes et l’utilisation de la réalité virtuelle seront probablement de plus en plus utilisées dans la neuroréhabilitation de la maladie de Parkinson.
Littérature :
- Yang F, et al : Activité physique et risque de maladie de Parkinson dans la Swedish National March Cohort. Brain 2015 ; 138(2) : 269-275.
- Comella CL, et al : Physical therapy and Parkinson’s disease : a controlled clinical trial. Neurology 1994 ; 44 (3) : 376-378.
- Farley BG, Koshland GF : Training BIG to move faster : the application of the speed-amplitude relation as a rehabilitation strategy for people with Parkinson’s disease. Exp Brain Res 2005 ; 167(3) : 462-467.
- Li F, et al. Tai chi et stabilité posturale chez les patients atteints de la maladie de Parkinson. N Engl J Med 2012 ; 366(6) : 511-519.
- Ebersbach G, et al. : Comparer l’exercice dans la maladie de Parkinson – l’étude LSVT®BIG de Berlin. Mov Disord 2010 ; 25(12) : 1902-1908.
- Shulman LM, et al : Essai clinique randomisé de 3 types d’exercice physique pour les patients atteints de la maladie de Parkinson. JAMA Neurol 2013 ; 70(2) : 183-190.
- Sturkenboom IH, et al : Efficacité de la thérapie occupationnelle pour les patients atteints de la maladie de Parkinson : un essai contrôlé randomisé. Lancet Neurol 2014 ; 13 : 557-566.
- Schenkman M, et al : Effect of high-intensity treadmill exercise on motor symptoms in patients with de novo Parkinson disease : a phase randomized clinical tria. JAMA Neurol 2018 ; 75(2) : 219-226.
- van der Kolk NM, et al : Efficacité de l’exercice aérobie à domicile et supervisé à distance dans la maladie de Parkinson : un exercice aérobie randomisé en double aveugle dans la maladie de Parkinson. Lancet Neurol 2019 ; 18(11) : 998-1008.
- Tinazzi M, et al. : Anomalies posturales dans la maladie de Parkinson : Une étude épidémiologique et clinique multicentrique. Mov Disord Clin Pract 2019 ; 6(7) : 576-585.
- Margraf NG, et al : Consensus pour la mesure de l’angle camptocormial chez le patient en position debout. Parkinsonism Relat Disord 2018 ; 52 : 1-5.
- Gandolfi M, et al : Four-week trunk-specific exercise program decreases forward trunk flexion in Parkinson’s disease : a single-blinded, randomized controlled trial. Parkinsonism Relat Disord 2019 ; 64:268-274.
- Nutt JG, et al : Freezing of gait : moving forward on a mysterious clinical phenomenon. Lancet Neurol 2011 ; 10(8):734-744.
- Potvin-Desrochers A, et al. : Changements dans la connectivité fonctionnelle de l’état de repos liés au gel de la marche dans la maladie de Parkinson. Neuroscience 2019 ; 418 : 311-317.
- Nieuwboer A, et al : Cueing training in the home improves gait-related mobility in Parkinson’s disease : the RESCUE trial. J Neurol Neurosurg Psychiatry 2007 ; 78(2) : 134-140.
- Espay AJ, et al. Entraînement à domicile avec un dispositif de réalité augmentée en boucle fermée pour améliorer la marche chez les patients atteints de la maladie de Parkinson. J Rehabil Res Dev 2010 ; 47 : 573-581.
- Pardoel S, et al : Wearable sensor-based detection and prediction of freezing of gait in Parkinson’s disease : a review. Sensors 2019 ; 19(23) : 5141.
- Cappeci M, et al : Effets cliniques de l’entraînement à la marche assisté par robot et de l’entraînement sur tapis roulant pour la maladie de Parkinson. Un essai contrôlé randomisé. Ann Phys Rehabil Med 2019 ; 62(5) : 303-312.
- Marotta N, et al : Nintendo WiiTM versus Xbox KinectTM pour la locomotion fonctionnelle chez les personnes atteintes de la maladie de Parkinson : a systematic review and network meta-analysis. Disabil Rehabil 2020 ; doi:10.1080/09638288.1768301.
- Canning CG, et al. : Réalité virtuelle dans la recherche et la rééducation de la marche et de l’équilibre dans la maladie de Parkinson. Nat Rev Neurol 2020 ; 16(8) : 409-425.
InFo NEUROLOGIE & PSYCHIATRIE 2020 ; 18(5) : 6-9