Les infarctus/lésions myocardiques périopératoires (IMP) après des interventions non cardiaques sont une complication cardiaque fréquente. Une meilleure compréhension de l’étiologie sous-jacente et des conséquences est nécessaire de toute urgence.
L’infarctus du myocarde périopératoire ou la lésion myocardique périopératoire (PMI) sont de plus en plus reconnus comme une complication cardiaque périopératoire fréquente après des interventions non cardiaques majeures et contribuent de manière significative à la mortalité postopératoire [2–6]. En raison de la forte analgésie administrée pendant la phase périopératoire, la plupart des PMI surviennent sans symptômes ischémiques typiques et sont donc négligées dans la pratique clinique de routine sans surveillance active [2–4,7,8]. La mortalité associée aux IMP asymptomatiques étant comparable à celle des IMP symptomatiques, une surveillance active des IMP avec des mesures pré- et postopératoires de la troponine cardiaque (cTn) dans le cadre des soins cliniques de routine est de plus en plus préconisée afin de permettre une détection et un traitement précoces [9–12]. Récemment, la Société européenne de cardiologie a publié une recommandation de classe IB pour une telle surveillance active de l’IMP [12].
Des études antérieures, dans lesquelles une surveillance active de l’IMP a été effectuée, ont montré que l’IMP n’est pas une maladie homogène, mais un syndrome hétérogène avec plusieurs étiologies sous-jacentes différentes, y compris l’infarctus du myocarde de type 1 (IMI T1), qui est causé par une rupture de plaque, l’infarctus du myocarde de type 2 (T2MI), qui est causé par un déséquilibre entre l’offre et la demande, la tachyarythmie, l’insuffisance cardiaque aiguë et l’IMP extracardiaque primaire, qui peut être causée, par ex. par exemple, en raison d’une septicémie grave ou d’une embolie pulmonaire (EP) [2–4,13–16]. Une meilleure compréhension de l’étiologie sous-jacente est une condition préalable à des interventions préventives et/ou thérapeutiques ciblées en cas d’IMP chez le patient individuel [9,17,18]. Lors de la détermination centrale de l’étiologie de l’IMP, des différences inattendues dans l’incidence et la mortalité à court terme après 30 jours ont été observées récemment dans une étude pilote, ce qui souligne encore davantage l’importance clinique d’un phénotypage détaillé [16]. On sait toutefois peu de choses sur les conséquences à long terme des différentes étiologies d’IMP [3]. Une étude multicentrique prospective récente a donc examiné quels événements cardiaques indésirables graves (ECM) et quelle mortalité globale étaient associés aux différentes étiologies d’IMP évaluées de manière centralisée sur une période d’un an [1].
Population
Entre mai 2014 et juin 2018, un total de 10 772 patients ont été inclus, dont 7754 étaient éligibles pour cette analyse. Des patients consécutifs ayant subi une chirurgie majeure non cardiaque en milieu hospitalier ont été inclus de manière prospective dans trois hôpitaux (l’Hôpital universitaire de Bâle, l’Hôpital cantonal d’Aarau, tous deux en Suisse, et l’Instituto do Coracao, InCor, Universidade de Sao Paulo, Brésil), qui ont été sélectionnés pour le programme institutionnel actif de surveillance et de réponse au PMI pour les patients à haut risque ayant subi une chirurgie majeure non cardiaque en milieu hospitalier [2].
Les patients ont été dépistés s’ils présentaient un risque accru de mortalité, s’ils étaient âgés de ≥65 ans ou de ≥45 ans, s’ils présentaient une maladie coronarienne, une maladie artérielle périphérique ou un accident vasculaire cérébral et s’ils subissaient une intervention chirurgicale non cardiaque en milieu hospitalier avec un séjour postopératoire prévu de ≥24 heures. Les concentrations plasmatiques de cTn ont été mesurées dans les 30 jours précédant l’opération et aux jours un et deux postopératoires dans le cadre de la surveillance active, ainsi qu’après l’opération en cas d’indication clinique. Un électrocardiogramme (ECG) à douze dérivations a été réalisé le jour où une PMI a été détectée et en cas d’indication clinique.
Évaluation de l’étiologie de l’IMP
L’étiologie de l’IMP, identifiée dans le cadre d’un programme de surveillance active et de réponse, a été évaluée de manière centralisée par deux médecins indépendants sur la base de toutes les informations obtenues au cours de l’examen de l’IMP indiqué sur le plan clinique, y compris l’imagerie cardiaque, chez des patients consécutifs à haut risque qui ont subi une chirurgie non cardiaque majeure dans le cadre d’une étude prospective multicentrique. L’étiologie de l’IMP a été hiérarchisée en “extracardiaque” lorsqu’elle était causée par une affection extracardiaque primaire, telle qu’une septicémie sévère ou une embolie pulmonaire, et “cardiaque”, subdivisée plus avant en infarctus du myocarde de type 1 (IMCT1), tachyarythmie, insuffisance cardiaque aiguë (ICA) ou infarctus du myocarde probable de type 2 (lT2MI).
Points finaux
Les critères d’évaluation primaires étaient la survenue de MACE et de décès de tous types selon différentes étiologies de PMI sur une période d’un an. Les décès ont été classés comme cardio-vasculaires ou non cardio-vasculaires selon les dernières lignes directrices [19]. Le MACE a été défini comme un critère d’évaluation composite comprenant l’infarctus aigu du myocarde, l’AHF, les arythmies potentiellement mortelles et le décès d’origine cardiovasculaire. Le suivi a commencé après l’opération, le jour même de l’intervention. Afin d’éviter les biais de définition, l’IMP index n’a pas été comptée comme un événement de point final chez les patients atteints d’IMP classés comme T1MI ou AHF ; à la place, la période de suivi pour les infarctus du myocarde aigus ou AHF a commencé après le troisième jour postopératoire. Un composite de MACE et de décès toutes causes confondues était un critère d’évaluation secondaire.
Afin d’optimiser le rapport événement/bruit pour les analyses temps-avant-événement et pronostiques, la survenue d’un MACE et d’un décès total après 120 jours a été choisie comme critère d’évaluation secondaire et utilisée pour les analyses pronostiques et temps-avant-événement, car une étude antérieure suggérait une période à risque de 120 jours après des interventions non cardiaques [20].
Caractéristiques des étiologies de PMI
Les IMP sont survenues chez 1016/7754 patients (13,1%), dont 109/1016 (10,7%) ont été classés comme extracardiaques primaires au niveau central. Les IMP ont été classées comme T1MI chez 71/1016 patients (7,0%), comme tachyarythmie chez 47/1016 patients (4,6%) et comme AHF chez 39/1016 patients (3,8%). Parmi les patients chez qui un T1MI a été détecté, 42/71 patients ont subi une coronarographie dans les sept jours, 47/71 patients dans les 30 jours, et 24 patients ont été décidés sans coronarographie. Les 750/1016 restants (73,8%) ont été classés comme lT2MI.
Les caractéristiques initiales différaient entre les étiologies d’IMP préalablement spécifiées, avec par exemple une coronaropathie connue plus fréquente dans les T1MI et les AHF que dans toutes les autres étiologies d’IMP. Des critères supplémentaires pour le diagnostic d’IMA spontanée étaient présents chez 260/1016 (25%) des patients atteints d’IMP, par exemple des symptômes ischémiques ou une dyspnée chez 143/1016 (14%), avec là aussi de grandes différences entre les étiologies d’IMP. Chez 34/1016 patients (3%), la PMI a été évaluée sans valeur cTn préopératoire, sur la base de la variation entre les valeurs postopératoires.
Suivi
Le suivi s’est achevé chez 7754/7833 patients (99%) avec une durée médiane de 388 jours. Chez 684/7754 patients, au moins un MACE est survenu après un an (8,8%). Au total, 818/7754 patients sont décédés dans l’année (10,5%), le décès étant survenu chez 154/817 patients pendant leur hospitalisation index. Chez 1160/7754 patients (15,0%), un MACE ou un décès a été la cause globale.
MACE selon PMI selon l’étiologie
Pour toutes les étiologies d’IMP, le taux de MACE à 1 an était nettement plus élevé par rapport aux patients sans IMP. Chez les patients sans IMC (7%, IC 95% 6%-8%), et au sein de l’étiologie de l’IMC, il y avait des différences significatives (Fig. 1A) [1] : L’IMP extracardiaque, l’IMIT, la tachyarythmie et l’AHF étaient associées à des taux très élevés de MACE [30% (IC 95% 20-47), 37% (IC 95% 24-47), 49% (IC 95% 34-75) et 56% (IC 95% 38-70) respectivement], et l’IMIT2 était également associée à des taux élevés de MACE (17%, IC 95% 22-28). Les associations ont été confirmées dans l’analyse multivariable avec des ratios de risque ajustés (aHR) de 3,0 (2,0-4,5), 3,2 (IC à 95% 2,1-4,8), 5,4 (3,5-8,4) et 5,5 (3,5-8,7) pour l’IMP extracardiaque, l’IMCT1, la tachyarythmie et l’AHF et 1,8 (1,5-2,2) pour l’IMCT2.
Une association similaire a été observée pour MACE à 120 jours, avec un aHR numériquement plus élevé dans l’analyse multivariable par rapport aux associations à 1 an, mais une puissance moindre en raison d’un nombre d’événements moins important. Le temps écoulé entre l’opération et l’apparition de MACE dans les 120 jours variait considérablement entre les étiologies de PMI, allant d’une médiane de trois jours après AHF à 13 jours après lT2MI et 26 jours chez les patients sans PMI. En examinant le nombre total de MACE, stratifié selon l’étiologie de l’IMP, des événements multiples sont survenus chez 3% à 23% des patients, contre 1% chez les patients sans IMP. L’association de l’étiologie de la PMI avec la MACE était plus forte au cours des 120 premiers jours qu’après un an.
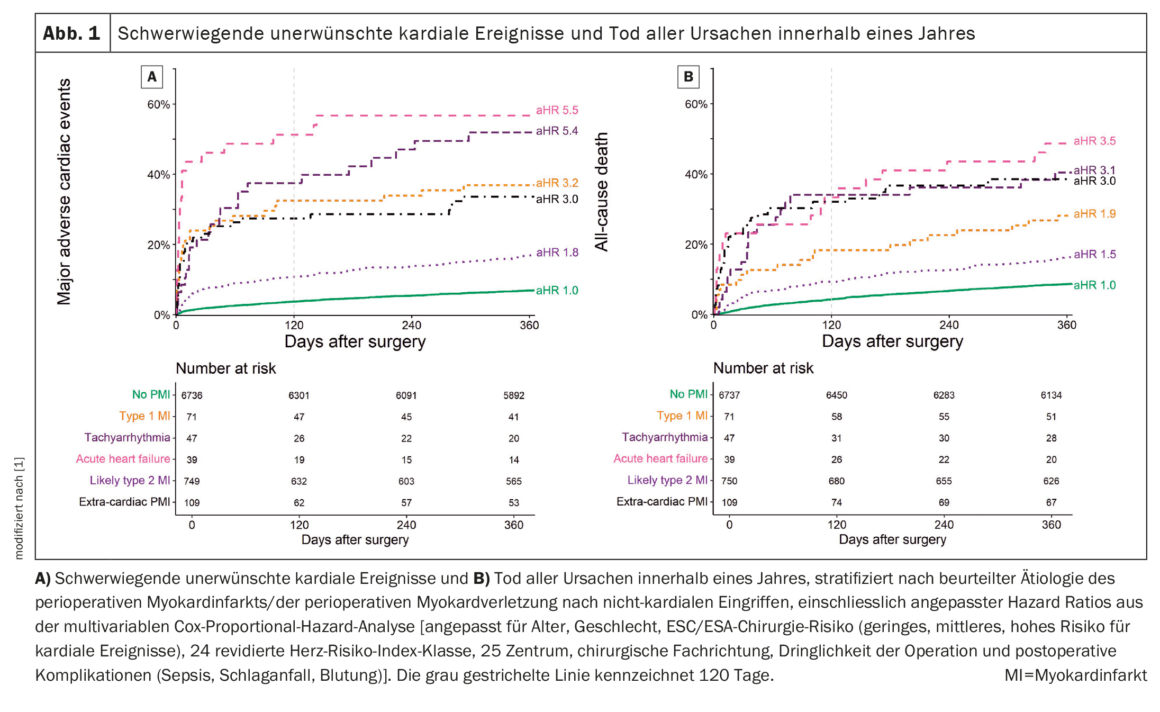
Mortalité totale par PMI
Toutes les étiologies d’IMP ont présenté un taux de mortalité globale à 1 an plus élevé par rapport aux patients sans IMP. Chez les patients sans IMC (9%, IC 95% 8-9%), et au sein des étiologies d’IMC, il y avait des différences significatives (Fig. 1B) [1] : l’IMP extracardiaque, l’IMCT, la tachyarythmie et l’AHF étaient associées à des taux de mortalité élevés [respectivement 38% (IC 95% 29-47), 28% (IC 95% 17-38), 40% (IC 95% 25-53) et 49% (IC 95% 30-62)], et l’IMCT2 était également associée à des taux de mortalité élevés (17%, IC 95% 14-20). Cette relation a été confirmée par l’analyse multivariable.
Modèle de prévision pour lT2MI
Chez 117/750 patients atteints de lT2MI, une MACE ou une mort totale est survenue dans les 120 jours. La présence de douleurs thoraciques ou d’une dyspnée, une augmentation absolue du cTn >2 × 99e percentile par rapport à la valeur initiale, une intervention chirurgicale à haut risque selon le score de risque ESC/ESA pour les interventions chirurgicales et une intervention non élective étaient associées à un risque accru de MACE, tandis que les saignements étaient associés à un risque moindre de MACE. La validation interne a montré une bonne concordance entre les taux d’événements prédits et observés après bootstrapping à 1000 itérations et un score de Brier de 0,16.
Le modèle pronostique a montré une AUC modérée de 0,71 (IC 95% 0,66-0,76). Comparé au RCRI maximal (disponible dans 747/750 cas), à la classe ASA (disponible dans 718/750 cas) et au delta absolu de hs-cTnT (disponible dans 564/750 cas), le modèle pronostique a montré l’AUC numériquement la plus élevée, statistiquement différente de la classe ASA et du delta de hs-cTnT (p=0,003) et comparable au RCRI (p=0,195). La combinaison du modèle pronostique avec la classe ASA ou le RCRI a encore augmenté significativement l’AUC par rapport au RCRI ou à la classe ASA seuls (modèle+ASA 0,75, IC à 95% 0,71-0,80, p<0,001 ; modèle+RCRI 0,75, IC à 95% 0,70-0,80, p<0,001). Après catégorisation par le modèle de pronostic, le groupe lT2MI-PMI à “très haut risque” a présenté un taux de MACE ou de décès de 31% (comparable au PMI de T1MI), tandis que le groupe à “faible risque” a présenté des taux de 7% (comparables aux patients sans PMI).
Taux élevés de MACE et de décès totaux après un an
La grande étude multicentrique internationale prospective a évalué de manière centrale l’étiologie de l’IMP détectée au cours de la surveillance active chez les patients à haut risque subissant une chirurgie non cardiaque majeure, et a suivi de près l’IMP au cours du suivi à long terme. Après un an, la plupart des étiologies de PMI présentent des taux inacceptablement élevés de MACE et de décès totaux, ce qui souligne le besoin urgent de traitements plus intensifs.
Littérature :
- Puelacher C, et al : Long-term outcomes of perioperative myocardial infarction/injury after non-cardiac surgery. EurHeartJ 2023.
https://doi.org/10.1093/eurheartj/ehac798 - Puelacher C, Lurati Buse G, Seeberger D, et al : Perioperative myocardial injury after noncardiac surgery : incidence, mortality, and characterization. Circulation 2018;137 : 1221-1232. https://doi.org/10.1161/CIRCULATIONAHA.117.030114
- Botto F, Alonso-Coello P, Chan MT V, et al.: Myocardial injury after noncardiac surgery: a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology 2014;120: 564–578.
https://doi.org/10.1097/ALN.0000000000000113 - Devereaux PJ, Biccard BM, Sigamani A, et al : Association of post-operative high-sensitivity troponin levels with myocardial injury and 30-day mortality among patients undergoing non-cardiac surgery. JAMA 2017;317 : 1642-1651.
https://doi.org/10.1001/jama.2017.4360 - Landesberg G, Mosseri M, Zahger D, et al : Infarctus du myocarde après chirurgie vasculaire : le rôle de l’ischémie prolongée de type stress-induced, ST depression. J Am Coll Cardiol 2001;37:1839-1845. https://doi.org/10.1016/S0735-1097(01)01265-7
- Landesberg G, Shatz V, Akopnik I, et al.: Association of cardiac troponin, CK-MB, and postoperative myocardial ischemia with long-term survival after major vascular surgery. J Am Coll Cardiol 2003;42: 1547–1554. https://doi.org/10.1016/j.jacc.2003.05.001
- Devereaux PJ, Xavier D, Pogue J, et al.: Characteristics and short-term prognosis of perioperative myocardial infarction in patients undergoing noncardiac surgery: a cohort study. Ann Intern Med 2011;154: 523–528. https://doi.org/10.7326/0003-4819-154-8-201104190-00003
- Devereaux PJ, Chan MT V, Alonso-Coello P, et al.: Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012;307: 2295–2304. https://doi.org/10.1001/jama.2012.5502
- Thygesen K, Alpert JS, Jaffe AS, et al.: Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019;40: 237–269. https://doi.org/10.1093/eurheartj/ehy462.
- Duceppe E, Parlow J, MacDonald P, et al.: Canadian Cardiovascular Society guidelines on perioperative cardiac risk assessment and management for patients who undergo noncardiac surgery. Can J Cardiol 2017;33: 17–32. https://doi.org/10.1016/j.cjca.2016.09.008
- Gualandro DM, Yu PC, Caramelli B, et al.: 3rd guideline for perioperative cardiovascular evaluation of the Brazilian society of cardiology. Arq Bras Cardiol 2017;109: 1–104. https://doi.org/10.5935/abc.20170140
- Halvorsen S, Mehilli J, Cassese S, et al.: 2022 ESC guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J 2022;43: 3826–3924. https://doi.org/10.1093/eurheartj/ehac270.
- Gualandro DM, Campos CA, Calderaro D, et al.: Coronary plaque rupture in patients with myocardial infarction after noncardiac surgery: frequent and dangerous. Atherosclerosis 2012;222: 191–195. https://doi.org/10.1016/j.atherosclerosis.2012.02.021
- Duvall WL, Sealove B, Pungoti C, et al.: Angiographic investigation of the pathophysiology of perioperative myocardial infarction. Catheter Cardiovasc Interv 2012;80: 768–776. https://doi.org/10.1002/ccd.23446
- Sheth T, Natarajan MK, Hsieh V, et al.: Incidence of thrombosis in perioperative and non-operative myocardial infarction. Br J Anaesth 2018;120: 725–733. https://doi.org/10.1016/j.bja.2017.11.063
- Puelacher C, Gualandro DM, Lurati Buse G, et al.: Etiology of peri-operative myocardial infarction/injury after noncardiac surgery and associated outcome. J Am Coll Cardiol 2020;76: 1910–1912. https://doi.org/10.1016/j.jacc.2020.08.043
- Landesberg G, Beattie WS, Mosseri M, et al.: Perioperative myocardial infarction. Circulation 2009;119: 2936–2944. https://doi.org/10.1161/CIRCULATIONAHA.108.828228.
- Howell SJ, Brown OI, Beattie WS: Aetiology of perioperative myocardial injury: a scientific conundrum with profound clinical implications. Br J Anaesth 2020;125: 642–646. https://doi.org/10.1016/j.bja.2020.08.007.
- Hicks KA, Tcheng JE, Bozkurt B, et al.: 2014 ACC/AHA key data elements and definitions for cardiovascular endpoint events in clinical trials. Circulation 2015;132: 302–361.
- Sazgary L, Puelacher C, Lurati Buse G, et al.: Incidence of major adverse cardiac events following non-cardiac surgery. Eur Heart J Acute Cardiovasc Care 2020;10: 550–558. https://doi.org/10.1093/ehjacc/zuaa008.
CARDIOVASC 2023; 22(1): 46–48