La radiothérapie des tumeurs thoraciques, en particulier du cancer du poumon, est tiraillée entre l’objectif d’obtenir la plus grande probabilité de contrôle de la tumeur et celui d’éviter les toxicités. La pneumonie radiogénique est un effet secondaire important. Celle-ci survient avec une latence de plusieurs semaines à plusieurs mois après la fin du traitement.
La radiothérapie des tumeurs thoraciques, en particulier du cancer du poumon, est tiraillée entre l’objectif d’obtenir la plus grande probabilité de contrôle de la tumeur et celui d’éviter les toxicités.
La pneumonie radiogénique est un effet secondaire important. Elle survient avec une latence de plusieurs semaines à plusieurs mois après la fin du traitement, la majorité des cas se manifestant dans les 8 premières semaines post radiationem [1]. Cliniquement, il s’agit souvent d’une triade de symptômes comprenant une dyspnée d’effort, une toux non productive et une hypoxie, qui contribuent à un sentiment de maladie subjectif prononcé chez le patient. Contrairement aux infections bactériennes ou virales, les températures fébriles sont plutôt rares, mais elles peuvent aussi être secondaires à des surinfections. Au cours de la phase aiguë, la morphologie du scanner révèle un œdème interstitiel. Cet état inflammatoire aigu peut ensuite être résolu soit spontanément, soit par une intervention médicamenteuse. Cependant, à long terme, une fibrose du tissu pulmonaire concerné est également possible, avec un rétrécissement consécutif. En fonction de l’importance de ces troubles par rapport aux poumons encore fonctionnels, des troubles restrictifs de la fonction pulmonaire peuvent persister sous forme de résidus irréversibles. Les évolutions mortelles de la maladie sont heureusement rares et sont estimées à moins de 2% dans la littérature [2].
Le mécanisme pathologique sous-jacent de la radiopneumonie n’est pas encore totalement décrypté dans sa complexité. Le système alvéolaire est composé de pneumocytes de type I et II. Alors que les pneumocytes de type I, en tant que cellules différenciées, représentent environ 90% de la surface alvéolaire, les cellules de type II synthétisent le surfactant et servent de pool de repopulation pour les cellules de type I endommagées [3]. La déplétion radio-induite de ces cellules entraîne une perte de la fonction de barrière dans l’alvéole et une diminution de l’intégrité microvasculaire. Ces processus entraînent la formation d’œdèmes et déclenchent, entre autres, la migration des macrophages et la libération de cytokines pro-inflammatoires [4]. Les pneumocytes survivants peuvent également se différencier en myofibroblastes et sécréter du facteur de croissance transformant bêta (TGF-beta), ce qui favorise finalement la formation de fibrose.
Classification des pneumonies
La gravité d’une pneumonie est classée selon les Critères de terminologie commune pour les événements indésirables (CTCAE), version 4.0 : asymptomatique (grade 1) ; symptomatique, nécessitant un traitement médicamenteux, limitant les activités quotidiennes (grade 2) ; symptômes graves, nécessitant de l’oxygène, limitant les activités quotidiennes (grade 3) ou dysfonction respiratoire mettant en jeu le pronostic vital (grade 4). Dans les études cliniques, c’est surtout le risque de pneumonie de grade 2 ou 3 qui est pertinent.
La probabilité de survenue d’une pneumonie, quel qu’en soit le degré, lors du traitement primaire définitif du cancer du poumon avancé est estimée entre 15 et 40% selon les sources bibliographiques [1]. Cependant, cet effet secondaire lié au traitement joue également un rôle dans l’irradiation d’autres entités. Une méta-analyse de Tonison et al. [5] a identifié, par exemple 19 études portant sur 874 patients ayant reçu une radiothérapie pour le traitement d’un cancer de l’œsophage. Le taux de pneumonie de grade ≥2 était de 6,6%. Une analyse rétrospective de Pinnix et al. [6] a enregistré la toxicité pulmonaire de 150 patients ayant subi une radiothérapie de consolidation ou de sauvetage incluant le médiastin en raison d’un lymphome. L’incidence indépendante du stade de la pneumonie était de 14%, les grades cliniquement significatifs ≥2 étant observés chez 8% des patients. La radiothérapie adjuvante du cancer du sein peut également entraîner une exposition importante des poumons aux radiations, en particulier lors de l’irradiation élective des ganglions lymphatiques mammaires internes parasternaux. L’essai EORTC 22922/10925 [7] a comparé les résultats thérapeutiques d’une irradiation adjuvante unique de la glande mammaire ou de la paroi thoracique avec un traitement supplémentaire des voies de drainage lymphatique mammaire interne et supraclaviculaire médiale. L’analyse de la toxicité montre une augmentation du taux de pneumonies de 0,7% vs 0,1% (p<0,0012) pour l’irradiation étendue. Même si ces valeurs semblent numériquement faibles, il faut garder à l’esprit que la radiothérapie adjuvante du cancer du sein est une indication standard absolue dans de nombreux centres de radio-oncologie. Rien qu’en Allemagne, 70 000 nouvelles femmes sont atteintes chaque année d’un cancer du sein, dont une grande partie est irradiée dans le cadre du concept de traitement.
Il existe des relations dose-effet tant pour le contrôle des tumeurs que pour les pneumonies radiogéniques. En théorie, les cancers bronchiques de grande taille et localement avancés nécessitent une dose élevée de rayonnement dans le volume cible, mais leur application est également liée à des doses plus élevées dans les tissus pulmonaires sains et à un risque accru de pneumonie. Les radio-oncologues se réfèrent généralement aux données de la revue QUANTEC (Quantitive Analysis of Normal Tissue Effects in the Clinic) pour évaluer la sécurité d’un plan d’irradiation [8]. Dans ce dernier, la littérature sur la réaction aux radiations induite par le traitement sur les tissus normaux a été systématiquement passée en revue. Pour l’évaluation de l’organe à risque qu’est le poumon, il est recommandé de limiter la dose moyenne au poumon à 20 Gy afin de maintenir le taux de pneumonies cliniquement manifestes en dessous de 20%.
Risque sous carboplatine/paclitaxel
Outre ces valeurs de référence dosimétriques, il existe d’autres facteurs de risque liés au patient et au traitement qui sont pertinents. Dans une méta-analyse complète de Palma et al. [2], les données d’un total de 836 patients issus de 12 études ont été incluses et analysées en termes de prédicteurs de la survenue d’une pénoménite de grade ≥2. Tous les patients ont reçu une radiochimiothérapie simultanée lors du diagnostic de NSCLC (non-small cell lung cancer) et la dose médiane appliquée était de 60 Gy. Le volume pulmonaire qui a reçu ≥20 Gy (appelé V20) a été identifié comme un paramètre dosimétrique pertinent. Dans ce cas, l’OR était de 1,03 pour 1 pour cent d’augmentation du V20 (p=0,008). Une augmentation significative du risque a été mise en évidence pour la chimiothérapie combinée simultanée avec les substances carboplatine et paclitaxel (OR 3,33 par rapport à une chimiothérapie avec cisplatine/étoposide, p<0,001). En ce qui concerne l’âge des patients, seule une tendance à un risque accru a été observée (OR 1,24 par décennie de vie, p=0,09). Cependant, l’analyse multivariée a montré que le risque le plus élevé de développer une pneumonie (>50%) était lié à la combinaison d’un âge >65 ans et de l’administration simultanée de carboplatine/paclitaxel.
Dans une comparaison randomisée moderne de deux niveaux de dose pour la radiothérapie du cancer bronchique non à petites cellules (NSCLC), une pneumonite ≥ grade 3 est survenue dans 7% (bras de traitement 60 Gy) et de 4% (bras de traitement 74 Gy) [9]. La survie significativement moins bonne dans le bras à forte dose n’est donc pas expliquée par un taux de pneumonies plus élevé documenté, mais laisse néanmoins supposer une influence des conséquences non enregistrées du traitement en combinaison avec des comorbidités.
Les techniques modernes d’irradiation, en particulier les méthodes de radiothérapie à modulation d’intensité (IMRT), permettent de réduire de manière significative la dose au poumon tout en maintenant une dose constante dans le volume cible par rapport aux planifications conventionnelles conformes à la 3D. Dans une étude prospective de phase 1 menée par Boyle et al. [10] 24 patients ont été traités par IMRT définitive pour un diagnostic de NSCLC avancé et un plan d’irradiation correspondant a été calculé à l’aide d’une technique 3D conforme à des fins de comparaison. Un avantage dosimétrique de l’IMRT a été observé en termes de dose moyenne au poumon (11,9 vs 14,9 Gy, p
La planification du volume cible à l’aide d’un PET/CT au 18F-fluorodésoxyglucose(18F-FDG) constitue une autre possibilité de réduction de la dose dans les tissus normaux sains. Cette méthode est devenue un standard pour le staging du NSCLC et détecte avec une grande sensibilité l’activité biologique d’un primitif, mais aussi d’éventuels ganglions lymphatiques médiastinaux atteints. Dans la planification conventionnelle de l’irradiation, les stations ganglionnaires médiastinales drainantes sont régulièrement irradiées de manière élective, en fonction de la localisation de la tumeur, ce qui entraîne parfois des volumes cibles importants. De même, il est parfois difficile de faire la différence entre une tumeur primaire et une atélectasie consécutive sur l’imagerie TDM conventionnelle (par exemple en cas d’obstruction des voies aériennes), de sorte qu’en cas de doute, les contours sont souvent plus larges.
Une étude de planification italienne [11] a comparé la charge de dose dans les organes à risque pour 18 patients qui devaient recevoir une radiothérapie primaire en raison d’un NSCLC localement avancé. Plusieurs plans de traitement individuels ont été créés pour chaque patient, dont une version ne couvrant que les structures TEP positives et une autre version irradiant également les niveaux de ganglions lymphatiques électifs. Chez 33% des patients, l’imagerie TEP a permis d’obtenir un downstaging, notamment en ne détectant plus d’atteinte médiastinale de Ln. En focalisant la radiothérapie sur les foyers TEP positifs, la dose moyenne reçue par les poumons a été réduite de 20,5 à 15,5 Gy en moyenne. Il en va de même pour le V20, qui est passé de 34 à 26%.
Dans une étude prospective randomisée, Nestle et al. [12]Il s’agit de savoir si la radiothérapie seule des structures TEP positives donne les mêmes résultats oncologiques. Au total, 205 patients atteints de NSCLC localement avancé ont été randomisés pour recevoir une radiochimiothérapie primaire basée sur la TEP ou une planification conventionnelle. Avec un suivi médian de 29 mois, aucun inconvénient de la radiothérapie basée sur le PET n’a été démontré en termes de survie sans progression. Le risque de progression locale à un an n’était même que de 14% contre 29% dans le bras standard (HR 0,57, IC 0,3-1,06). Il est donc sûr d’adapter individuellement le volume cible pour un patient à l’aide du PET-CT et donc, le cas échéant, de le réduire considérablement.
La question qui se pose en fin de compte est de savoir si l’amélioration des paramètres dosismiques se traduit effectivement par une réduction du taux d’expression clinique de la pneumonie. Dans l’étude de comparaison des doses de Bradley et al. mentionnée précédemment, les chercheurs ont constaté que les doses de médicaments étaient plus élevées que les doses d’antibiotiques. [9], l’IMRT ainsi que l’ancienne technique 3D conforme étaient autorisées dans les deux bras. L’IMRT a été utilisée chez des patients présentant des volumes cibles tumoraux plus importants (médiane de 486 vs. 427 ml), mais a été associée à un taux plus faible de pneumonies ≥ grade 3 (3,5% vs. 7,9%) et à une tendance à une survie globale à 2 ans encore meilleure (53,2% vs. 49,4%) [13].
Réduction des marges de sécurité grâce au gating
Une autre innovation technique dans le domaine de la radiothérapie est la mise en œuvre de procédures de gating. Celles-ci permettent, par la détection et/ou la correction de la mobilité respiratoire de la tumeur, de réduire les marges de sécurité pour le volume cible de planification (appelé PTV = Planning Target Volume), qui tient compte non seulement de l’extension clinique d’un primitif, mais aussi des imprécisions de position quotidiennes. Une telle approche est par exemple est possible grâce à une irradiation ciblée en inspiration profonde, souvent désignée dans la littérature par DIBH (Deep Inspiration Breath Hold). Pour réaliser cela, la courbe respiratoire des patients est enregistrée numériquement via un spiromètre ou des scanners de surface et visualisée sur un écran. Un signal visuel ou sonore invite ensuite les patients à prendre une grande inspiration. Si un seuil prédéfini est dépassé, l’air est retenu dans cette position pendant environ 15 secondes. Ce n’est que pendant cette période que l’appareil de traitement, appelé accélérateur linéaire, reçoit l’autorisation d’irradier, les patients pouvant eux-mêmes interrompre le traitement à tout moment. Après une petite “pause respiratoire”, la procédure se poursuit jusqu’à la fin de la séance de traitement quotidienne. Après une courte période d’adaptation, de nombreux patients sont tellement familiarisés avec la manipulation de la procédure qu’ils respirent eux-mêmes au-dessus du seuil au bon moment. Ils apprennent donc en quelque sorte à contrôler eux-mêmes l’irradiation avec leur propre respiration. Une étude comparative de Josipovic et al. [14] a étudié les différences dosimétriques entre le traitement en “respiration libre” et la DIBH pour 10 patients atteints de NSCLC avancé et recevant une radiothérapie primaire. Selon la technique d’irradiation utilisée, la DIBH a permis de réduire significativement la dose moyenne dans les poumons et le V20 d’environ 20% chacun. Dans une autre analyse, le même groupe de travail s’est penché sur la question de savoir si les patients atteints de CBNPC à un stade avancé pouvaient bénéficier d’un traitement avec arrêt respiratoire malgré leur maladie de base et, le cas échéant, d’autres maladies pulmonaires secondaires (par ex. BPCO) [15]. Dans une analyse intermédiaire d’une étude prospective, vous avez conclu qu’environ 70% des patients étudiés étaient capables d’effectuer une DIBH de plus de 20 secondes et bénéficiaient en outre de cette technique sur le plan dosimétrique.
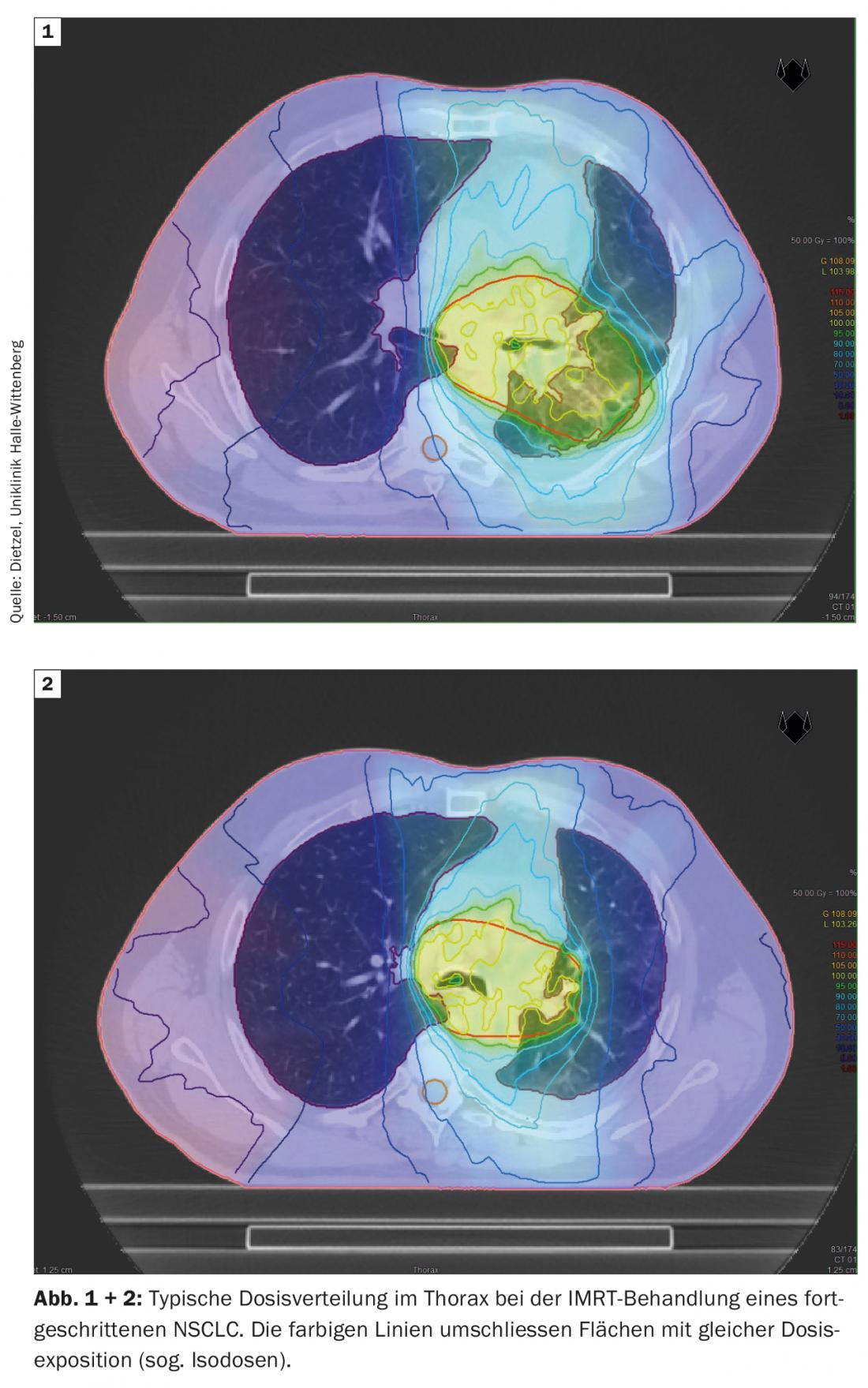
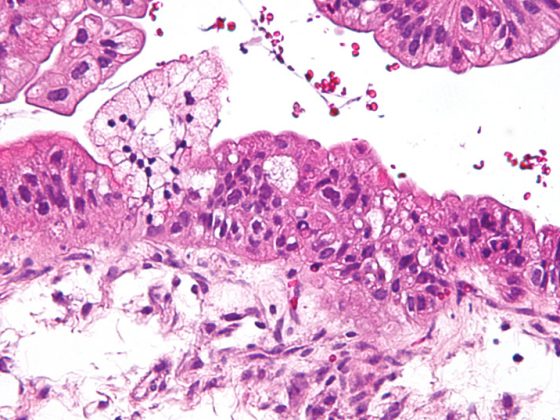
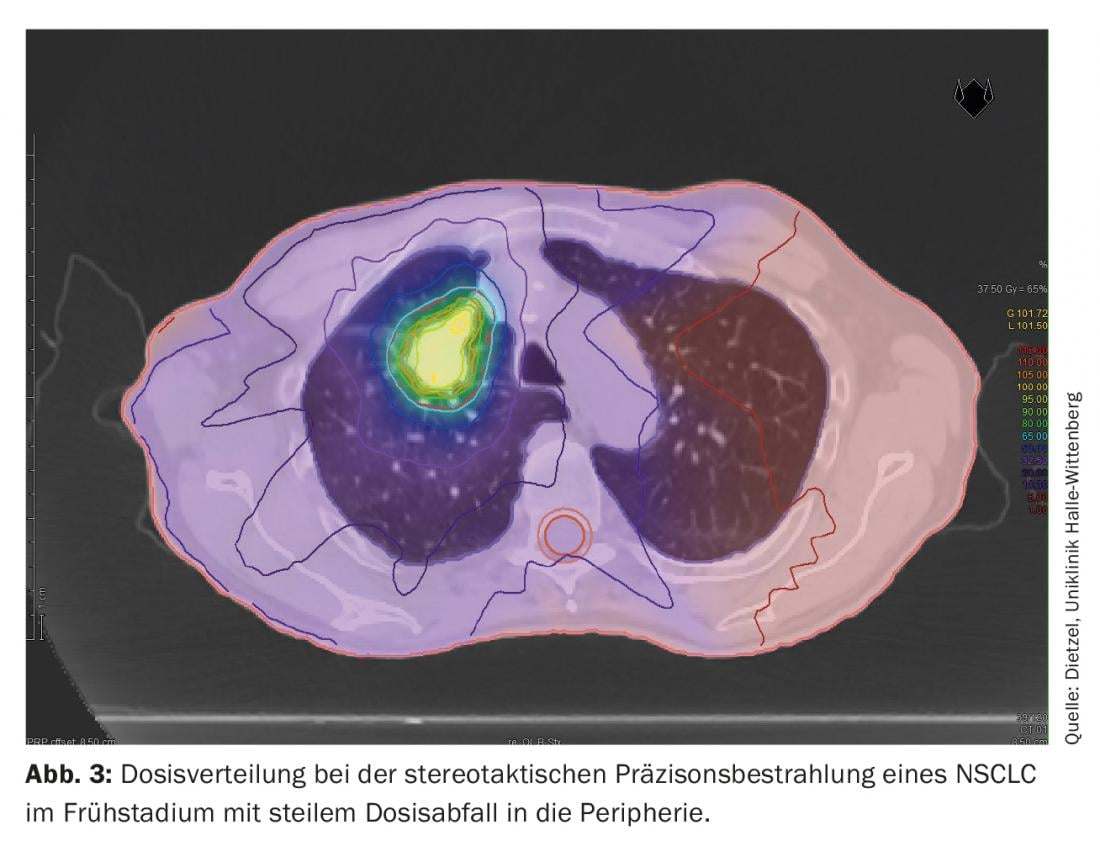
La technique DIBH joue également un rôle décisif dans la radiothérapie adjuvante du cancer du sein, surtout lorsque la tumeur est située du côté gauche, afin d’éviter des doses de rayonnement inutiles dans les organes à risque environnants. Dans ce cas, l’effet de l’insipration profonde est principalement utilisé pour épargner les structures cardiaques en soulevant la paroi thoracique du péricarde et en abaissant le cœur vers la région caudale. Toutefois, l’augmentation et le déplacement du volume ont pour effet secondaire positif de ménager les poumons. Une étude de planification menée par l’Université technique de Munich sur 31 patientes atteintes d’un cancer du sein a montré que la DIBH permettait de réduire la dose moyenne de 19 ± 9% et le V20 de 24 ± 10% pour le poumon gauche [16]. Alors que dans le cas du NSCLC de stade III, de grands volumes pulmonaires sont exposés à des doses élevées et moyennes (figures 1 et 2), dans le cas de la radiothérapie stéréotaxique du NSCLC au stade précoce, seules de petites parties des poumons sont exposées à des doses de rayonnement significatives (Fig. 3), C’est pourquoi la méthode est principalement utilisée chez les patients inopérables en médecine interne, souvent atteints de BPCO de haut grade et parfois d’O2-est utilisée. Même dans ce groupe de patients sélectionnés négativement, les concepts de dose standard n’ont permis d’observer que des taux de pneumonies de grade 2 de 7% et de grade 3 de 2% respectivement [17].
L’immunothérapie ouvre de nouvelles perspectives
L’introduction de l’immunothérapie dans le traitement du NSCLC a ouvert de nouvelles perspectives cliniques au cours des dernières années, qui ont contribué à une amélioration significative du pronostic. L’association séquentielle d’une radiochimiothérapie suivie de durvalumab en première intention, telle qu’elle a été étudiée dans l’essai PACIFIC, a par exemple permis d’obtenir des résultats positifs en termes de survie globale. une amélioration de la survie à 2 ans de 55,6% à 66,3% (p=0,005) a été démontrée [18]. Toutefois, en ce qui concerne la toxicité supplémentaire de l’immunothérapie, on ne dispose actuellement que d’une solide expérience à long terme. L’évaluation de l’essai PACIFIC n’a rapporté qu’un faible taux de pneumonies ≥ grade 3 de 3,4%, contre 2,6% dans le bras contrôle (radiochimiothérapie suivie d’un placebo) [18]. En cas de traitement combiné du NSCLC par radiothérapie et immuno-oncologie, la pneumonie doit être prise en compte en tant que toxicité superposée. Les premières données d’une étude de phase II sur l’administration simultanée de nivolumab et d’une radiochimiothérapie ont montré un taux de pneumonies de grade 3 de 10,3%, jugé acceptable par les auteurs, mais probablement plus élevé que celui d’une radiochimiothérapie seule [19].
Options thérapeutiques
Selon les recommandations sur le traitement de la pneumonie radiogénique du guide S3 actuel “Traitement de soutien chez les patients oncologiques” [20], un traitement par stéroïdes devrait être mis en place. Les schémas posologiques typiques comprennent une dose quotidienne de prednisone de 60-100 mg/jour. initial, qui est réduit progressivement sur une période de 8 à 12 semaines [1]. Il s’agit d’un traitement symptomatique de la phase inflammatoire aiguë de la maladie, qui n’a probablement pas d’influence sur l’expression ultérieure de la fibrose [21]. Après décision au cas par cas (par exemple si le soulagement est insuffisant), l’administration de stéroïdes peut être complétée ou remplacée par de l’azathioprine ou de la ciclosporine. L’administration prophylactique d’antibiotiques n’est recommandée que pour les patients présentant des facteurs de risque (par ex. immunosuppression, processus de sténose, etc.). Si la fièvre est prononcée, une antibiothérapie calculée peut être administrée. Si celle-ci est sans effet, il convient de rechercher une confirmation microbiologique, par exemple via un lavage bronchique, afin de mettre en place un traitement adapté au résistogramme ou d’exclure une pneumonie fongique. Dans le cadre de la prophylaxie médicamenteuse, on discute de l’administration d’amifostine, qui agit comme un capteur de radicaux libres. Selon la ligne directrice, l’application peut se faire en off-label-use chez les patients dont la radiochimiothérapie est prévue. Il n’existe actuellement aucune option de traitement efficace pour les fibroses préexistantes.
En résumé, la pneumonie radiogénique est un effet secondaire important de la radiothérapie qui, en devenant chronique, peut entraîner une fibrose pulmonaire, même à long terme, pour les patients. Cependant, la connaissance des relations dose-effet pertinentes et des facteurs de risque liés au patient, associée à l’innovation technique constante dans le domaine de la radio-oncologie, a permis de parler d’un risque calculable.
Messages Take-Home
- La pneumonie radiogénique est un effet secondaire important après l’irradiation de tumeurs thoraciques et n’apparaît typiquement qu’après plusieurs semaines ou mois.
- Outre une phase inflammatoire aiguë, une fibrose peut se développer au cours de l’évolution avec des symptômes chroniques associés.
- Outre l’exposition pulmonaire radiogénique (dose pulmonaire moyenne et V20), des facteurs liés au patient (âge, comorbidités) et l’application de thérapies systémiques simultanées ont une influence sur la probabilité d’expression.
- Les techniques modernes de radiothérapie telles que la radiothérapie à modulation d’intensité (IMRT), le gating respiratoire et la planification basée sur le PET permettent de réduire considérablement les doses non souhaitées au niveau des poumons.
Littérature :
- Jain V, et al : Radiation Pneumonitis : Old Problem, New Tricks. Cancers 2018 ; 10 (7).
- Palma DA, et al : Predicting radiation pneumonitis after chemoradiation therapy for lung cancer : an international individual patient data meta-analysis. Int J Radiat Oncol Biol Phys 2013 ; 85 (2) : 444-450.
- Giuranno L, et al : Radiation-Induced Lung Injury (RILI). Front Oncol 2019 ; 9 : 877.
- Citrin DE, et al : Role of type II pneumocyte senescence in radiation-induced lung fibrosis. J Natl Cancer Inst 2013 ; 105 (19) : 1474-1484.
- Tonison JJ, et al : Radiation Pneumonitis after Intensity-Modulated Radiotherapy for Esophageal Cancer : Institutional Data and a Systematic Review. Sci Rep 2019 ; 9 (1) : 2255.
- Pinnix CC, et al : Predictors of radiation pneumonitis in patients receiving intensity modulated radiation therapy for Hodgkin and non-Hodgkin lymphoma. Int J Radiat Oncol Biol Phys 2015 ; 92 (1) : 175-182.
- Matzinger O et al : Toxicité à trois ans avec et sans irradiation de la chaîne ganglionnaire mammaire interne et supraclaviculaire médiale dans le cancer du sein de stade I à III (EORTC trial 22922/10925). Acta Oncol 2010 ; 49 (1) : 24-34.
- Bentzen, et al : Analyses quantitatives des effets sur les tissus normaux en clinique (QUANTEC) : une introduction aux questions scientifiques. Int J Radiat Oncol Biol Phys 2010 ; 76 (3 Suppl) : 3-9.
- Bradley JD, et al : Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617) : a randomised, two-by-two factorial phase 3 study. Lancet Oncol 2015 ; 16 (2) : 187-199.
- Boyle J, et al : Avantages dosimétriques de la radiothérapie avec modulation d’intensité dans le cancer du poumon localement avancé. Adv Radiat Oncol 2017 ; 2 (1) : 6-11.
- Ceresoli GL, et al : Role of computed tomography and [18F] fluorodeoxyglucose positron emission tomography image fusion in conformal radiotherapy of non-small cell lung cancer : a comparison with standard techniques with and without elective nodal irradiation. Tumori 2007 ; 93 (1) : 88-96.
- Nestle U, et al : Imaging-based target volume reduction in chemoradiotherapy for locally advanced non-small-cell lung cancer (PET-Plan) : a multicentre, open-label, randomised, controlled trial. Lancet Oncol 2020 ; 21 (4) : 581-592.
- Chun SG, et al : Impact de la technique de radiothérapie à intensité modulée pour le cancer du poumon non à petites cellules localement avancé : une analyse secondaire de l’essai clinique randomisé NRG Oncology RTOG 0617. J Clin Oncol 2017 ; 35 (1) : 56-62.
- Josipovic M, et al : Deep inspiration breath hold radiotherapy for locally advanced lung cancer : comparison of different treatment techniques on target coverage, lung dose and treatment delivery time. Acta Oncol 2013 ; 52 (7) : 1582-1586.
- Persson GF, et al : Deep Inspiration Breath Hold Compliance in Radiation Therapy for Locally Advanced Lung Cancer. Int J Radiat Oncol Biol Phys 2017 ; 99 (2) : Supplément 2017 : E491.
- Oechsner M, et al : Deep inspiration breath-hold for left-sided breast irradiation : Analysis of dose-mass histograms and the impact of lung expansion. Radiat Oncol 2019 ; 14 (1) : 109.
- Guckenberger M, et al : Y a-t-il une limite inférieure de la fonction pulmonaire de prétraitement pour la radiothérapie stéréotaxique corporelle sûre et efficace pour le cancer du poumon non à petites cellules au stade précoce ? J Thorac Oncol 2012 ; 7 (3) : 542-551.
- Antonia SJ, et al : Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. N Engl J Med 2018 ; 379 (24) : 2342-2350.
- Peters S, et al : Safety evaluation of nivolumab added concurrently to radiotherapy in a standard first line chemo-radiotherapy regimen in stage III non-small cell lung cancer-The ETOP NICOLAS trial. Lung Cancer 2019 ; 133 : 83-87.
- Programme de lignes directrices en oncologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF) : Supportive Therapie bei onkologischen PatientenInnen – Langversion 1.3, 2020, numéro de registre AWMF : 032/054OL, www.leitlinienprogramm-onkologie.de/leitlinien/supportive-therapie ; dernier accès : 24.08.2020.
- Sekine I, et al : Analyse rétrospective du traitement par stéroïdes pour les lésions pulmonaires induites par les radiations chez les patients atteints de cancer du poumon. Radiother Oncol 2006 ; 80 (1) : 93-97.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2020 ; 2(4) : 6-10