La thromboembolie veineuse (TEV) est la troisième maladie cardiovasculaire la plus fréquente en Europe centrale. Elles se manifestent dans environ deux tiers des cas par une thrombose veineuse profonde et dans environ un tiers des cas par les symptômes d’une embolie pulmonaire. Pendant l’âge de la reproduction, les femmes sont plus susceptibles de subir des événements de TEV que les hommes du même âge.
La thromboembolie veineuse (TEV) est la troisième maladie cardiovasculaire la plus fréquente en Europe centrale. Elles se manifestent dans environ deux tiers des cas par une thrombose veineuse profonde et dans environ un tiers des cas par les symptômes d’une embolie pulmonaire. Pendant l’âge de la reproduction, les femmes sont plus susceptibles de subir des événements de TEV que les hommes du même âge. Cela est essentiellement dû à des facteurs de risque spécifiques aux femmes, tels que l’utilisation de contraceptifs hormonaux et les grossesses. Malgré cette augmentation relative du risque, le risque global de TEV reste faible, de l’ordre de 2 à 5 pour 10 000 femmes par an [1].
Hormones et hémostase
Les œstrogènes ont une influence sur l’expression des gènes hépatiques et déplacent l’équilibre entre les facteurs coagulants et anticoagulants vers une coagulabilité accrue. Le niveau de la dose d’œstrogènes et le type de progestatif dans les préparations combinées déterminent le risque de complications thrombotiques. La prise de préparations hormonales permet de mettre en évidence une augmentation de l’activité des facteurs thrombogènes (fibrinogène, prothrombine, facteur VII, facteur VIII, facteur X) et une réduction de l’activité des inhibiteurs physiologiques de la coagulation (antithrombine, protéine S, Tissue Factor Pathway Inhibitor [TFPI]) [2,3]. Il en résulte une résistance à la protéine C activée (dite résistance acquise à l’APC). Le degré de cette résistance à l’APC est en corrélation avec le risque de TEV [4].
Contraceptifs hormonaux combinés
Les contraceptifs hormonaux combinés (CHC) représentent la plus grande partie des méthodes de contraception utilisées. Quelques années seulement après sa mise sur le marché en 1960, on savait déjà que les AC augmentaient le risque de thrombose veineuse et, dans une moindre mesure, de thrombose artérielle [5]. La composition de l’IRC a évolué au cours des 60 dernières années, mais les composants de base restent inchangés. Les CHC modernes contiennent une combinaison d’un œstrogène (généralement de l’éthinylestradiol à une dose de 20 à 35 µg) et d’un progestatif de synthèse. La composition détermine alors l’ampleur de l’augmentation du risque d’événements thromboemboliques (tableau 1). Parmi les CHC, les préparations contenant une faible dose d’œstrogènes et du lévonorgestrel comme progestatif présentent le plus faible risque de TEV [6,7]. Avec d’autres composants progestatifs, le risque de TEV est parfois significativement plus élevé. Un risque accru de thrombose a été décrit non seulement pour les CHC administrés par voie orale, mais aussi pour les préparations combinées utilisées par voie transdermique et transvaginale [8].

Le risque de thromboembolie est le plus élevé au cours des premiers mois d’utilisation et diminue considérablement au cours de la première année. Mais même en cas d’utilisation à long terme, le risque de TEV reste environ 2 fois plus élevé pour les femmes qui utilisent un CHC par rapport aux femmes qui n’utilisent pas de contraception hormonale [9]. Si la contraception hormonale est interrompue pendant plusieurs semaines, la reprise entraîne à nouveau un risque temporairement plus élevé de TEV que la prise continue. Il ne semble donc pas judicieux d’interrompre les AC en période périopératoire pour réduire le risque de TEV. En cas de risque élevé de TEV, il est donc préférable de recourir à une prophylaxie médicamenteuse de la TEV avec une héparine de bas poids moléculaire ou une autre substance approuvée pour l’indication [1].
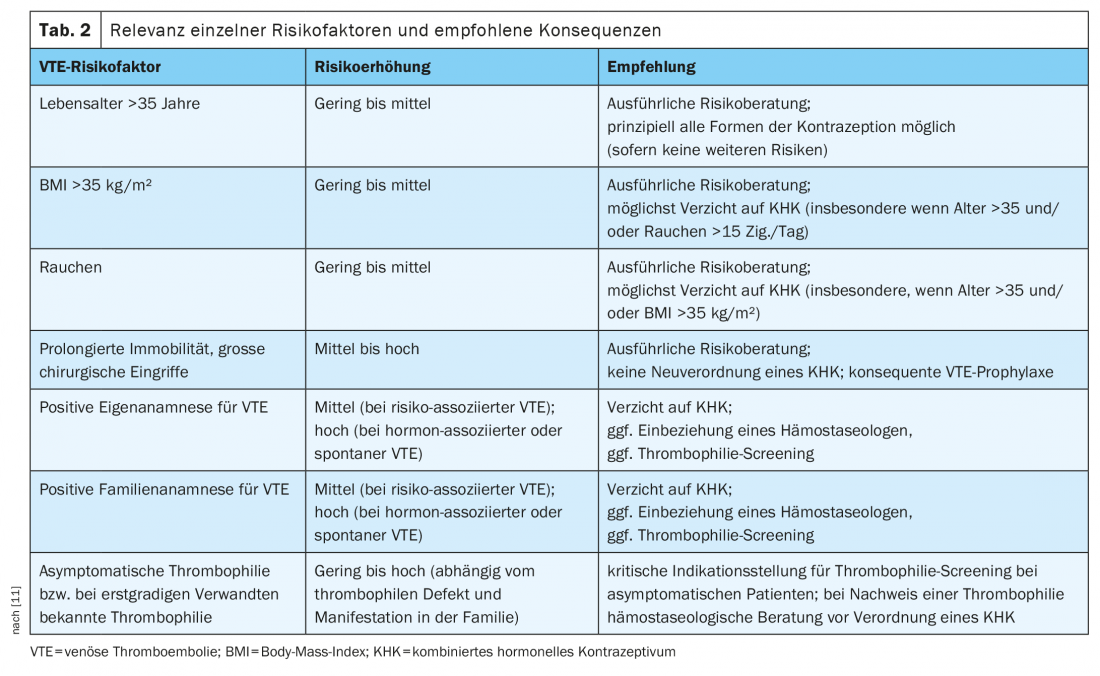
En présence de facteurs de risque supplémentaires (par ex. thrombophilie héréditaire, antécédents familiaux positifs, âge avancé, obésité, tabagisme), le risque de TEV augmente encore [10]. Le risque individuel de TEV doit être évalué lors de toute nouvelle prescription d’un CHD par une collecte minutieuse des antécédents médicaux. Le guide S3 de l’AWMF sur la contraception hormonale, récemment mis à jour, recommande d’inclure dans l’évaluation du risque des facteurs tels que l’âge, l’indice de masse corporelle, le statut tabagique, la mobilité réduite, les opérations chirurgicales majeures à venir, les informations sur les antécédents personnels et familiaux d’événements de TEV et une éventuelle thrombophilie connue [11]. Le tableau 2 donne un aperçu des facteurs de risque et des conséquences recommandées.
Thrombophilie héréditaire et contraception hormonale
La question de savoir si une seule anamnèse familiale positive constitue une contre-indication à la contraception hormonale est controversée. Certaines études ont pu montrer qu’une thrombophilie héréditaire associée à la prise d’un AVK augmentait significativement le risque relatif de TEV [12,13]. Il existe aujourd’hui un consensus sur le fait qu’un dépistage généralisé de la thrombophilie avant la prescription initiale d’un AC n’est pas utile. Au moins une thrombophilie héréditaire peut être détectée chez 3 à 9% de la population d’Europe centrale (tableau 3). Les cas les plus fréquents sont l’hétérozygotie pour une mutation du facteur V Leiden (environ 2-7%) ou une mutation de la prothrombine G20210A (environ 1-2%). Malgré la prévalence élevée de ces mutations, le risque absolu de TEV chez les personnes concernées est faible, à moins que d’autres facteurs de risque ne s’y ajoutent.

Un travail français récent, incluant 2214 parents issus de 651 familles ayant une thrombophilie héréditaire connue et des manifestations de TEV, a calculé un risque annuel absolu de TEV de 0,36% (HR 1,91 ; IC à 95% 1,30-2,80) pour les personnes ayant une thrombophilie légère, mais sans antécédents personnels de TEV, et de 0,64% (HR 3,78 ; IC à 95% 2,50-5,73) pour les personnes ayant une thrombophilie sévère. [14]. Cependant, le risque de TEV augmente considérablement en cas de prise d’un CHD.
Un autre groupe de travail a calculé que l’utilisation de l’AC chez les femmes présentant une mutation du facteur V de Leiden augmentait jusqu’à 45 fois le risque relatif de TEV [15]. Il est donc préférable de ne pas prescrire d’AVK aux femmes présentant une thrombophilie et des antécédents familiaux positifs, en particulier si le patient index a subi un événement de TEV à un jeune âge sans autre facteur de risque ou associé à une hormone. Si la prescription d’un CHC est inévitable en raison de circonstances concomitantes ou de comorbidités, il convient d’envisager un bilan d’hémostase et la prescription d’un CHC contenant du lévonorgestrel comme composant progestatif. En cas de thrombophilie sévère connue, il convient de renoncer à l’AC ; dans ces cas, la préférence doit être donnée à une méthode de contraception sans œstrogènes.
Monoparticules de progestatif
Dans l’état actuel des connaissances, les contraceptifs contenant uniquement un progestatif (c’est-à-dire les préparations orales contenant du désogestrel ou du lévonorgestrel ou les dispositifs intra-utérins contenant du lévonorgestrel) n’augmentent pas significativement le risque de TEV. Ils peuvent donc être utilisés chez les femmes présentant un risque accru de TEV ou ayant des antécédents de TEV [1,16]. Cela ne s’applique toutefois pas à l’acétate de médroxyprogestérone à libération prolongée (DMPA ; injection dite de 3 mois), pour lequel un risque de TEV environ 3 fois plus élevé a été décrit [17]. L’administration de DMPA devrait donc être évitée chez les femmes présentant un risque accru de TEV.
Contraception sous anticoagulation
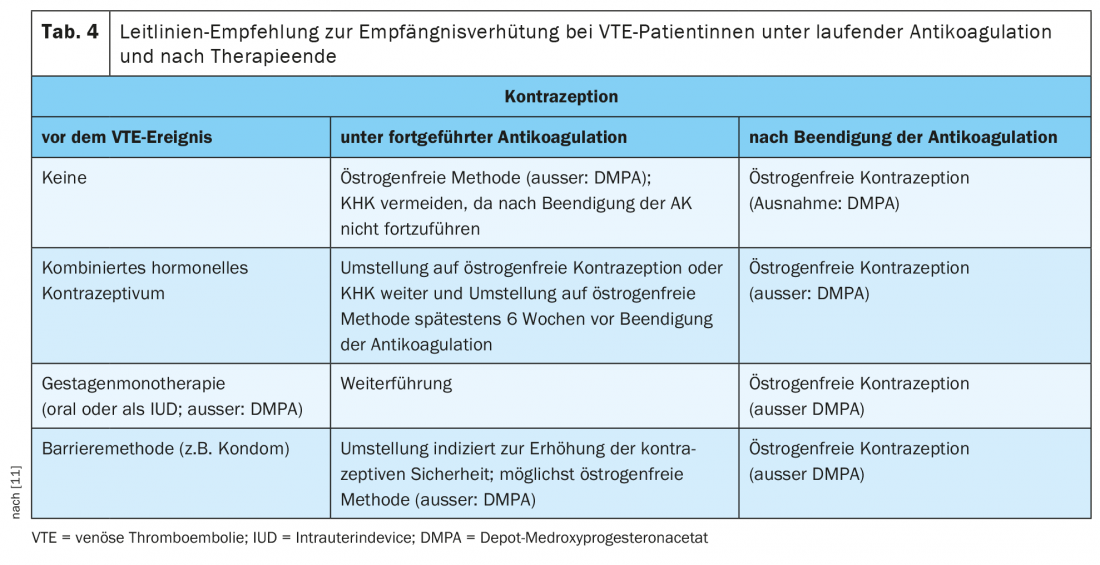
Souvent, les femmes atteintes d’une TEV associée aux hormones arrêtent de prendre leur contraceptif immédiatement après la confirmation du diagnostic. Ceci est -problématique dans la mesure où l’arrêt entraîne une hémorragie de rupture qui peut être plus importante sous anticoagulants plus fortement dosés en phase initiale (apixaban, rivaroxaban) ou en cas de chevauchement d’anticoagulation (NMH plus antagoniste de la vitamine K [VKA]) que pendant la phase de traitement d’entretien. En outre, le risque de grossesse non désirée augmente. Le guide S3 actuel de l’AWMF préconise une contraception sûre pour toutes les femmes sous traitement anticoagulant oral [11], car les anticoagulants oraux directs (AOD) et les AVK sont tous deux placentaires et donc potentiellement embryotoxiques. Selon les estimations actuelles, l’effet prothrombogène de l’AC est compensé par une anticoagulation entièrement thérapeutique, de sorte que la poursuite de la contraception avec un AC sous anticoagulation est considérée comme sans danger.
Une analyse post-hoc en sous-groupe des études EINSTEIN-DVT et EINSTEIN-PE, comparant le risque de récidive chez les femmes avant l’âge de 60 ans avec et sans traitement hormonal continu, n’a pas mis en évidence de taux accru de récidive de TEV sous traitement hormonal continu (3,7% vs 4,7% ; HR 0,56 ; IC à 95% 0,23-1,39) [18]. Pour minimiser le risque de TEV sous anticoagulation, le guide S3 de l’AWMF recommande une monopréparation progestative (par voie orale ou sous forme de dispositif intra-utérin) ou un stérilet au cuivre comme moyen de premier choix (méthodes dites “sans œstrogènes”). (tableau 4). Si la patiente décide avec son médecin de poursuivre la contraception avec un CHC, il est recommandé de passer à une préparation contenant du lévonorgestrel comme composant progestatif. [11].
TEV hormono-associée et risque de récidive
Selon les évaluations de risque actuelles, les maladies coronariennes sont considérées comme des facteurs de risque faibles et transitoires [19]. Étant donné que la poursuite de la prise de CHC après l’arrêt de l’anticoagulation s’accompagne d’un risque présumé élevé de récidive, les CHC doivent être arrêtés ou remplacés par une contraception sans œstrogènes au moins 6 semaines avant l’arrêt prévu de l’anticoagulation.
En principe, après un premier événement de TEV, les femmes ont un risque de récidive plus faible que les hommes du même âge. 5,3% des femmes ont une récidive dans l’année et 11,1% dans les 5 ans. Le risque de récidive est plus faible après une TEV hormonale qu’après une TEV spontanée (HR 0,5 ; IC 95% 0,3-0,8) [20]. Les études de cohorte rapportent un risque annuel absolu de 1,1 à 2,5% [21–23]. En revanche, le risque moyen d’hémorragie sous anticoagulation à dose fixe est d’environ 1-3% par an [24]. Certaines études font même état d’un risque plus élevé d’hémorragies graves et cliniquement significatives chez les femmes par rapport aux hommes [10].
Par conséquent, après avoir évalué les bénéfices et les risques, l’anticoagulation est généralement limitée à 3-6 mois après une TEV associée à une maladie coronarienne et en l’absence de facteurs de risque persistants. Si une contraception a été poursuivie avec un CHC, il faut veiller à la remplacer par une méthode contraceptive sans œstrogènes au moins 6 semaines avant l’arrêt prévu de l’anticoagulation.
Techniques de reproduction assistée et risque de TEV
La proportion de grossesses dues aux techniques de procréation assistée (PMA) a augmenté ces dernières années. L’hormonothérapie nécessaire à cet effet augmente le risque de TEV. Ainsi, les femmes dont la grossesse est survenue après une fécondation in vitro (FIV) ont un risque environ 2 fois plus élevé que les femmes dont la grossesse est survenue spontanément [25,26]. Une analyse suédoise basée sur la population et portant sur 140 458 enregistrements de 1990 à 2008 a révélé un risque absolu de TEV de 0,42% pour les femmes enceintes ayant subi un traitement par FIV, contre 0,25% pour les femmes dont la grossesse a débuté spontanément (HR 1,77 ; IC à 95% : 1,41-2,23). Le risque de TEV est resté plus élevé tout au long de la grossesse, mais a été le plus élevé au 1er trimestre (HR 4,22 ; IC à 95% 2,46 -7,26) [25]. Il est particulièrement élevé (1- 4%) pour les femmes qui développent un syndrome d’hyperstimulation ovarienne (SHO) sévère au cours de l’évolution [27,28].
Traitement hormonal substitutif et risque de TEV
Le traitement hormonal substitutif (“hormone replacement therapy”, HRT) est utilisé pour traiter les troubles et les maladies de la ménopause dus à une carence en œstrogènes. Le THS ne vise pas à maintenir les niveaux d’hormones actuels, mais à éliminer les symptômes tels que les bouffées de chaleur, les troubles du sommeil, l’humeur dépressive ou les troubles urogénitaux dus à l’atrophie des muqueuses en utilisant la dose efficace la plus faible. Étant donné qu’une monothérapie par œstrogènes est associée à un risque accru de cancer de l’endomètre, on utilise généralement des préparations combinées.
Les préparations à base d’œstrogènes en monothérapie et les préparations à base d’œstrogènes et de progestatifs en association sont toutes deux associées à un risque de TEV environ 2 à 3 fois plus élevé [29]. Une augmentation du risque d’environ 4 fois a même été décrite pour les femmes ayant des antécédents de TEV [30,31]. Comme pour la contraception hormonale, le risque de TEV augmente avec la dose d’œstrogènes et en fonction de la composante progestative (figure 1). Le risque est le plus élevé au cours de la première année d’utilisation et reste élevé pendant toute la durée de la prise. Elle augmente avec l’âge et l’obésité. Contrairement à la maladie coronarienne, le risque ne semble pas être augmenté en cas d’application transdermique [32,33].

Conclusion pour la pratique
Connaissant le risque accru d’événements thromboemboliques, il convient de privilégier une composition présentant le risque de thrombose connu le plus faible lorsqu’un CHD est prescrit. En outre, toute femme utilisant un CHC devrait être informée du risque accru de thromboembolie. Il en va de même pour les femmes qui ont recours à la procréation médicalement assistée ou qui doivent suivre un THS à la ménopause. Avant toute prescription, il convient de rechercher d’autres facteurs de risque individuels tels que des antécédents personnels ou familiaux de thrombose veineuse ou artérielle, une thrombophilie connue, le tabagisme ou l’obésité. La femme doit également être informée des signes qui peuvent indiquer une thrombose ou une embolie pulmonaire, afin qu’elle puisse se rendre immédiatement chez un médecin en cas de symptômes.
Messages Take-Home
- Un traitement associant un œstrogène et un progestatif augmente le risque thromboembolique, l’ampleur de l’augmentation du risque dépendant de la dose d’œstrogène ainsi que du composant progestatif.
- Le risque de TEV est le plus élevé au cours de la première année d’utilisation, mais il reste plus élevé par la suite par rapport aux femmes qui ne prennent pas de CHC.
- Les progestatifs en monothérapie (par voie orale ou sous forme de DIU) n’augmentent pas le risque de thrombose dans l’état actuel des connaissances.
- Les directives actuelles recommandent une contraception sûre en cas de TEV avérée ; la poursuite de la prise de CHD est possible tant que la patiente est sous anticoagulation thérapeutique complète.
- Après un événement de TEV associé à une hormone, le risque de récidive est faible si le traitement par une association médicamenteuse a été interrompu avant la fin de l’anticoagulation.
Littérature :
- Rott H : Pilules contraceptives et risques thrombotiques : Differences of Contraception Methods with and without Estrogen. Hamostaseologie 2019 ; 39(1) : 42-48 ; doi : 10.1055/s-0039-1677806.
- Tchaikovski SN, Rosing J : Mécanismes de la thromboembolie veineuse induite par les œstrogènes. Thrombosis Research 2010 ; 126(1) : 5-11 ; doi : 10.1016/j.thromres.2010.01.045.
- Oger E, Alhenc-Gelas M, Lacut K, et al : Effets différentiels des régimes oraux et transdermiques d’œstrogène/progestérone sur la sensibilité à la protéine C activée chez les femmes ménopausées : un essai randomisé. Arterioscler Thromb Vasc Biol 2003 ; 23(9) : 1671-1676 ; doi : 10.1161/01.ATV.0000087141.05044.1F.
- Tans G, van Hylckama Vlieg A, Thomassen MCLGD, et al : Activated protein C resistance determined with a thrombin generation-based test predicts for venous thrombosis in men and women. Br J Haematol 2003 ; 122(3) : 465-470 ; doi : 10.1046/j.1365-2141.2003.04443.x.
- Tyler ET : Contraception orale et thrombose veineuse. JAMA 1963 ; 185(2) : 131 ; doi : 10.1001/jama.1963.03060020091034.
- Dragoman MV, Tepper NK, Fu R, et al : A systematic review and meta-analysis of veinous thrombosis risk among users of combined oral contraception. Int J Gynaecol Obstet 2018 ; 141(3) : 287-294 ; doi : 10.1002/ijgo.12455.
- Bastos M de, Stegeman BH, Rosendaal FR, et al : Contraceptifs oraux combinés : thrombose veineuse. Cochrane Database Syst Rev 2014 ; (3) : CD010813 ; doi : 10.1002/14651858.CD010813.pub2.
- Lidegaard O, Nielsen LH, Skovlund CW, et al : Thrombose veineuse chez les utilisatrices de contraception hormonale non orale : étude de suivi, Danemark 2001-10. BMJ 2012 ; 344 : e2990 ; doi : 10.1136/bmj.e2990.
- Lidegaard Ø, Nielsen LH, Skovlund CW, et al. : Risk of venous thromboembolism from use of oral contraceptives containing different progestogens and oestrogen doses : Danish cohort study, 2001-9. BMJ 2011 ; 343 : d6423 ; doi : 10.1136/bmj.d6423.
- Bistervels IM, Scheres LJJ, Hamulyák EN, et al : Sex matters : Practice 5P’s when treating young women with veinous thromboembolism. J Thromb Haemost 2019 ; 17(9) : 1417-1429 ; doi : 10.1111/jth.14549.
- Guide S3 de l’AWMF. Contraception hormonale. Numéro de registre AWMF 015/015.
- van Vlijmen EFW, Wiewel-Verschueren S, Monster TBM, et al : Combined oral contraceptives, thrombophilia and the risk of veinous thromboembolism : a systematic review and meta-analysis. J Thromb Haemost 2016 ; 14(7) : 1393-1403 ; doi : 10.1111/jth.13349.
- Wu O, Robertson L, Langhorne P, et al : Oral contraceptives, hormone replacement therapy, thrombophilias and risk of venous thromboembolism : a systematic review. L’étude Thrombosis : Risk and Economic Assessment of Thrombophilia Screening (TREATS) Study. Thromb Haemost 2005 ; 94(1) : 17-25 ; doi : 10.1160/TH04-11-0759.
- Suchon P, Resseguier N, Ibrahim M, et al : Common Risk Factors Add to Inherited Thrombophilia to Predict Venous Thromboembolism Risk in Families. TH Open 2019 ; 3(1) : e28-e35 ; doi : 10.1055/s-0039-1677807.
- Hugon-Rodin J, Horellou MH, Conard, J et al : Type de contraceptifs combinés, mutation du facteur V Leiden et risque de thromboembolie veineuse. Thromb Haemost 2018 ; 118(5) : 922-928 ; doi : 10.1055/s-0038-1641152.
- Klok FA, Barco S : Gestion optimale des contraceptifs hormonaux après un épisode de thromboembolie veineuse. Thrombosis Research 2019 ; 181 : S1-S5 ; doi : 10.1016/S0049-3848(19)30357-3.
- van Hylckama Vlieg A, Helmerhorst FM, Rosendaal FR : Le risque de thrombose veineuse profonde associé aux contraceptifs injectables à base d’acétate de médroxyprogestérone à libération prolongée ou à un dispositif intra-utérin au levonorgestrel. Arterioscler Thromb Vasc Biol 2010 ; 30(11) : 2297-2300 ; doi : 10.1161/ATVBAHA.110.211482.
- Martinelli I, Lensing AWA, Middeldorp S, et al : Thromboembolisme veineux récurrent et saignement utérin anormal avec utilisation d’anticoagulants et d’hormonothérapie. Blood 2016 ; 127(11) : 1417-1425 ; doi : 10.1182/blood-2015-08-665927.
- Kearon C, Ageno W, Cannegieter SC, et al : Catégorisation des patients comme ayant un thromboembolisme veineux provoqué ou non provoqué : conseils du SSC de l’ISTH. J Thromb Haemost 2016 ; 14(7) : 1480-1483 ; doi : 10.1111/jth.13336.
- Douketis J, Tosetto A, Marcucci M, et al. Risque de récidive après une maladie thromboembolique veineuse chez les hommes et les femmes : méta-analyse au niveau du patient. BMJ 2011 ; 342 : d813 ; doi : 10.1136/bmj.d813.
- Christiansen SC, Lijfering WM, Helmerhorst FM, et al : Différence sexuelle dans le risque de thrombose veineuse récurrente et le profil de risque pour un deuxième événement. J Thromb Haemost 2010 ; 8(10) : 2159-2168 ; doi : 10.1111/j.1538-7836.2010.03994.x.
- Vaillant-Roussel H, Ouchchane L, Dauphin C, et al : Facteurs de risque de récidive de thromboembolie veineuse associés à l’utilisation de contraceptifs oraux. Contraception 2011 ; 84(5) : e23-30 ; doi : 10.1016/j.contraception.2011.06.008.
- Eischer L, Eichinger S, Kyrle PA : Le risque de récidive chez les femmes souffrant de thromboembolie veineuse alors qu’elles utilisent des œstrogènes : une étude de cohorte prospective. J Thromb Haemost 2014 ; 12(5) : 635-640 ; doi : 10.1111/jth.12528.
- van Es N, Coppens M, Schulman S, et al : Anticoagulants oraux directs comparés aux antagonistes de la vitamine K pour la thromboembolie veineuse aiguë : preuves issues d’essais de phase 3. Blood 2014 ; 124(12) : 1968-1975 ; doi : 10.1182/blood-2014-04-571232.
- Henriksson P, Westerlund E, Wallén H, et al : Incidence de la thromboembolie pulmonaire et veineuse chez les femmes enceintes après une fécondation in vitro : étude intersectionnelle. BMJ 2013 ; 346 : e8632 ; doi : 10.1136/bmj.e8632.
- Rova K, Passmark H, Lindqvist PG : Thromboembolisme veineux en relation avec la fécondation in vitro : une approche pour déterminer l’incidence et l’augmentation du risque dans les cycles réussis. Fertil Steril 2012 ; 97(1) : 95-100 ; doi : 10.1016/j.fertnstert.2011.10.038.
- Sennström M, Rova K, Hellgren M, et al : Thromboembolism and in vitro fertilization – a systematic review. Acta Obstet Gynecol Scand 2017 ; 96(9) : 1045-1052 ; doi : 10.1111/aogs.13147.
- Bates SM, Greer IA, Middeldorp S, et al. : VTE, thrombophilia, antithrombotic therapy, and pregnancy : Antithrombotic Therapy and Prevention of Thrombosis, 9th ed : American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012 ; 141(2 Suppl) : e691S-e736S ; doi : 10.1378/chest.11-2300.
- Canonico M, Plu-Bureau G, Lowe GDO, et al : Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women : systematic review and meta-analysis. BMJ 2008 ; 336(7655) : 1227-1231 ; doi : 10.1136/bmj.39555.441944.BE.
- Cushman M, Kuller LH, Prentice R, et al : Estrogènes plus progestin et risque de thrombose veineuse. JAMA 2004 ; 292(13) : 1573-1580 ; doi : 10.1001/jama.292.13.1573.
- Høibraaten E, Qvigstad E, Arnesen H, et al : Increased risk of recurrent venous thromboembolism during hormone replacement therapy – results of the randomized, double-blind, placebo-controlled estrogen in venous thromboembolism trial (EVTET). Thromb Haemost 2000 ; 84(6) : 961-967.
- Roach REJ, Lijfering WM, Helmerhorst FM, et al : Le risque de thrombose veineuse chez les femmes de plus de 50 ans utilisant une contraception orale ou un traitement hormonal post-ménopausique. J Thromb Haemost 2013 ; 11(1) : 124-131 ; doi : 10.1111/jth.12060.
- Renoux C, Dell’Aniello S, Suissa S : Hormone replacement therapy and the risk of venous thromboembolism : a population-based study. J Thromb Haemost 2010 ; 8(5) : 979-986 ; doi : 10.1111/j.1538-7836.2010.03839.x.
- Mannucci PM, Franchini M : Variants génétiques thrombophiliques classiques. Thromb Haemost 2015 ; 114(5) : 885-889 ; doi : 10.1160/TH15-02-0141.
- Linnemann B, Hart C : Diagnostics de laboratoire dans la thrombophilie. Hamostaseologie 2019 ; 39(1) : 49-61 ; doi : 10.1055/s-0039-1677840.
- www.bfarm.de/DE/Arzneimittel/Pharmakovigilanz/KOK/_node.html ; consulté le : 7.12.2020.
PRATIQUE DU MÉDECIN DE FAMILLE 2021 ; 16(1) : 8-13