La proportion de femmes âgées de 18 à 24 ans vaccinées contre l’HPV stagne autour de 50%. La couverture vaccinale doit être nettement améliorée si l’on veut réduire durablement la circulation du papillomavirus. Une possibilité est par exemple la vaccination prévue des garçons adolescents et des jeunes hommes. La fenêtre jeunesse du schéma de vaccination anti-HPV à deux doses se termine à partir du 15e anniversaire. Après cette fenêtre de jeunesse, trois doses sont nécessaires au lieu de deux. Pourtant, près des deux tiers des infections à HPV sontVaccination effectuée après l’âge de 15 ans, ce qui réduit l’efficacité (un tiers avait déjà eu des rapports sexuels au moment de la vaccination). En outre, le risque de coïncidence temporelle avec des maladies auto-immunes rares augmente avec l’âge.
L’évolution des vaccins contre l’HPV et des méthodes de détection de l’HPV a été marquée par les travaux de recherche sur l’HPV menés par Harald zur Hausen, pour lesquels ce dernier a reçu le prix Nobel de médecine en 2008. Deux vaccins contre l’HPV sont autorisés en Suisse. Ils offrent une protection élevée contre deux (bi-valent, bHPV, 2vHPV) ou quatre types d’HPV (quadri-valent, qHPV, 4vHPV). L’année prochaine (2016), il est prévu de mettre sur le marché un vaccin HPV immunisant contre neuf types de HPV (novem-valent, 9vHPV). Le 4vHPV et le 9vHPV protègent tous deux à >90% contre les condylomes acuminés. Le 9vHPV couvre des types d’HPV oncogènes supplémentaires (appelés types “à haut risque”), bien que leur fréquence varie au niveau international [1] : Ainsi, les types oncogènes 51 (en quatrième position) et 59, relativement fréquents en Suisse, ne sont pas inclus dans le 9vHPV. De plus, les effets secondaires au site d’injection (brûlure/douleur, érythème, gonflement) seraient encore plus fréquents, avec 91% (9vHPV) contre 85% (4vHPV) [2] – les assistants médicaux qui vaccinent devront intensifier leur travail d’information en conséquence.
Le vaccin HPV novem-va^lent ne pourra démontrer sa contribution théorique de 20% maximum à la réduction du cancer du col de l’utérus que s’il remplace complètement les vaccins HPV bi- et quadrivalents et si la couverture vaccinale augmente de manière significative.
Schémas de vaccination
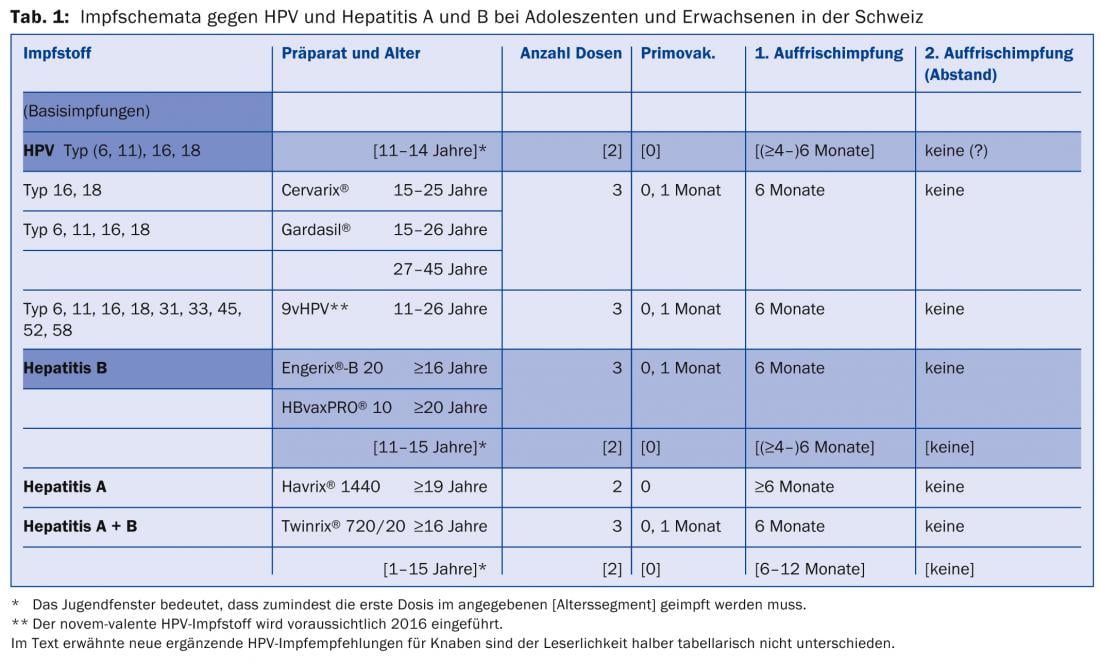
Pour les vaccins contre le HPV, il existe en Suisse un schéma de vaccination à deux doses, avec le début de cette fenêtre d’adolescence dite à deux doses à partir de l’âge de 11 ans jusqu’au 15e anniversaire (date ultime de la première dose ; recommandé depuis février 2012). De la même manière, les schémas à deux doses existent depuis oct. 2000 dans la fenêtre jeunesse pour la vaccination contre l’hépatite B entre le 11e et le 16e anniversaire, et depuis août 2001 pour la vaccination combinée contre l’hépatite A+B entre le 1er et le 16e anniversaire. Il est évident et immunologiquement possible de se faire vacciner contre l’HPV et l’hépatite (A et) B en même temps, en deux sessions à six mois d’intervalle, dans la fenêtre d’adolescence 11-15. Il est recommandé de vacciner les enfants jusqu’à leur 18e anniversaire, à raison d’une injection dans le muscle deltoïde gauche et d’une injection dans le muscle deltoïde droit (tableau 1).
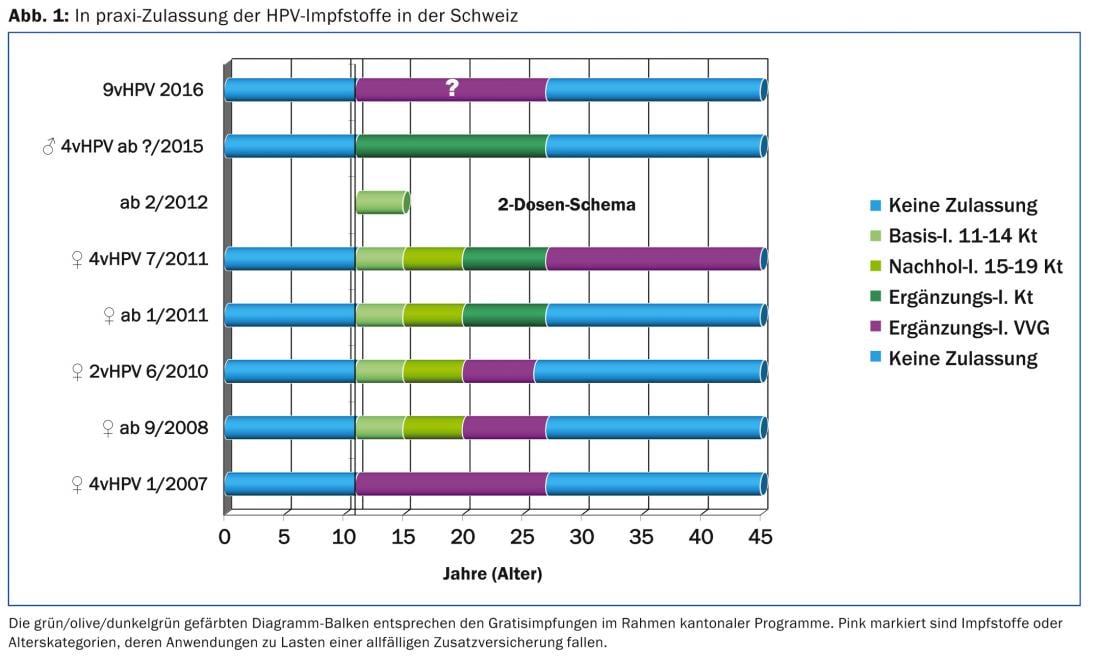
Depuis septembre 2008, les programmes cantonaux offraient la possibilité de vacciner “gratuitement” les jeunes femmes nées entre 1984 et 2003 (figure 1). Une évaluation de la vaccination contre le HPV commandée par l’Office fédéral de la santé publique [3] a montré des taux de couverture vaccinale des 18-24 ans d’un peu plus de 50%. Cela est jugé insuffisant pour réduire la circulation virale des HPV oncogènes de types 16 et 18 et pour protéger également les personnes non immunisées (ce que l’on appelle l’effet de troupeau). Le statut infectieux du partenaire actuel étant le principal facteur de risque de transmission de l’HPV, la vaccination complémentaire contre l’HPV des adolescents et des jeunes hommes prévue cette année, également dans le cadre de programmes cantonaux, ne constitue pas seulement une “équité d’accès” corrigée [4], mais aussi une protection possible contre la transmission du virus. Une étude canadienne [5] a démontré que la prévalence de l’HPV était plus élevée chez les personnes dont les partenaires étaient infectés (85%) que chez les patients dont les partenaires étaient séronégatifs (19%). Les préservatifs exerçaient un effet protecteur plus important chez les hommes que chez les femmes. Dans une étude épidémiologique d’observation américaine, la prévalence de l’HPV était de 38 % malgré l’utilisation systématique du préservatif (test HPV effectué huit mois après la cohabitation) [6]. Bien entendu, le même schéma à deux doses existe pour les garçons dans la fenêtre de l’adolescence, qui constitue le moment optimal pour la vaccination. En théorie, les recommandations suisses en matière de vaccination 2015 distinguent simplement que les vaccins contre le HPV chez les garçons adolescents ne sont pas appelés vaccins de base ou de rattrapage comme chez les filles, mais “vaccins complémentaires”. Pour les vaccins complémentaires, il n’y a pas d’obligation d’atteindre une couverture vaccinale minimale par le biais de campagnes appropriées.
Influence de la vaccination et de la recherche sur les HPV sur le dépistage du cancer du col de l’utérus
Les vaccins bi- et quadrivalents peuvent théoriquement prévenir jusqu’à 70% des cancers du col de l’utérus si la vaccination a lieu avant la cohabitation ; le vaccin HPV novem-valent peut même en prévenir jusqu’à 90% [2]. Comme cette prévention primaire du cancer du col de l’utérus n’offre pas une protection totale, les mesures de prévention secondaire (frottis cervicaux) doivent être poursuivies. Parmi les femmes de moins de 25 ans vaccinées, un quart (25,2 %) déclarent que le frottis de dépistage leur a toujours été recommandé, mais qu’il est moins souvent nécessaire [3]. Bien que ce changement de comportement en matière de dépistage ne fasse pas l’unanimité, il convient de garder à l’esprit que la sensibilité du frottis individuel de Papanicolaou (test de Papanicolaou), qui est de 50 à 70%, pourrait diminuer pour les cohortes de jeunes femmes ayant une couverture vaccinale élevée. Les dysplasies cervicales sévères (appelées HSIL, High-grade Squamous Intraepithelial Lesion) sont diagnostiquées par les cytotechniciens dans environ 0,2% de tous les frottis cervicaux ; une diminution du pourcentage de pathologie positive pourrait avoir pour conséquence la détection de moins de cytologies positives. Une couverture vaccinale maximale peut théoriquement réduire les changements HSIL de 50% (2vHPV et 4vHPV) à 80% (9vHPV) [2], ce qui signifie qu’un seul frottis HSIL positif peut encore être détecté sur 1000 envois.
En outre, le dépistage du col de l’utérus en Suisse doit s’aligner sur les recommandations internationales. Le co-testing du col de l’utérus tous les 5 ans est recommandé de préférence (sociétés américaines de cancérologie/colposcopie/pathologie : ACS, ASCCP, ASCP) à partir de l’âge de 30-65 ans . Le co-testing signifie qu’à partir du même frottis cervical (LBC “liquid based”), on obtient le résultat cytologique (frottis microscopique) et le résultat de biologie moléculaire (test HPV entièrement automatisé). Pour éviter que le co-testing ne déstabilise une femme sur dix (test ADN HPV positif dû par exemple à des infections HPV transitoires, spécificité du test 90%), il faut probablement privilégier les tests ARNm HPV avec une spécificité proche de 95% [7]. Le dépistage de l’HPV et la vaccination contre l’HPV sont les principaux thèmes des congrès internationaux EUROGIN qui ont lieu tous les deux ans. L’auteur, un praticien, a réussi à convaincre son laboratoire étranger, grâce à des informations de congrès et à sa propre publication [8], d’intégrer pour la première fois en Suisse ce test appelé Aptima®-HPV-mRNA dans son programme d’analyse (fig. 2).

La détection du génome du groupe ARNm du papillomavirus est facturée sous la position 3133.00 (54 CHF). Aux États-Unis, le test d’ARNm d’Aptima® HPV a été approuvé par la FDA en octobre 2011 (FDA approved). Ce test détecte spécifiquement les protéines oncogènes E6/E7 de 14 types de HPV à haut risque (16, 18, 31, 33, 35, 45, 51, 56, 58, 59, 66, 68) qui sont surexprimées en raison de la persistance de l’infection, sur la base de la traduction ribosomale de l’ARNm du HPV. Cette dérégulation cellulaire est la conséquence de l’intégration du génome viral dans les noyaux des cellules de l’épithélium cervical basal. Les déplacements possibles par la vaccination au sein des différentes (“high risk”) prévalences de types d’HPV plaident en faveur d’un test ARNm HPV à haut risque avec une large couverture des types, c’est-à-dire incluant les types 51 et 59 non inclus dans le vaccin 9vHPV et relativement fréquents en Suisse.
Messages Take-Home
- Les taux de couverture vaccinale de base et de rattrapage (adolescentes de 11 à 19 ans) contre le papillomavirus humain (HPV) devraient être optimisés depuis 2011 grâce à des programmes cantonaux de vaccination complémentaire pour les femmes de 20 à 26 ans. Malgré cela, la proportion de femmes âgées de 18 à 24 ans vaccinées stagne autour de 50% [3].
- Pour réduire durablement la circulation du papillomavirus et obtenir ainsi un effet grégaire, il faut obtenir une couverture vaccinale plus élevée, par exemple via la vaccination prévue des garçons adolescents et des jeunes hommes.
- Bien que les gynécologues soient les plus nombreux à vacciner contre les HPV, avec 32% de toutes les vaccinations contre les HPV (principalement des vaccinations de rattrapage et complémentaires [3]), et qu’ils suivent cette nouvelle compétence clé, il convient de rappeler que la vaccination contre les HPV est avant tout une Vaccination de base des 11-14 ans et donc, dans 99,5% des cas, avant ou au même moment que le premier rapport sexuel.
- Le fait que près des deux tiers des vaccinations contre le HPV soient effectuées après l’âge de 15 ans réduit d’une part l’efficacité (un tiers des adolescents tardifs avaient déjà eu des rapports sexuels au moment de la vaccination) et présente d’autre part, avec l’âge, un risque de coïncidence temporelle avec des maladies auto-immunes rares comme la sclérose en plaques ou des maladies neurologiques (syndrome de Guillain-Barré) [9]. De plus, le schéma de vaccination contre le HPV après la fenêtre d’adolescence (à partir du 15e anniversaire) nécessite trois doses au lieu de deux.
Dr. med. Daniel Brügger
Littérature :
- Krech T, et al : Papillomavirus humains urogénitaux et chlamydia. Forum Med Suisse 2010 ; 10(12) : 230-232.
- Luxembourg A (CDC/NCIRD) : 9-valent HPV (9vHPV) Vaccine Program Key Results. www.cdc.gov/vaccines/acip/meetings/downloads/slides-2014-10/HPV-02-Luxembourg.pdf
- Mäusezahl-Feuz M : Évaluation de la vaccination contre le HPV. VIIIE CONGRÈS MONDIAL DE LA VACCINATION. Congrès sur la vaccination, 06.11.2014 Bienne.
- Stronski-Huwiler S : Vaccination contre le HPV en Suisse : Girls AND Boys ? VIIIE CONGRÈS DE LA VACCINATION. Congrès sur la vaccination, 06.11.2014 Bienne
- Burchell AN, et al : Influence du statut infectieux du partenaire sur la prévalence du papillomavirus humain chez les personnes ayant un nouveau partenaire sexuel. Sex Transm Dis 2010 ; 37(1) : 34-40.
- Winer RL, et al : Utilisation du préservatif et risque d’infection génitale à papillomavirus chez les jeunes femmes. N Engl J Med 2006 ; 354(25) : 2645-2654.
- Monsonego J, et al : Évaluation des tests d’ARN et d’ADN du papillomavirus humain oncogène avec la cytologie en milieu liquide dans le dépistage primaire du cancer du col de l’utérus : l’étude FASE. Int J Cancer 2011 ; 129(3) : 691-701.
- Brügger D : Que devient le dépistage du cancer gynécologique ? Gynécologie 2010 ; 5 : 6-8.
- Siegrist CA : Maladies auto-immunes après immunisation de l’adolescent ou de l’adulte : à quoi faut-il s’attendre ? CMAJ 2007 ; 177(11) : 1352-1354.
PRATIQUE DU MÉDECIN DE FAMILLE 2015 ; 10(2) : 17-20