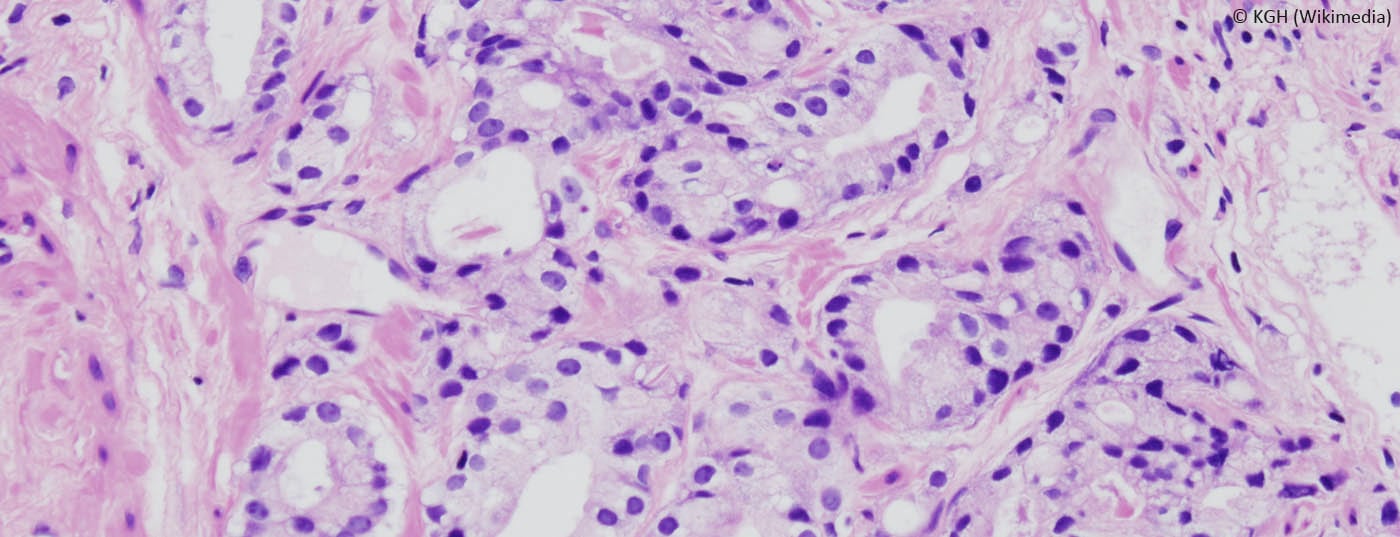
Des études suggèrent que la surveillance active constitue une option thérapeutique pour les tumeurs à faible risque de progression (tumeurs à faible risque). L’équipe soignante doit définir les stratégies de traitement avec le patient sur la base des directives existantes et des preuves actuelles. Dans le cas de la surveillance active, le suivi et le contrôle régulier des patients sont un facteur déterminant de la stratégie thérapeutique. De plus en plus de cancers de la prostate sont diagnostiqués sur la base de la mesure du PSA. Environ 90% de ces tumeurs sont localisées. Une grande partie des tumeurs diagnostiquées ne présentent aucun danger pour les patients concernés ; pour ces patients, le risque de morbidité lié aux interventions est plus élevé que le risque de morbidité lié à la tumeur.
Pour le traitement du carcinome de la prostate à faible risque localisé, il existe différentes options alternatives selon les directives actuelles (S3 Guideline DGU, EAU Guideline on Prostate Cancer) : prostatectomie radicale, radiothérapie locale, surveillance active et, en fonction de l’âge, le concept de watchful waiting. La surveillance active (Active Surveillance, AS) consiste à suivre de près les personnes chez qui une maladie a été diagnostiquée, tout au long de son évolution. La SA doit être distinguée de la Watchful Waiting. Il s’agit de stratégies de traitement symptomatique d’une maladie au cours de son évolution, sans avoir pour objectif de faire passer les patients à un traitement curatif, par exemple en raison de leur âge avancé et/ou de comorbidités graves. La SA se distingue également de la surveillance clinique/de la santé publique, dont l’objectif est de collecter, d’analyser et d’interpréter des données de santé relatives à des populations spécifiques [1].
Surveillance active des cancers à faible risque
L’analyse et l’interprétation des traitements anticancéreux pour des maladies oncologiques sélectionnées chez les hommes ont récemment poursuivi l’objectif d’éviter la surutilisation d’options thérapeutiques invasives (overtreatment). Pour les cancers de la prostate et des testicules en particulier, des critères ont été élaborés qui ne conduisent à aucun traitement immédiat, voire à aucun traitement du tout. Pour les deux entités, les directives de traitement prévoient qu’en plus des options thérapeutiques établies (prostatectomie, radiothérapie, traitement médicamenteux de la tumeur, ablation hormonale, orchidectomie), la SA pour les tumeurs à faible risque (low-risk disease) est une autre option de traitement primaire [2,3]. La décision d’utiliser ou non la SA comme stratégie de traitement est déterminée par la classification de la tumeur comme “à faible risque”.
En prenant l’exemple du cancer de la prostate, nous allons illustrer les difficultés pratiques liées au choix du traitement possible. Des études récentes montrent que la classification des cancers est toujours – malgré de nombreuses années de recherche – marquée par une pratique très hétérogène [4–11]. Par exemple, le taux de patients atteints d’une tumeur à faible risque est passé de 60% en 2004 à 27% en 2013 – sur la base des définitions modifiées des tumeurs à faible risque [12].
Épidémiologie et étiologie
Le cancer de la prostate est le cancer le plus fréquent chez les hommes en Suisse [13]. On constate une incidence différente selon les populations : aux États-Unis, les personnes à la peau foncée sont plus souvent touchées que les Blancs et ces derniers plus souvent que les Asiatiques. Cela suggère une prédisposition génétique au développement du carcinome [9]. Il est probable que la prédisposition génétique soit également influencée et modifiée par des facteurs sociodémographiques [14–16]. Par exemple, l’incidence du cancer de la prostate augmente chez les Asiatiques qui immigrent aux États-Unis. L’incidence des cancers de la prostate cliniquement non significatifs est comparable dans le monde entier, mais il existe des différences pour les cancers de la prostate cliniquement significatifs. Les hommes dont un parent au premier degré est atteint d’un cancer de la prostate ont deux fois plus de risques de développer également un cancer de la prostate. Si plusieurs parents de premier degré sont atteints, le risque est multiplié par 5 à 11 [10,17].
La majorité des cancers de la prostate sont probablement dus à plusieurs polymorphismes génétiques [10]. La testostérone n’est actuellement pas considérée comme un agent précancéreux, mais joue probablement un rôle de promoteur de tumeur dans les tumeurs déjà en progression. Les composants alimentaires ont de nombreux effets sur le cancer de la prostate [18]. Les protéines animales semblent favoriser le risque de développement d’un cancer de la prostate avancé. L’oligo-élément sélénium a longtemps fait l’objet de discussions quant à son éventuel effet protecteur. L’étude SELECT n’a toutefois pas pu démontrer un tel bénéfice et a donc été interrompue prématurément en 2008. Le tabagisme au moment du diagnostic initial augmente le risque de tumeur avancée, de récidive (38 vs 26%) et de décès lié au cancer (15,3 vs 9,6/1000 personnes-années) [15]. Le syndrome métabolique augmente également le risque de cancer de la prostate. Il n’a pas encore été possible d’établir un lien entre le risque de cancer de la prostate et la consommation d’alcool.
Taux élevé de surtraitement
Depuis plus de 30 ans, la prostatectomie radicale est considérée comme le traitement curatif standard du cancer de la prostate ; environ 70% des patients de moins de 70 ans subissent une prostatectomie [8,12]. Cette stratégie est adoptée en partant du principe que le patient est guéri après l’intervention. Ces considérations doivent être de plus en plus relativisées : On estime que 30% des hommes opérés présentent une progression du PSA au cours de l’évolution. Une partie des patients ont des tumeurs qui ne doivent pas nécessairement être traitées par une intervention ; ces patients ne mourraient pas de leur tumeur même sans chirurgie ou radiothérapie. Cependant, les possibilités d’évaluer la biologie individuelle des tumeurs sont encore limitées aujourd’hui. C’est pourquoi l’équipe soignante et le patient choisissent souvent la voie de l’intervention, souvent par crainte que la tumeur n’évolue vers un stade ne pouvant plus être traité de manière curative en raison d’une progression rapide.
Une surveillance active régulière des patients atteints de cancers à faible risque, cliniquement normaux, qui se prêtent à l’AS, peut prévenir les morbidités liées au traitement (dysfonctionnement érectile, incontinence, complications liées à l’opération et à la radiothérapie, etc.) et donc un surtraitement, et est considérée comme sûre dans ce cadre. La charge mentale du patient et de son partenaire sous la direction d’un urologue expérimenté est également considérée comme appropriée [6,18]. L’étude ERSPC a montré un taux de surtraitement de 54%. Éviter à ces hommes les morbidités liées à un traitement interventionnel est le sens de la SA [5].
Critères pour une surveillance active
Les lignes directrices S3 actuelles sur le dépistage, le diagnostic et le traitement des différents stades du cancer de la prostate incluent la SA comme stratégie de traitement pour les cancers à faible risque définis qui répondent à certains critères (tableau 1).

La ligne directrice définit les critères de décision pertinents suivants :
- Les patients atteints d’un cancer de la prostate localisé et éligibles à un traitement curatif local doivent être informés non seulement des procédures de traitement telles que la prostatectomie radicale, la radiothérapie et la curiethérapie, mais aussi de la SA.
- Chez les patients atteints d’un cancer de la prostate localisé et éligibles à un traitement curatif, les effets indésirables et les conséquences thérapeutiques de la prostatectomie radicale, de la radiothérapie percutanée et de la curiethérapie doivent être mis en balance avec le risque d’un traitement retardé en cas de stratégie AS.
- La tumeur doit être contrôlée tous les trois mois au cours des deux premières années suivant le diagnostic par le biais d’un dosage du PSA et d’un toucher rectal numérique. Si le taux de PSA reste stable, un contrôle doit ensuite être effectué tous les six mois. Les biopsies doivent être effectuées tous les 12 à 18 mois. Actuellement, de nouvelles méthodes sont à l’étude pour améliorer la pertinence des biopsies de la prostate (Fig. 1).
- L’AS doit être abandonné si le temps de doublement du PSA est réduit à moins de trois ans ou si le degré de malignité s’aggrave jusqu’à un score de Gleason >6.
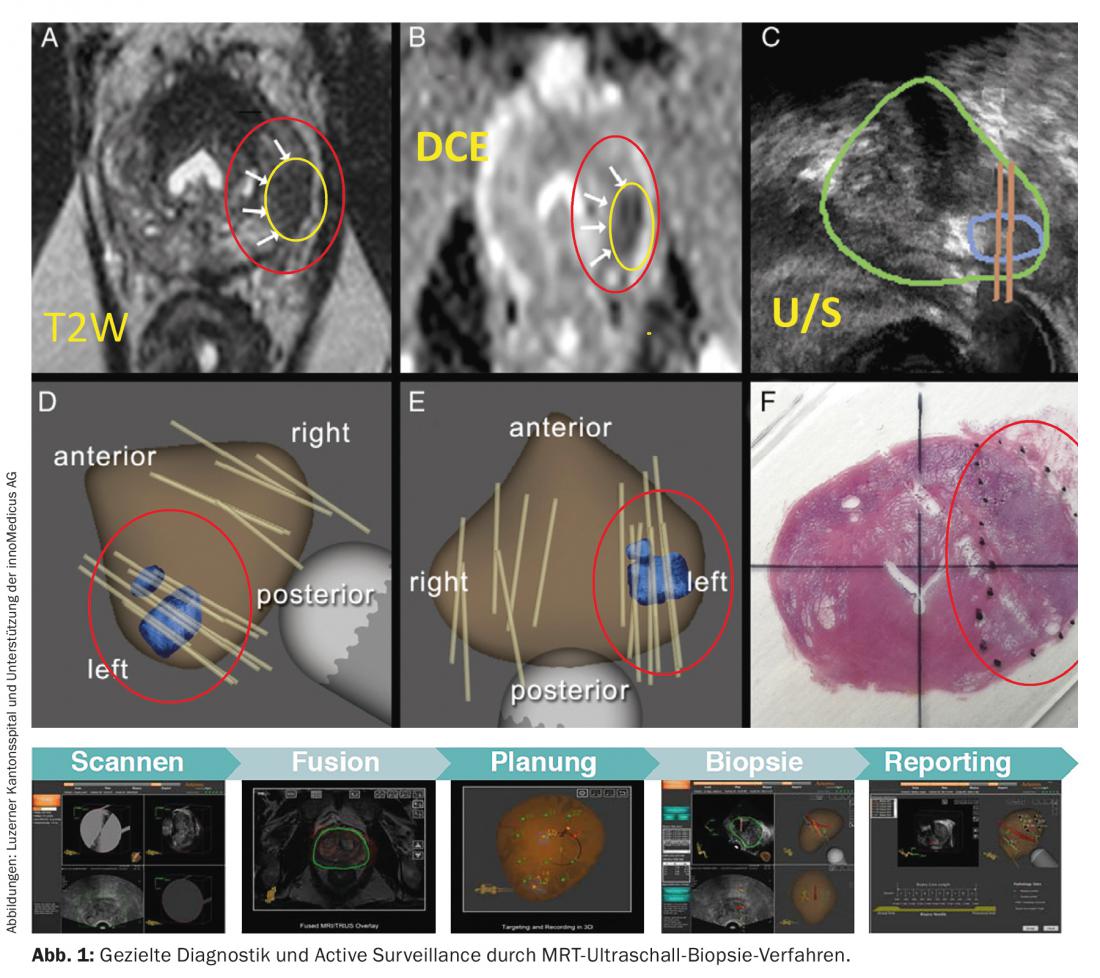
Le degré d’adaptation du traitement au cours de l’évolution individuelle (par exemple prostatectomie radicale ou radiothérapie locale) dépend directement de la dynamique individuelle de la maladie cancéreuse. Chaque patient, informé de toutes les options thérapeutiques, se voit proposer en premier lieu une procédure qui lui permet de vivre, dans un premier temps, les années suivantes avec une qualité de vie élevée et si possible sans les inconvénients liés au traitement. Les centres d’oncologie certifiés contribuent de manière démontrable à garantir la qualité des soins.
Conclusion pour la pratique
- Actuellement, en Suisse, le premier dosage de référence du PSA est recommandé entre 40 et 45 ans.
- Si le taux de PSA est <1 ng/ml, un dosage du PSA est recommandé tous les trois ans, tous les deux ans si le PSA est ≥1 à <2 ng/ml et tous les ans si le PSA est ≥2 à <3 ng/ml . Le patient doit être informé en détail au préalable.
- Les mesures excessives du PSA provoquent le diagnostic d’un nombre croissant de cancers de la prostate qui, autrement, seraient passés inaperçus pendant toute la vie des patients, compte tenu de leur âge, de leurs comorbidités et/ou d’une biologie tumorale favorable.
- Environ 90% des patients diagnostiqués ces dernières années ont un cancer de la prostate localisé.
- Des études suggèrent que la SA constitue une option thérapeutique pour les tumeurs à faible risque de progression (tumeurs à faible risque). Les patients doivent être informés de toutes les options thérapeutiques.
- L’équipe soignante (médecins généralistes, urologues, radio-oncologues, oncologues) doit, sur la base des directives existantes et des preuves actuelles, définir et suivre avec le patient et ses proches les stratégies de traitement, notamment en cas de SA possible.
- La Société Suisse d’Urologie a créé une base de données Active Surveillance (SIP-CAS) afin d’assurer et de développer en permanence les données probantes.
Littérature :
- OMS, Surveillance de la santé publique, 2015. www.who.int/topics/public_health_surveillance/en/.
- Kollmannsberger C, et al : Patterns of relapse in patients with clinical stage I testicular cancer managed with active surveillance. J Clin Oncol 2015 ; 33(1) : 51-57.
- Coursey Moreno C, et al : Tumeurs testiculaires : ce que les radiologues doivent savoir-diagnostic différentiel, staging, et prise en charge. Radiographics 2015 ; 35(2) : 400-415.
- Loeb S, et al : Active Surveillance for Prostate Cancer : A Systematic Review of Clinicopathologic Variables and Biomarkers for Risk Stratification. Urologie européenne 2015 ; 67(4) : 619-626.
- Klotz L : Active Surveillance for Prostate Cancer : Debate over the Application, Not the Concept. European Urology 2015 Jan 24. doi : 10.1016/j.eururo.2015.01.007. [Epub ahead of print]
- Bellardita L, et al : How Does Active Surveillance for Prostate Cancer Affect Quality of Life ? Une revue systématique. Urologie européenne 2015 ; 67(4) : 637-645.
- Bangma CH, et al : Active Surveillance for Low-risk Prostate Cancer : Developments to Date. Urologie européenne 2015 ; 67(4) : 646-648.
- Saman DM, et al : A review of the current epidemiology and treatment options for prostate cancer. Dis Mon 2014 ; 60(4) : 150-154.
- Helfand BT, Catalona WJ : The epidemiology and clinical implications of genetic variation in prostate cancer. Urol Clin North Am 2014 ; 41(2) : 277-297.
- Eeles R, et al : The genetic epidemiology of prostate cancer and its clinical implications. Nat Rev Urol 2014 ; 11(1) : 18-31.
- Berman DM, Epstein J : Quand le cancer de la prostate est-il vraiment un cancer ? Urol Clin North Am 2014 ; 41(2) : 339-346.
- Huland H, Graefen M : Changing Trends in Surgical Management of Prostate Cancer : The End of Overtreatment ? Eur Urol 2015 Feb 27. doi : 10.1016/j.eururo. 2015.02.020. [Epub ahead of print]
- Office fédéral de la statistique, 2015. www.bfs.admin.ch/bfs/portal/de/index/themen/14/02/05/key/01/02.html.
- Kasperzyk JL, et al : Watchful waiting and quality of life among prostate cancer survivors in the Physicians’ Health Study. J Urol 2011 ; 186(5) : 1862-1867.
- Kenfield SA, et al : Smoking and prostate cancer survival and recurrence. JAMA 2011 ; 305(24) : 2548-2555.
- Kenfield SA, et al : Activité physique et survie après un diagnostic de cancer de la prostate dans l’étude de suivi des professionnels de santé. J Clin Oncol 2011 ; 29(6) : 726-732.
- Bratt O : Cancer héréditaire de la prostate : aspects cliniques. J Urol 2002 ; 168(3) : 906-913.
- Masko EM, et al : The relationship between nutrition and prostate cancer : is more always better ? Eur Urol 2013 ; 63(5) : 810-820.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(5) : 8-11