La chirurgie stéréotaxique dans le traitement du syndrome parkinsonien idiopathique est une option thérapeutique prometteuse. État de la recherche, utilisation et principes de base des méthodes de stimulation cérébrale profonde (DBS) et d’ultrasons focalisés guidés par RM (MRgFUS).
L’année dernière, nous avons célébré le bicentenaire de la première description du syndrome de Parkinson par James Parkinson en 1817. Il est impressionnant de constater à quel point le syndrome de Parkinson peut encore être diagnostiqué aujourd’hui sur la base des six cas qu’il a décrits, avec leurs symptômes moteurs et non moteurs respectifs. Cependant, bien que de grands progrès aient été réalisés au cours des dernières décennies dans la recherche sur la physiopathologie du syndrome parkinsonien idiopathique, la cause de la maladie reste à ce jour inconnue et, par conséquent, la maladie ne peut être guérie.
Catégorisation et clinique
Parmi les troubles moteurs, nous distinguons les troubles moteurs hyperkinétiques (tremblements, dystonie, myoclonie, chorée et tic) et les troubles moteurs hypokinétiques, le principal représentant de cette dernière catégorie étant le syndrome de Parkinson. Le syndrome parkinsonien moteur suppose la présence d’une rigidité, de tremblements (typiquement un tremblement de repos qui augmente lors d’une activité cognitive et disparaît lors de l’initiation d’un mouvement) et d’un ralentissement général de type bradykinésie. Cependant, au cours des dernières décennies, nous avons pris conscience que les patients et leurs familles souffraient en outre de symptômes non moteurs. Il s’agit notamment des troubles de l’odorat, des troubles comportementaux du sommeil paradoxal, des troubles autonomes (dysfonctionnement sexuel, troubles urinaires, variations de la pression artérielle, troubles gastro-intestinaux tels que la constipation et le retard de vidange gastrique) et des troubles psychiatriques (dépression, hallucinations, fatigue, etc.) [1].
1% des personnes de plus de 60 ans souffrent d’un syndrome parkinsonien idiopathique ; en Suisse, plus de 15 000 personnes sont touchées par cette maladie [2]. Les personnes âgées sont loin d’être les seules à être atteintes, même si l’âge avancé reste le facteur de risque le plus important pour le syndrome parkinsonien idiopathique. Dans nos consultations pour les troubles du mouvement, nous constatons qu’environ 10% des patients sont atteints avant l’âge de quarante ans.
Diagnostic
Pour des raisons encore inconnues, il se produit notamment une destruction des neurones dopaminergiques, ce qui peut également être objectivé en médecine nucléaire par DaTSCAN-SPECT dans le sens d’un déficit dopaminergique présynaptique. Cependant, en règle générale, le diagnostic est purement clinique et neurologique, basé sur l’anamnèse et après avoir exclu d’autres causes. Au moment où le syndrome parkinsonien moteur se manifeste, plus de 50% des cellules dopaminergiques sont déjà détruites.
Les diagnostics différentiels importants du syndrome parkinsonien idiopathique sont les syndromes parkinsoniens atypiques tels que l’atrophie multisystémique (dans ce cas, on trouve en outre des indices d’une implication d’autres systèmes neurologiques, par exemple sous la forme d’un syndrome des voies pyramidales, d’un syndrome cérébelleux et de troubles autonomes précoces) ainsi que la paralysie visuelle supranucléaire progressive (PSP) et ses différentes sous-formes. Le diagnostic différentiel doit également porter sur une dégénérescence corticobasale. Si le syndrome parkinsonien idiopathique et l’atrophie multisystématisée sont des alpha-synucléinopathies, la PSP ou la dégénérescence corticobasale sont neuropathologiquement basées sur une tauopathie. Le diagnostic différentiel important est également le parkinsonoïde médicamenteux dû à un traitement neuroleptique ou l’hydrocéphalie à pression normale. Jusqu’à présent, les syndromes parkinsoniens résultant d’une intoxication au manganèse, tels qu’ils ont été décrits principalement dans les cas de polytoxicomanie, ne sont pas survenus en Suisse. Chez les patients plus jeunes, il convient d’exclure la maladie de Wilson en tant que maladie pouvant être traitée.
Thérapie médicamenteuse
Le traitement médicamenteux reste l’étalon-or de la thérapie, notamment par l’administration de L-Dopa dans ses variantes pharmacologiques et toujours en combinaison avec un inhibiteur de la décarboxylase afin d’éviter une dégradation prématurée en périphérie. Les agonistes dopaminergiques tels que le pramipexole, la rotigotine ou le ropinirole sont également utilisés avec succès, mais ne sont pas aussi efficaces que la L-Dopa elle-même. Les inhibiteurs de la COMT (entacapone, tolcapone) et les inhibiteurs de la MAO-B (rasagiline ou safinamide) sont également utilisés. Les anticholinergiques, qui ont tendance à provoquer un délire en raison de la maladie neurodégénérative, sont rarement utilisés. Dans les situations de crise, l’amantadine peut être administrée par voie intraveineuse. En règle générale, on commence par un traitement par agoniste dopaminergique chez les patients âgés de moins de 70 ans et par la L-dopa chez les patients âgés de plus de 70 ans. En principe, toutefois, la qualité de vie du patient doit primer. Si l’administration d’un agoniste dopaminergique ne permet pas d’obtenir une amélioration clinique suffisante, nous passons généreusement au traitement le plus efficace sous forme de L-Dopa. Les principaux effets secondaires à mentionner sont initialement les nausées, les troubles circulatoires, les œdèmes des jambes (principalement dus aux agonistes dopaminergiques), la fatigue ainsi que les effets secondaires psychiatriques tels que les hallucinations. Il convient de souligner le risque de troubles du contrôle des impulsions. Parfois, il peut y avoir une dépendance au jeu, une hypersexualité, une augmentation des achats et des activités répétitives compulsives. Des familles peuvent être brisées par cet effet secondaire grave et il est donc du devoir de tout médecin prescrivant ces médicaments de s’enquérir également de ce type d’effets secondaires. Au début, les patients atteints de la maladie de Parkinson idiopathique répondent très bien au traitement, de sorte que l’on peut parler d’une phase de “lune de miel”, qui peut toutefois se transformer en “paradis perdu” au fil du temps. Le bon effet initial se transforme. On observe des fluctuations d’action au cours de la journée, un “on” retardé ou absent, des dyskinésies induites par la L-dopa, une dystonie sous forme de syndrome de carence en L-dopa (typiquement le matin) ou encore des effets secondaires psychiatriques. C’est au plus tard dans cette situation qu’il faut envisager la possibilité de thérapies interventionnelles. On peut citer d’une part la possibilité d’une pompe à apomorphine. Ici, l’apomorphine est appliquée en continu par voie sous-cutanée via un système de pompe. L’apomorphine est l’agoniste dopaminergique le plus puissant, mais elle ne peut être administrée que par voie parentérale. Une autre alternative est la perfusion intrajéjunale continue de L-Dopa. En raison de la stimulation dopaminergique continue, les deux traitements entraînent une diminution des fluctuations d’action et une amélioration des dyskinésies induites par la L-Dopa [2].
Stimulation cérébrale profonde (DBS)
Parmi les autres traitements invasifs possibles, nous disposons de la chirurgie stéréotaxique comme la stimulation cérébrale profonde (DBS) et, plus récemment, des ultrasons focalisés guidés par RM (MFgFUS). Dans les années 1980, des neurologues et des neurochirurgiens français, mais aussi suisses, se sont efforcés d’établir cette nouvelle méthode. On peut dire qu’il s’agit de la plus grande avancée thérapeutique dans le traitement de la maladie de Parkinson depuis l’introduction de la L-dopa dans les années 1960.
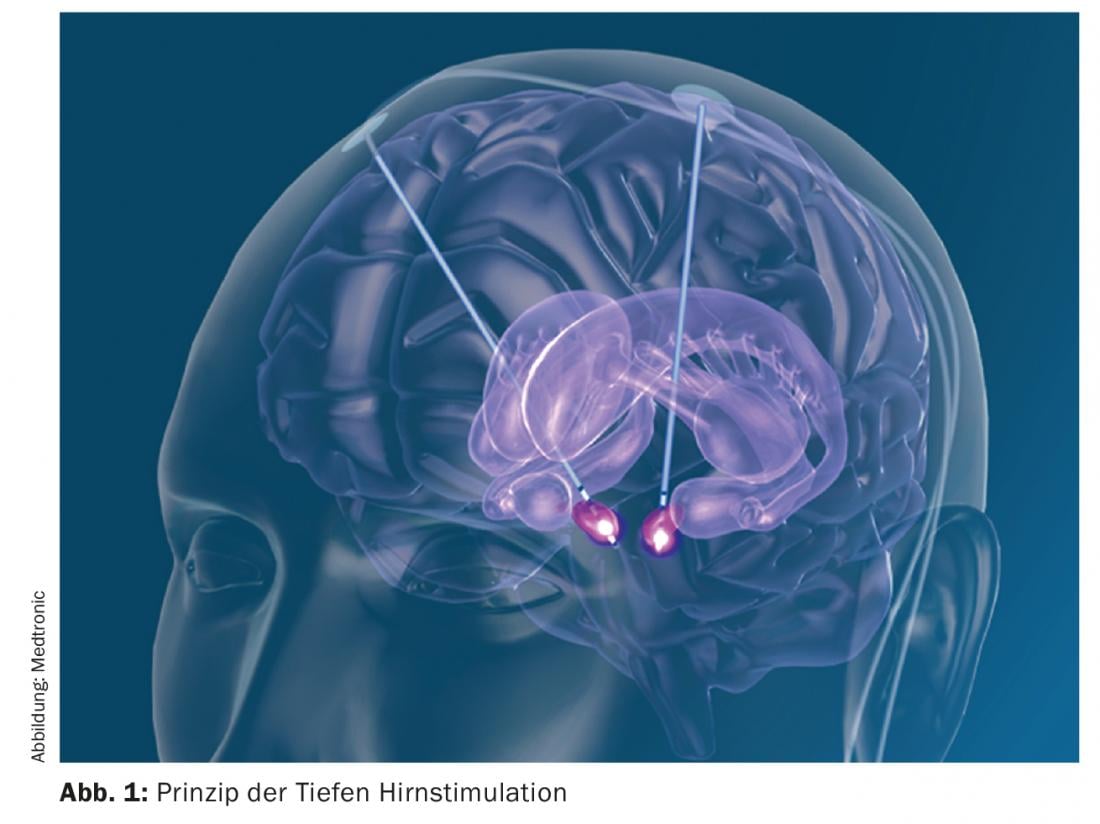
La stimulation cérébrale profonde est une méthode non lésionnelle qui consiste à implanter des électrodes en un point cible précis au cours d’une opération stéréotaxique. Des câbles sont ensuite posés sous la peau et un neurostimulateur est implanté par voie sous-clavière ou abdominale. Il est possible de régler de l’extérieur les paramètres qui permettent de réaliser une neurostimulation (fig. 1). Il convient de souligner que la neurostimulation ne détruit aucun tissu, elle ne fait que l’inactiver fonctionnellement. Les cibles typiques dans le traitement de la maladie de Parkinson sont le noyau sous-thalamique (STN), le globus pallidus internus (Gpi) ou certains noyaux du thalamus. Le STN et le Gpi entraînent tous deux une amélioration de tous les symptômes cardinaux de la maladie de Parkinson (rigidité, bradykinésie et tremblements). En cas de neurostimulation du STN, il est possible de réduire le traitement dopaminergique de moitié environ et d’améliorer ainsi les dyskinésies induites par la L-dopa. Une neurostimulation dans le noyau ventral intermédiaire de Thalami (Vim) entraîne une réduction du tremblement, sans affecter les autres symptômes cardinaux. Pendant l’opération stéréotaxique, le patient, généralement éveillé, est fixé dans un système de cadre stéréotaxique afin de permettre l’implantation des électrodes au millimètre près. Si la préparation et la sélection des patients sont effectuées avec soin, il s’agit d’une procédure chirurgicale qui présente relativement peu d’effets secondaires [3]. Les effets secondaires possibles liés à l’opération sont des saignements intracrâniens, des infections et des érosions cutanées, le déclenchement de crises d’épilepsie, l’apparition d’une fistule du liquide céphalorachidien ou, dans le pire des cas, une lésion directe du tissu cérébral. Toutefois, comme l’opération peut être planifiée de manière ciblée à l’aide d’un logiciel, ces effets secondaires sont inférieurs à 3% selon les études. A cela s’ajoutent les éventuels dysfonctionnements du système de neurostimulation, tels qu’une migration des électrodes, une rupture ou un dysfonctionnement, mais cela reste également extrêmement rare en raison de la très grande fiabilité des systèmes. Dans les profondeurs du cerveau, d’importants systèmes neuronaux passent très près les uns des autres, notamment au niveau des points cibles mentionnés pour la stimulation cérébrale profonde. En conséquence, des effets secondaires induits par la stimulation peuvent également se produire. C’est tout l’art du neurologue traitant de trouver le bon réglage parmi la multitude de réglages possibles, de manière à obtenir l’effet souhaité et à éviter les effets secondaires liés à la stimulation, tels que les troubles de l’élocution, les crispations de la main controlatérale, les paresthésies, etc. ce qui, en général, se passe bien. Comme la thérapie médicamenteuse, la neurostimulation peut entraîner des effets secondaires psychiatriques. Ceux-ci sont également très rares et réversibles. Comme pour toute opération du cerveau, en particulier chez les personnes souffrant d’une maladie neurodégénérative, des syndromes délirants postopératoires sont possibles de manière transitoire. Cependant, la stimulation directe peut également entraîner une certaine augmentation de la propulsion et un comportement hypomaniaque ainsi qu’une hypersexualité en raison de la co-stimulation des fibres limbiques. C’est également pour identifier ces effets secondaires qu’il est important d’impliquer les proches dans le processus de traitement dès le début.
Depuis peu, des systèmes d’électrodes directionnelles sont également disponibles. Ceux-ci permettent de stimuler de manière ciblée dans certaines directions et ainsi d’éviter ou de corriger les effets secondaires induits par la stimulation.
Une sélection rigoureuse des patients comme condition préalable
La méthode dépend d’une sélection minutieuse des patients, à laquelle les personnes concernées doivent consacrer suffisamment de temps. Les patients atteints d’un syndrome parkinsonien idiopathique sont particulièrement adaptés. Les syndromes parkinsoniens atypiques mentionnés précédemment pour le diagnostic différentiel ne répondent pas de manière comparable à la DBS. Seuls les patients qui bénéficient d’un traitement par L-Dopa verront également une amélioration grâce à la stimulation cérébrale profonde. Cela permet de prédire l’effet thérapeutique. Seul le symptôme cardinal des tremblements ne s’améliore pas nécessairement sous traitement par la L-Dopa, mais il constitue un excellent symptôme cible pour la DBS. Aujourd’hui, on peut parler de la DBS comme d’un traitement établi du syndrome parkinsonien idiopathique, qui conduit à une amélioration de l’activité quotidienne par la régulation des fonctions motrices, à une réduction des dyskinésies induites par la L-Dopa via la diminution du traitement dopaminergique quotidien, et donc à une amélioration globale de la qualité de vie. Il existe des études contrôlées qui montrent un avantage de la DBS par rapport à un groupe de patients comparables qui ne reçoivent “que” un traitement médicamenteux [3]. En conséquence, les possibilités de DBS doivent être envisagées très tôt dans le cadre de l’évolution de la maladie, car ce traitement est déjà indiqué en présence de l’indication correspondante (fluctuations d’efficacité, dyskinésies) [4].
Ultrasons focalisés guidés par RM (MRgFUS)
Outre la DBS en tant que méthode de thérapie stéréotaxique non lésionnelle, il existe également des méthodes stéréotaxiques lésionnelles. Cependant, en raison de leur irréversibilité, elles ont perdu de leur importance par rapport à la DBS au cours des dernières décennies. Les méthodes disponibles sont l’ablation par radiofréquence, la radiochirurgie avec Gamma-Knife et, plus récemment, les ultrasons focalisés guidés par RM (MRgFUS) [5].
Grâce à un traitement technique de l’énergie sonore, les ultrasons, utilisés par ailleurs à des fins de diagnostic, peuvent être utilisés pour des lésions d’une précision millimétrique, sans qu’il soit nécessaire d’ouvrir la boîte crânienne. Le système contient plus de 1000 sources d’ultrasons et peut être utilisé de manière intégrée dans une IRM 3T (Fig. 2). Seul le système Exablate Neuro de la société israélienne InSightec est autorisé pour une utilisation clinique. Avant l’intervention, la tête du patient est entièrement rasée afin de garantir une transmission adéquate de l’énergie des ultrasons. Dans le centre de RM, la mise en place du cadre stéréotaxique se fait sous anesthésie locale, comme pour la DBS, et le patient est fixé sur la table de traitement à l’aide du cadre stéréotaxique. Sur celle-ci est monté le système de neuro-traitement Exablate, qui est intégré dans un système d’IRM 3T. Toute l’intervention est réalisée sur un patient éveillé et accompagnée par une équipe d’anesthésistes. Selon notre expérience, le traitement de la douleur chez le patient éveillé se fait, dans la mesure du possible, uniquement par le rémifentanil lors d’opérations DBS, afin de ne pas influencer les symptômes cibles.

L’espace entre le transducteur hémisphérique et le cuir chevelu du patient est rempli d’eau dégazée à 16°C, qui circule pour transmettre le son et refroidir localement le cuir chevelu ; une membrane en silicone assure l’étanchéité avec le cuir chevelu du patient. Ci-dessous, des séquences d’IRM actuelles sont fusionnées avec des séquences de planification réalisées au préalable. Le point cible est déterminé par neurochirurgie et neuroradiologie en utilisant des atlas stéréotaxiques et en guidant directement le patient en fonction de son anatomie individuelle. Au début de l’intervention proprement dite, des sonorisations à faible énergie sont effectuées pendant dix secondes. Entre les échographies, le neurologue procède à une évaluation clinique du symptôme cible et des éventuels effets secondaires. Pendant chaque sonication, l’évolution de la température dans le voxel cible et sa localisation selon le plan sont suivies à l’aide des séquences IRM correspondantes sur la console de contrôle. En plus du feed-back clinique du neurologue, il est important d’augmenter progressivement l’énergie sonore appliquée et la durée (max. 30’000 J plus de max. 30 secondes) et donc l’augmentation de la température, il est possible de corriger l’énergie sonore ainsi que la position du point cible. De cette manière, la température cible de 56-60°C, qui provoque une coagulation irréversible des tissus, est atteinte de manière progressive et contrôlée. Cette approche permet de tester en toute sécurité l’effet clinique et les éventuels effets secondaires, et d’ajuster le point cible avant de procéder à l’ablation finale irréversible.
Dès que le seuil de température est atteint, entre 48 et 55°C, un effet anatomique et clinique est évident, ce qui permet de planifier la suite des opérations. En fonction de la réponse clinique au symptôme cible, de la preuve par imagerie morphologique de l’extension d’une lésion au point cible et de la documentation de la température cible atteinte, une décision interdisciplinaire est prise pour déterminer quand le traitement doit être arrêté [6].
L’un des avantages du MRgFUS est qu’il permet de planifier le point cible à l’IRM pendant l’intervention et de vérifier directement les effets secondaires ou de contrôler l’effet du traitement. L’ouverture de la boîte crânienne n’est pas nécessaire et les risques d’infection sont donc insignifiants. La lésion placée par MRgFUS atteint une taille maximale après environ 72 heures, puis, selon notre expérience, elle se résorbe en six mois à un an de telle sorte que la lésion n’est pratiquement plus détectable à l’IRM. Cela représente un avantage par rapport à d’autres lésions pour lesquelles une augmentation de la taille au cours de l’évolution est parfois décrite.
Dans la région sous-thalamique postérieure, plusieurs cibles anatomiques sont définies comme pouvant faire l’objet d’un traitement stéréotaxique, que ce soit par DBS ou par une procédure lésionnelle. Le point cible à choisir dépend de la maladie sous-jacente. D’après notre expérience, non seulement le syndrome parkinsonien idiopathique, mais aussi les tremblements essentiels ou dystoniques peuvent être une indication de traitement par MRgFUS. En 2016, une étude randomisée et contrôlée par sham a montré un net avantage du groupe de patients traités par rapport aux patients traités par sham en termes de réduction des tremblements [7]. De manière générale, le tremblement semble être un symptôme particulièrement bien ciblé pour un traitement par MRgFUS. L’effet de réduction des tremblements s’est également avéré stable lors du suivi à deux ans. Nous avons nous-mêmes eu de bonnes expériences avec des patients souffrant d’un syndrome de tremblement essentiel. Nous avons utilisé comme cible le tractus cérébello-thalamique (fasciculus cerebello thalamicus, FCT), ce qui a entraîné une amélioration de plus de 80% des symptômes [8]. Dans notre centre, l’intervention n’est pour l’instant réalisée que d’un seul côté afin d’éviter d’éventuels effets secondaires bilatéraux. Après l’intervention, les patients ont parfois présenté comme effets secondaires une légère instabilité transitoire de la marche et, pendant l’intervention, des maux de tête et une sensation de vertige non spécifique. Cependant, nous n’avons pas constaté d’effets secondaires à long terme, notamment pas de dysarthrophonie ou de dysphagie.
Chez les patients beaucoup plus gravement atteints et souvent plus morbides, qui souffrent d’un syndrome parkinsonien idiopathique avancé, il est essentiel de sélectionner soigneusement les patients. Il existe parfois des incertitudes quant à la structure cible à choisir pour une lésion avec MRgFUS. Si l’objectif est une réduction pure et simple du tremblement, le FCT, en tant qu’afférence cérébelleuse vers le thalamus, peut également être lésé unilatéralement chez ces patients, ce qui permet d’espérer une réduction controlatérale du tremblement. Les autres symptômes cardinaux, tels que la rigidité et la bradykinésie, ne sont toutefois pas affectés et on ne sait pas dans quelle mesure il est possible de réduire la médication après l’intervention afin d’éviter également les dyskinésies induites par la L-Dopa.
Dans notre centre, nous avons également acquis de l’expérience dans le traitement des patients atteints de la maladie de Parkinson. Il s’agissait en grande partie de patients qui, pour diverses raisons, n’étaient pas éligibles pour une DBS avec électrodes. Pour ces patients, nous avons choisi comme point cible le tractus pallido-thalamique (PTT). Il s’agit de fibres provenant du pallidum qui convergent vers le thalamus et sont donc facilement accessibles à un traitement lésionnel. Là encore, nous avons constaté que les syndromes à prédominance de tremblements, en particulier, ont connu une amélioration significative et durable sur plusieurs années. En outre, certains patients ont vu une amélioration de la bradykinésie et de la rigidité, ce qui permet d’espérer une amélioration d’autres symptômes cardinaux. Toutefois, pour pouvoir en juger au cours de l’évolution, il faut encore plus d’expérience dans le cadre d’études cliniques et de suivis à long terme dans le cadre d’une étude en cours dans notre centre [8].
Récemment, un groupe de travail de Madrid a utilisé le MRgFUS chez des patients atteints de la maladie de Parkinson idiopathique très asymétrique et a choisi le noyau sous-thalamique comme cible de la lésion. L’objectif était donc le même point d’arrivée que pour la DBS décrite ci-dessus. D’après les données disponibles à ce jour, il y a également eu une amélioration du syndrome parkinsonien controlatéral, sans hyperkinésie liée aux lésions [9].
Dans l’ensemble, le traitement par MRgFUS est une nouvelle option thérapeutique très prometteuse pour les troubles du mouvement. Il s’agit d’une procédure lésionnelle et donc irréversible. Cependant, l’intervention elle-même est non invasive et certains effets secondaires liés à l’opération que nous connaissons avec la DBS ne jouent aucun rôle dans cette intervention. Dans le cas de maladies neurodégénératives évolutives telles que le syndrome de Parkinson idiopathique, il n’est pas possible d’adapter l’effet obtenu par le traitement à la progression de la maladie, car une nouvelle lésion serait alors nécessaire.
Toutefois, par rapport à l’expérience considérable dont on dispose sur le DBS par le biais d’études contrôlées, il faut encore acquérir davantage d’expérience avec cette thérapie.
Conclusion
La chirurgie stéréotaxique dans le traitement du syndrome de Parkinson idiopathique et d’autres troubles du mouvement constitue une option thérapeutique certes invasive, mais prometteuse. Cette offre devrait être proposée à nos patients à un stade avancé et après avoir épuisé toutes les possibilités de traitement médicamenteux. Si les patients sont soigneusement sélectionnés et évalués au préalable, les procédures ont relativement peu d’effets secondaires.
Messages Take-Home
- Bien que le traitement médicamenteux reste l’étalon-or, la chirurgie stéréotaxique constitue une option thérapeutique prometteuse dans le traitement du syndrome parkinsonien idiopathique.
- Une sélection rigoureuse des patients est essentielle à la réussite du traitement.
- La stimulation cérébrale profonde (DBS) est une méthode non lésionnelle de neurostimulation par électrodes implantées.
- Les ultrasons focalisés guidés par RM (MRgFUS) sont une procédure lésionnelle et irréversible. Comme l’intervention ne nécessite pas l’ouverture du crâne ni l’implantation de matériel étranger, certains effets secondaires liés à l’opération ne sont pas nécessaires.
- Le MRgFUS semble être particulièrement efficace dans les syndromes à prédominance de tremblement.
Littérature :
- Postuma RB, Berg D : Les nouveaux critères de diagnostic de la maladie de Parkinson. Int Rev Neurobiol 2017 ; 132 : 55-78.
- Diener HC, et al. : Guidelines for Diagnostic and Therapy in the Neurology : Publied by the Commission Guidelines of the German Society for Neurology, 5e édition. Stuttgart 2012.
- Deuschl G, et al : A randomized trial of deep-brain stimulation for Parkinson’s disease. N Engl J Med 2006 ; 355 : 896-908.
- Schuepbach WM, et al : Neurostimulation for Parkinson’s disease with Early Motor Complications. N Engl J Med 2013 ; 368(7) : 610-622.
- Schreglmann SR, et al. : Neurosurgery lesionale fonctionnelle pour le tremblement : retour vers le futur ? J Neurol Neurosurg Psychiatry 2017 ; 210 : 1-9.
- Schreglmann SR, et al : Focused ultrasound ablation as tremor treatment. Nervenarzt 2018 [Epub ahead of print].
- Elias WJ, et al : A Randomized Trial of Focused Ultrasound Thalamotomy for Essential Tremor. N Engl J Med 2016 ; 375(8) : 730-739.
- Schreglmann SR, et al : Ablation unilatérale de la voie cérébellothalamique dans le tremblement essentiel par échographie focalisée guidée par IRM. Neurology 2017 ; 88 : 1329-1333.
- Martínez-Fernández R, et al : Focused ultrasound subthalamotomy in patients with asymmetric Parkinson’s disease : a pilot study. Lancet Neurol 2018 ; 17(1) : 54-63.
InFo NEUROLOGIE & PSYCHIATRIE 2018 ; 16(4) : 6-10











