Le travail d’équipe entre le médecin généraliste, le néphrologue, le centre de transplantation et le patient est essentiel. 50% des patients transplantés décèdent avec un greffon rénal fonctionnel. Dans la phase précoce qui suit la transplantation, l’accent est mis sur l’ajustement de l’immunosuppression et la détection, en particulier, de la réjection et des infections. Le traitement des complications non immunologiques, notamment des facteurs de risque cardiovasculaires, est extrêmement important. Il convient de procéder à des contrôles réguliers de la tumeur, notamment de la peau. Toujours faire attention aux interactions médicamenteuses, surtout pour les immunosuppresseurs.
La transplantation rénale est la méthode de remplacement rénal préférée pour la majorité des patients souffrant d’insuffisance rénale chronique, et elle est associée à la meilleure qualité et espérance de vie pour le patient. La survie à 5 ans du greffon rénal est actuellement supérieure à 70% pour les organes provenant de donneurs décédés, et même supérieure à 80% pour les organes provenant de donneurs vivants [1].
Aujourd’hui, environ 50% des transplantés dont le greffon fonctionne décèdent en raison de complications cardiovasculaires, suivies de tumeurs et d’infections graves. C’est pourquoi le contrôle et le traitement réguliers des comorbidités jouent un rôle crucial. Le résultat à long terme d’une transplantation dépend en grande partie de la qualité et de la régularité du suivi. Dans ce cas, une bonne collaboration entre le médecin généraliste et le centre de transplantation est essentielle.
Phase précoce après la transplantation
La phase précoce du monitoring (première année postopératoire) se déroule principalement directement au centre de transplantation, avec des intervalles de contrôle qui sont prolongés jusqu’à trois mois après la phase initiale. Après la première année, le néphrologue le plus proche du domicile, en coopération avec le médecin généraliste, prend en charge la majeure partie du suivi régulier, complété par des contrôles annuels au centre de transplantation.
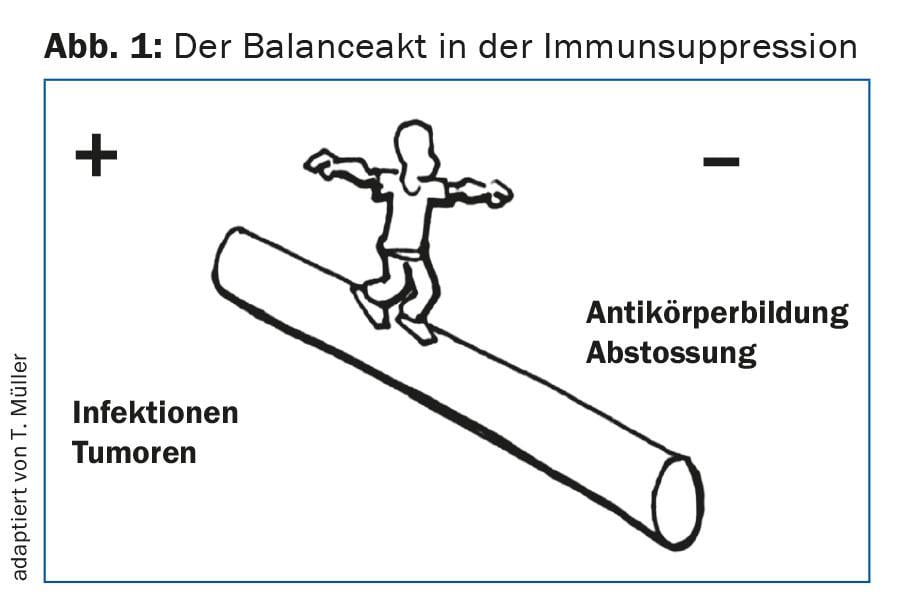
Un suivi initial étroit est nécessaire pour détecter précocement les complications immunologiques aiguës telles que les réactions aiguës de rejet. Pour les éviter, c’est-à-dire pour éviter une sous-immunosuppression ou une surimmunosuppression, il est nécessaire d’ajuster l’immunosuppression de manière très individuelle (fig. 1). En outre, les infections, en particulier les infections virales, doivent être détectées à un stade précoce. Il s’agit notamment de la réactivation du CMV ou des primo-infections à CMV, qui peuvent avoir des conséquences graves si elles ne sont pas traitées [2]. En outre, une surveillance étroite est nécessaire pour détecter une éventuelle réplication du BKV (polyomavirus), car une virémie BKV significative peut entraîner une néphropathie BK et, en l’absence de traitement, une perte rapide de la fonction du greffon.
Contrôles à long terme
Au cours de l’évolution à long terme, le site accorde une plus grande importance à la détection des complications non immunologiques, notamment au contrôle et à l’ajustement de la pression artérielle ainsi qu’aux éventuels troubles du métabolisme lipidique et osseux.
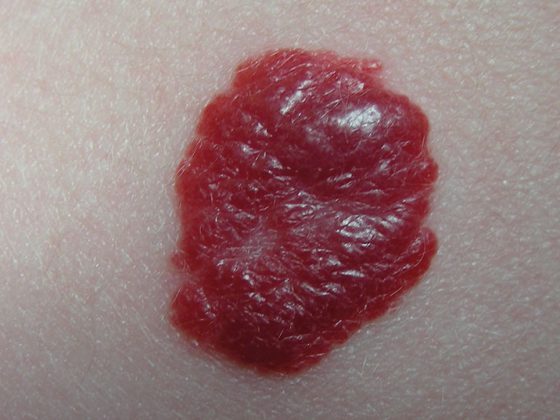
En raison de l’amélioration de la survie à long terme des patients ayant subi une transplantation rénale, nous sommes aujourd’hui confrontés aux conséquences d’un traitement immunosuppresseur de longue durée. Il s’agit notamment du risque accru de tumeurs cutanées malignes. Les tumeurs cutanées (Non Melanoma Skin Cancer, NMSC) représentent la part la plus élevée de toutes les tumeurs malignes post-transplantation, soit 40%. Dans 90 à 95% des cas, les NMSC sont des carcinomes épidermoïdes et basocellulaires. Le risque d’un tel carcinome est significativement plus élevé chez les patients immunodéprimés que dans la population générale [3], le risque général de tumeur est d’environ deux à trois fois plus élevé [4]. Pour cette raison, un contrôle étroit de la peau est crucial et un changement éventuel du traitement immunosuppresseur est nécessaire en cas d’apparition d’une NMSC.
L’un des principaux facteurs dans la phase tardive de la prise en charge est le problème des changements chroniques dans le greffon, qui se produisent presque toujours pour une raison encore incertaine et qui réduisent la durée de fonctionnement du greffon. L’évolution de la créatinine et de la protéinurie est déterminante dans le diagnostic fonctionnel. Dans ce contexte, une augmentation de la créatinine de plus de 15% mérite d’être examinée. Pour l’excrétion des protéines, il suffit généralement de déterminer le quotient protéine-créatinine ou albumine-créatinine dans l’urine spontanée. Là encore, l’évolution dans le temps et l’augmentation de l’excrétion de protéines sont déterminantes. Tout changement significatif doit être discuté avec le centre de transplantation. Le cas échéant, il faut alors décider de procéder à des examens supplémentaires, comme un dépistage des anticorps dirigés contre le greffon ou même une biopsie rénale.
Au cours de la phase à long terme, il est important de prendre contact avec le centre de transplantation en cas de maladie, de détérioration de la fonction rénale, de fièvre, de douleurs ou d’intolérance aux médicaments, même en dehors des rendez-vous convenus, car ces situations nécessitent souvent une évaluation rapide, dans le cadre de laquelle un traitement hospitalier pourrait également être nécessaire.
Les auto-mesures des patients constituent également un élément essentiel du monitorage standard. Il s’agit notamment de mesurer la pression artérielle, le pouls, la température et le poids corporel, d’abord quotidiennement, puis de manière intermittente. En particulier, une température corporelle élevée (généralement une augmentation de plus de 0,5°C au-dessus de la normale individuelle) et/ou une prise de poids significative d’un jour à l’autre de plus de 1 kg sont des signes d’alerte que les patients doivent signaler.
Médicaments immunosuppresseurs
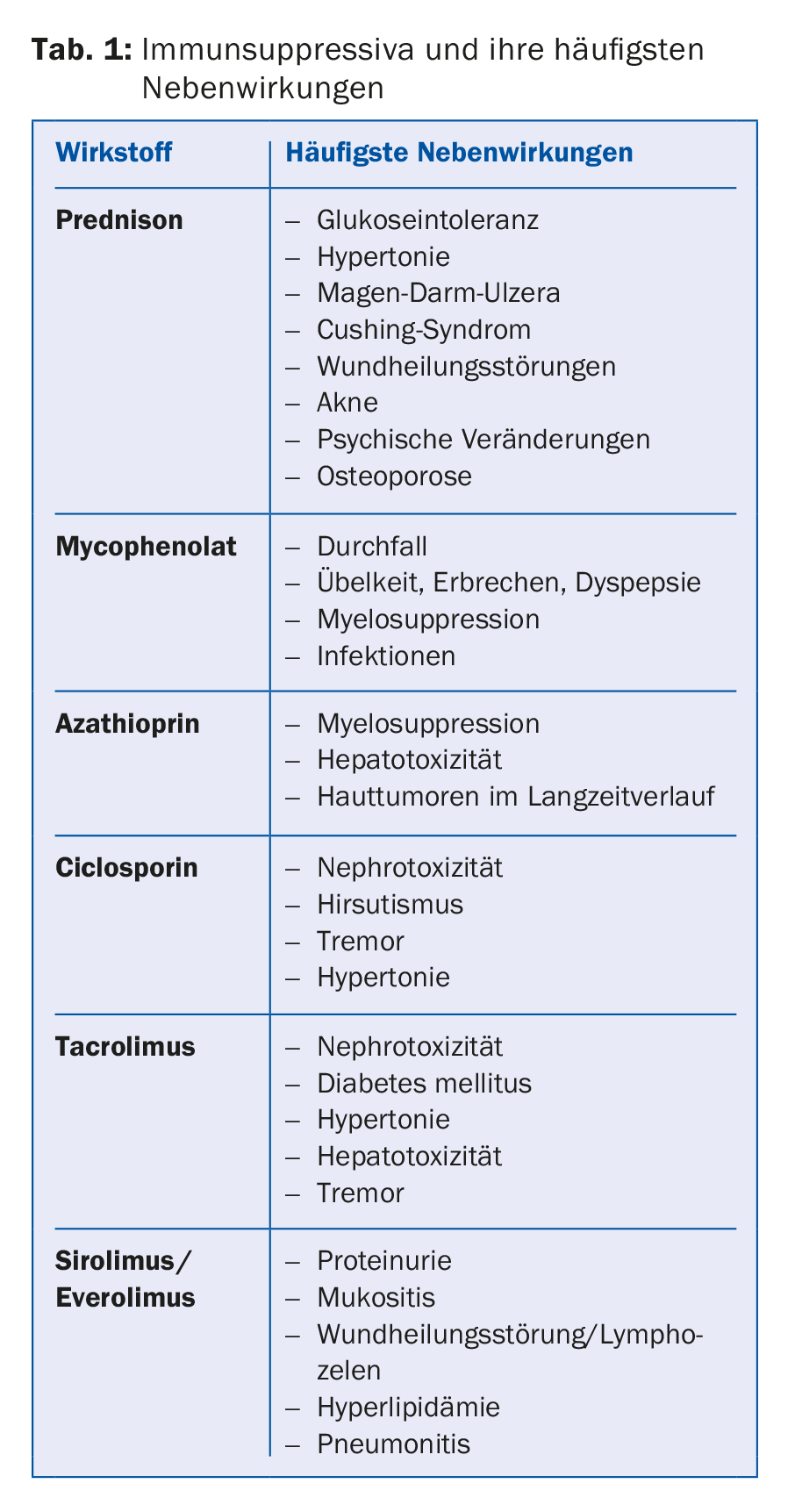
La transplantation ne guérit pas le patient, qui doit prendre des médicaments régulièrement tout au long de sa vie. Les questions relatives aux effets secondaires et aux interactions doivent donc toujours être abordées avec le centre de transplantation. La norme est la double thérapie pour les patients à faible risque immunologique ou la triple thérapie pour les patients à risque plus élevé. Le traitement immunosuppresseur consiste généralement en un inhibiteur de la calcineurine, le plus souvent du tacrolimus (Prograf® ou Advagraf®, ce dernier étant la forme à libération prolongée du tacrolimus), ou, dans certains cas, de la ciclosporine (Sandimmun Neoral®). En outre, une substance antiproliférative est utilisée, dans la plupart des cas le mycophénolate (CellCept® ou Myfortic®), plus rarement l’azathioprine (Imurek®). Dans la phase postopératoire précoce, un glucocorticoïde est généralement ajouté comme troisième immunosuppresseur, qui est supprimé après environ six mois en fonction du risque immunologique et des directives du centre (tableau 1).
L’adaptation de la dose, en particulier des inhibiteurs de la calcineurine, se fait sur la base de ce que l’on appelle le taux de sédimentation, la détermination de la concentration du principe actif dans le sang douze heures après la prise de la dernière dose. Il s’agit de viser des taux cibles individuels, adaptés à la clinique (situation immunologique, complications infectieuses ou tumorales).
En ce qui concerne les immunosuppresseurs, il convient d’utiliser les préparations recommandées par le centre de transplantation. Les changements de traitement, de dose ou le passage à des médicaments génériques ne doivent être effectués qu’après consultation.
Les inhibiteurs de la calcineurine, comme de nombreux autres médicaments, sont métabolisés par le CYP3A, c’est pourquoi la plus grande prudence est de mise lors de la prescription de nouveaux médicaments en raison des interactions potentielles. Les antibiotiques macrolides en particulier (notamment la clarithro- et l’érythromycine) peuvent entraîner une toxicité grave des inhibiteurs de la calcineurine en inhibant le CYP3A. Mais les médicaments à base de plantes ont également un fort potentiel d’interaction. Par exemple, une réduction significative des taux d’inhibiteurs de la calcineurine peut se produire sous millepertuis, et une forte augmentation sous jus de pamplemousse, avec un risque de rejet consécutif ou d’immunosuppression excessive.
Autres médicaments
Lors d’interventions dentaires et d’endoscopies avec ou sans biopsies, une prophylaxie antibiotique n’est pas obligatoire uniquement en raison du fait que le patient a besoin d’une immunosuppression systémique. Un traitement antibiotique conforme au schéma de prophylaxie de l’endocardite n’est généralement indiqué que chez les patients qui recevraient une prophylaxie antibiotique même en l’absence d’immunosuppression et/ou lorsque des interventions sont prévues dans une zone infectée. En cas de doute, la situation individuelle du patient doit être évaluée avec le centre de transplantation en fonction de son statut immunitaire.
En cas de traitement analgésique, les AINS et les inhibiteurs de la COX II doivent absolument être évités en raison de divers effets secondaires rénaux possibles (insuffisance rénale aiguë d’origine vasomotrice, néphrite tubulo-interstitielle, rétention de sel, etc.), comme c’est généralement le cas chez tous les patients dont la fonction rénale est altérée.
La fonction rénale doit être prise en compte lors du dosage des médicaments. Lorsque le greffon fonctionne très bien, le débit de filtration glomérulaire (DFG) est généralement supérieur à 60 ml/min et 1,73 m2 de surface corporelle. Conformément à l’information professionnelle, la dose doit être ajustée pour les différentes plages de DFG.
Infections des voies urinaires
Les infections les plus fréquentes après une transplantation rénale sont les infections urinaires. En principe, seules les infections urinaires symptomatiques doivent être traitées sur le long terme. Avant d’initier un traitement empirique (en général avec de la ciprofloxacine ou de l’amoxicilline/acide clavulanique), il est impératif de prélever une culture d’urine pour un traitement ultérieur adapté à la résistance.
En cas d’infections urinaires récidivantes, le traitement empirique est d’une part choisi en fonction des résistances antérieures aux antibiotiques. D’autre part, il convient de prendre contact avec le centre de transplantation afin de clarifier les causes éventuelles (par exemple, reflux dans le greffon, etc.). En outre, la consommation d’airelles ou de baies est fortement déconseillée. Le jus de canneberge est recommandé comme mesure prophylactique, et dans certains cas, l’utilisation de L-méthionine pour acidifier l’urine peut également être discutée.
Hyperuricémie et goutte
En raison d’une diminution de la clairance rénale de l’acide urique, l’hyperuricémie est une complication fréquemment observée lors d’un traitement par inhibiteur de la calcineurine. Des crises de goutte ont été décrites chez 5 à 10 % des patients, en particulier sous ciclosporine.
Pour le traitement d’une crise de goutte aiguë, il est recommandé d’administrer des stéroïdes pendant une courte période de trois à cinq jours (env. 20-50 mg/j) est recommandée. Les AINS doivent être strictement évités. Une prophylaxie par l’allopurinol ne doit pas être administrée aux patients sous traitement continu par l’azathioprine, car cette association peut entraîner des neutropénies/agranulocytoses sévères.
Diarrhée et troubles gastro-intestinaux
La diarrhée et les troubles gastro-intestinaux sont des problèmes fréquents chez les personnes immunodéprimées. Si un patient se plaint de diarrhée (>3 selles liquides et pâteuses) qui dure plus de deux jours, il faut d’abord rechercher une origine infectieuse (bactériologie fécale générale, norovirus). En cas de persistance et/ou de fièvre simultanée, le patient doit être envoyé au centre de transplantation (recherche d’une infection à CMV/colite à CMV, etc.). En cas de suspicion de diarrhée induite par le médicament, qui est souvent observée sous mycophénolate, en particulier lorsqu’elle est déclenchée par une infection, la dose d’immunosuppresseurs peut être adaptée. En cas de diarrhée, il est également toujours indiqué de contrôler rapidement le taux de tacrolimus, car il peut y avoir une absorption accrue du tacrolimus et donc des taux élevés.
Facteurs de risque cardiovasculaire
Les facteurs de risque cardiovasculaire doivent être traités de manière cohérente. L’hypertension artérielle est présente chez 60 à 80% des patients transplantés rénaux [6]. En principe, toutes les classes de substances des antihypertenseurs peuvent être utilisées. Au départ, on utilise généralement en premier lieu un antagoniste du calcium, mais également des inhibiteurs de l’ECA ou des bloqueurs de l’ATII (blocage du SRAA) si la fonction rénale du greffon est stable. En cas de protéinurie supérieure à 1 g/24 h, une substance destinée à bloquer le SRAA est le premier choix. La pression artérielle cible est de 130/80 mmHg (dans les mesures à domicile) pour la plupart des transplantés, parfois les valeurs cibles doivent être fixées individuellement.
La dyslipidémie doit également être traitée de manière intensive par des mesures de style de vie, notamment le contrôle du poids. Toutefois, un traitement médicamenteux par statine est souvent nécessaire. La valeur cible de LDL est <2,6 mmol/l. Dans ce cas, il faut également tenir compte des interactions avec les immunosuppresseurs.
Les fumeurs devraient toujours être encouragés à arrêter de fumer et des programmes de sevrage tabagique devraient leur être proposés. Les patients obèses peuvent bénéficier de conseils nutritionnels. En cas de maladie cardiovasculaire athérosclérotique, une prophylaxie par l’acide acétylsalicylique est recommandée.
Diabète sucré
Le diabète sucré ne réapparaît souvent qu’après la transplantation. Le tacrolimus, le sirolimus, la stéroïdothérapie et l’âge avancé sont des facteurs de risque de diabète post-transplantation (NODAT). Pour le traitement du NODAT, outre les mesures habituelles liées au mode de vie et les antidiabétiques oraux tels que les inhibiteurs de la DPP4 (sitagliptine), l’insuline est souvent envisagée de manière précoce. Si l’immunosuppression peut être réduite au cours de l’évolution, le métabolisme du glucose se normalise à nouveau chez une partie des patients pour atteindre une situation métabolique normoglycémique. L’objectif thérapeutique selon les lignes directrices de la KDIGO est une HbA1C <7-7,5%.
Désir d’enfant
En cas de désir d’enfant, il est essentiel de prendre contact avec le centre de transplantation afin de discuter ouvertement des risques et des dangers. De même, il est généralement impératif de modifier la médication avant une éventuelle grossesse. Une grossesse chez une femme ayant subi une transplantation rénale est en principe une grossesse à risque et nécessite un suivi interdisciplinaire étroit au centre de transplantation.
Vaccins et voyages
En règle générale, les vaccinations complètes – conformément aux recommandations suisses en matière de vaccination des personnes avant et après la transplantation d’organes solides – devraient avoir été effectuées avant la transplantation au moment de l’inscription sur la liste. Après la transplantation, les vaccins vivants comme ceux contre la rubéole ou la rougeole sont contre-indiqués en raison de l’immunosuppression. Tous les vaccins non-vivants doivent être régulièrement mis à jour conformément aux recommandations de vaccination. La vaccination annuelle contre la grippe est également recommandée. Il faut toutefois garder à l’esprit que la réponse à la vaccination est souvent légèrement affaiblie sous traitement immunosuppresseur.
En cas de voyage dans des pays présentant un risque accru d’infections gastro-intestinales, il est recommandé de consulter au préalable, par exemple dans un centre de médecine des voyages. Il est possible d’obtenir des informations sur la situation de la résistance dans ce pays. C’est sur cette base que sera déterminé le traitement empirique recommandé à prendre en cas d’urgence.
Conclusion
En résumé, le succès d’une transplantation, notamment en ce qui concerne la survie du greffon et la qualité de vie du patient, dépend de manière décisive de l’étroite collaboration entre le médecin généraliste, le néphrologue, le centre de transplantation et le patient.
Littérature :
- Matas AJ, et al. : Rapport annuel de données OPTN/SRTR 2012 : Kidney.
- Kumar D, et al. : The AST Handbook of Transplant Infections, Wiley-Blackwell, 2011.
- Zwald FO, et al : Skin cancer in solid organ transplant recipients : advances in therapy and management part I : Epidemiology of skin cancer in solid organ transplant recipients. J Am Acad Dermatol 2011 ; 65(2) : 253-261.
- Engels E, et al : Spectrum of Cancer Risk Among US Solid Organ Transplant Recipients. JAMA 2011 ; 306(17) : 1891-1901.
- Kasiske B, et al : KDIGO clinical practice guideline for the care of kidney transplant recipients : a summary. Kidney Int 2010 ; 77 : 299-311.
- Danovitch G : Handbook of Kidney Transplantation, Wolters Kluver, 2010.
PRATIQUE DU MÉDECIN DE FAMILLE 2015 ; 10(12) : 20-24