Grâce aux techniques d’imagerie modernes, les cancers de la thyroïde peuvent aujourd’hui être bien diagnostiqués et ont souvent un bon pronostic. La stratification du risque postopératoire devrait toutefois avoir lieu dans un centre disposant d’un conseil thyroïdien dédié.
Les techniques d’imagerie modernes permettent de diagnostiquer de plus en plus fréquemment les nodules thyroïdiens. La plupart de ces nodules sont bénins. Un traitement et une analyse précis sont donc indispensables pour éviter des interventions chirurgicales inutiles. En cas de nodules thyroïdiens suspects, la biopsie à l’aiguille fine et le traitement cytologique constituent l’étalon-or pour établir le diagnostic. Si un carcinome de la thyroïde est confirmé par la cytologie ou l’histologie, il est recommandé, compte tenu de la complexité croissante des options thérapeutiques, de discuter des résultats dans le cadre d’un conseil interdisciplinaire de la thyroïde. Un consensus permet alors de déterminer le traitement et le suivi optimaux pour le patient. Cet article donne un aperçu du diagnostic et du traitement des cancers de la thyroïde. L’accent est mis ici sur la thérapie. Les directives internationales actuelles servent de base.
Épidémiologie
Le carcinome de la thyroïde est une tumeur rare à faible potentiel de malignité. Il s’agit de la tumeur endocrinienne la plus fréquente. En Suisse, environ 770 nouveaux cas sont recensés chaque année, ce qui représente 1,9% de tous les carcinomes. Les femmes sont plus souvent touchées que les hommes dans un rapport de 2,5:1 [3].
La mortalité du carcinome thyroïdien est d’environ 0,4% de toutes les tumeurs malignes. Les cancers papillaires et folliculaires de la thyroïde, lorsqu’ils sont traités de manière optimale, ont un taux de survie global à 5 ans de près de 100% et 97% respectivement. Cependant, certains sous-types histologiques présentent un pronostic nettement moins bon, avec une mortalité à 10 ans de 10 à 40%. Pour les cancers médullaires de la thyroïde, le taux de survie global à 5 ans est de 90%. En cas de métastases, le pronostic est moins bon. Contrairement aux cancers différenciés de la thyroïde, le pronostic des cancers anaplasiques ou indifférenciés de la thyroïde est extrêmement mauvais, avec un taux de survie global à 5 ans de 7% [1].
Le carcinome papillaire de la thyroïde est le carcinome le plus fréquent de la thyroïde, avec une fréquence de 60 à 80%, suivi du carcinome folliculaire, médullaire et anaplasique/indifférencié de la thyroïde. Ce dernier est rare et représente moins de 2% de tous les cancers de la thyroïde.
L’incidence du carcinome papillaire de la thyroïde est en augmentation pour les petits carcinomes papillaires <2 cm, mais l’incidence et la mortalité sont constantes pour les plus grands. Cela peut s’expliquer par un diagnostic plus fréquent de nodules thyroïdiens non manifestés cliniquement. La prévalence des nodules thyroïdiens qui ne se manifestent pas cliniquement augmente avec l’âge de la population. Dans les études de dépistage, la prévalence des nodules thyroïdiens dépasse 50% chez les patientes de plus de 60 ans [6].
Diagnostic
Examen clinique : en cas de suspicion de nodule thyroïdien, il est recommandé de procéder à un bref examen clinique des parties molles du cou. Les nodules thyroïdiens de plus de 1,5 cm sont généralement faciles à palper. Le diagnostic clinique comprend également le statut des ganglions lymphatiques. Les ganglions lymphatiques non déplacés, ipsilatéraux et localisés dans les régions inférieures du cou sont suspects. Un enrouement récemment apparu peut également être un signe de malignité.
Diagnostic de laboratoire : lors de l’évaluation de la malignité des nodules thyroïdiens, le statut hormonal thyroïdien ne joue qu’un rôle secondaire, car les valeurs ne permettent pas de déterminer la bénignité ou la malignité d’un nodule. En postopératoire, la thyroglobuline est un excellent paramètre d’évolution tumorale dans les cancers de la thyroïde. Cependant, la thyroglobuline non spécifique n’est pas appropriée pour établir un diagnostic. Il en va tout autrement de la calcitonine sérique en tant que paramètre tumoral pour le carcinome médullaire de la thyroïde. Dans certains centres, le dosage de la calcitonine sérique est donc systématiquement effectué lors de l’examen des nodules thyroïdiens.

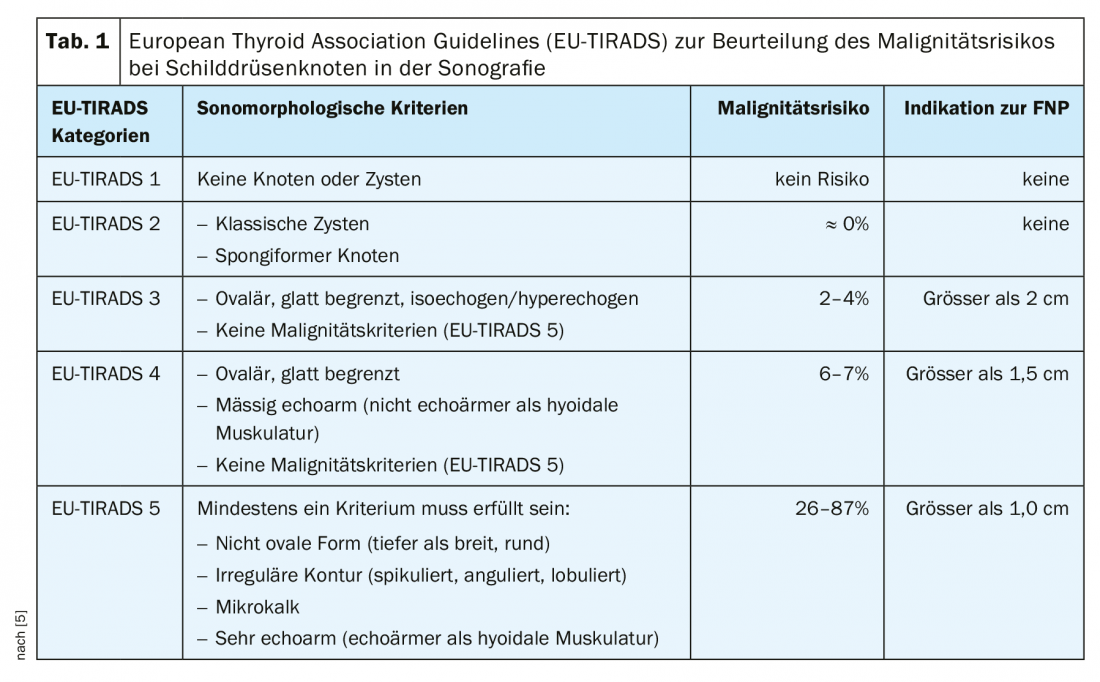
L’imagerie médicale : L’échographie est la première méthode d’examen utilisée pour déterminer la présence d’une masse dans le cou. Celui-ci permet une évaluation à haute résolution des nodules thyroïdiens et un diagnostic de localisation très précis. Pour évaluer les nodules thyroïdiens examinés par échographie, il est conseillé d’utiliser un système de classification. L’objectif d’un tel système de classification est de fournir une gradation quantitative des nodules thyroïdiens avec les recommandations qui en découlent, une nomenclature standardisée et un rapport standardisé. Sous nos latitudes, le système américain [7] ou européen [5] TI-RADS (Thyroid Imaging-Reporting and Database System) est souvent utilisé (Fig. 2, Tab. 1 [5]).
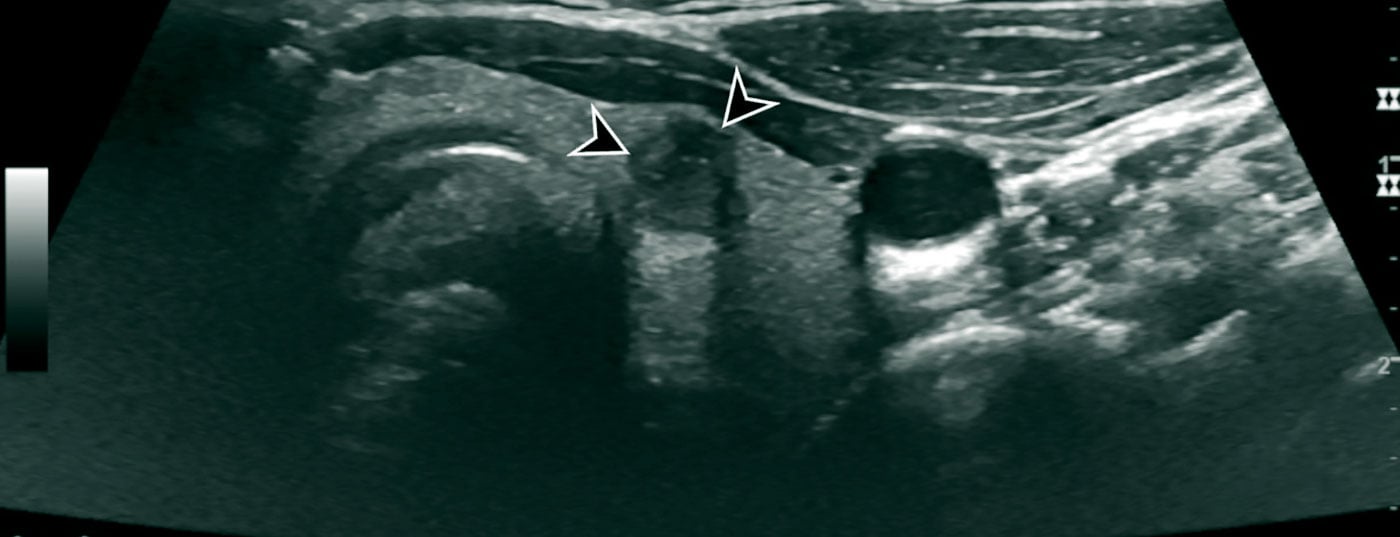
En plus de la thyroïde, les ganglions lymphatiques cervicaux et les autres parties molles du cou doivent toujours être évalués par échographie. Dans une certaine mesure, les parties molles du cou peuvent également être évaluées en termes d’infiltration dans le cas de cancers de la thyroïde à croissance infiltrante.
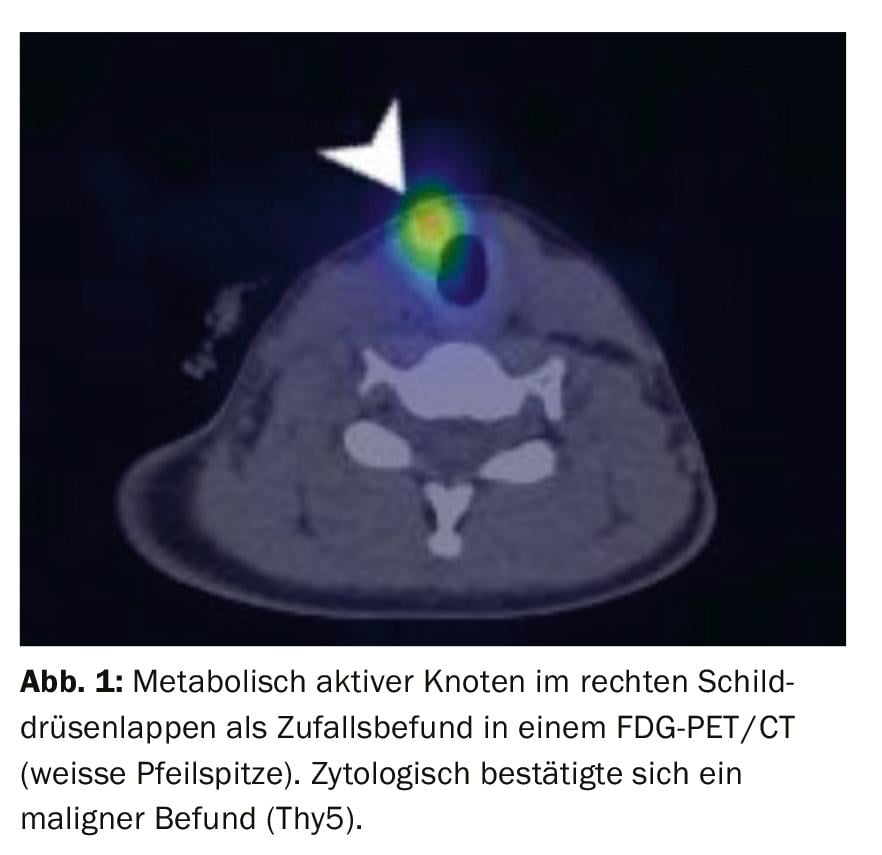
Le scanner et l’IRM n’ont qu’une place limitée dans le diagnostic primaire des nodules thyroïdiens. Si l’échographie atteint ses limites physiques, l’évaluation de la position anatomique des grandes glandes thyroïdes s’étendant jusqu’au médiastin et à la rétrotrachée peut être mieux évaluée qu’avec l’échographie. Les nodules thyroïdiens avides de FDG découverts par hasard au PET-CT doivent être ponctionnés. Le potentiel de malignité de tels nodules est d’environ 14-56% [6] (Fig. 1).
Ponction à l’aiguille fine (FNP) et diagnostic cytologique : La ponction à l’aiguille fine est très importante pour le diagnostic et la détermination de la procédure à suivre. Les cellules traitées sont évaluées soit selon une classification américaine à 6 niveaux (classification de Bethesda), soit selon une classification britannique à 5 niveaux (classification de Thy). A partir d’un résultat Thy3, un carcinome n’est plus exclu. Le risque de carcinome est ici de 15-40%, de 60-70% pour une Thy4 et de 97-100% pour une Thy5.
Différentes mutations et translocalisations sont aujourd’hui utilisées dans le diagnostic des cancers de la thyroïde et prendront de plus en plus d’importance à l’avenir. Les mutations les plus importantes actuellement sont RAS, B-RAF et hTERT. En fonction de la taille de la lésion focale et du diagnostic cytologique, on procède à une stratification du risque en matière de traitement et de suivi.
Traitement des cancers de la thyroïde
Chirurgie : le traitement primaire du carcinome thyroïdien est la chirurgie. Si, après le traitement histologique, la tumeur est complètement retirée, le patient est considéré comme guéri. C’est le cas lorsque la tumeur mesure moins de 2,0 cm sur la préparation pathologique après une hémi- ou une thyroïdectomie totale, qu’elle a été entièrement retirée et qu’elle présente une différenciation classique.
Dans tous les autres cas, une thyroïdectomie totale sous monitoring des récurrents est indiquée, complétée, en fonction du statut des ganglions lymphatiques, par une dissection ipsilatérale du cou, généralement de niveau III-IV et de niveau VI. Les risques per- et postopératoires sont faibles pour les chirurgiens expérimentés ; les principaux risques sont l’hypoparathyroïdie non réversible et la lésion du nerf laryngé. En fonction de l’histologie, du statut TNM et, de plus en plus, des analyses génétiques, le traitement et le suivi postopératoires appropriés sont déterminés.
Ablation à l’iode radioactif : l’ATA [2] (American Thyroid Association) et l’ETA [4] (European Thyroid Association) ont toutes deux élaboré des directives concernant les indications d’un traitement à l’iode radioactif postopératoire. En fonction de l’histologie, de la taille de la tumeur primaire, de la multifocalité, du nombre/de la taille des ganglions lymphatiques et de la génétique, les patients sont classés en “risque faible”, “risque intermédiaire” ou “risque élevé” pour l’ATA et en “très faible”, “faible” et “risque élevé” pour l’ETA. Un consensus existe pour les patients “very low” et “low risk”, où le risque général de récidive dans les 10 ans est inférieur à 3%, avec ou sans ablation de l’iode radioactif. Il existe également un consensus sur les patients “à haut risque”, pour lesquels une radiothérapie par iode réduit considérablement le risque de récidive à 10 ans. Le grand désaccord concerne les patients “à risque intermédiaire”. L’ATA ne propose l’ablation de l’iode radioactif que pour des patients sélectionnés, alors que les directives européennes ne mentionnent pas les patients “à risque intermédiaire” et recommandent une procédure globalement plus agressive. Cette stratification du risque permet de poser l’indication d’une éventuelle ablation complémentaire de l’iode radioactif, de déterminer les intervalles d’examen dans le cadre du suivi et de définir la TSH cible post-thérapeutique.
L’objectif de la radio-iodothérapie complémentaire est de détecter et d’éliminer les cellules thyroïdiennes ou tumorales laissées en place après l’opération, ce qui facilite le suivi par échographie du cou et mesure de la thyroglobuline. L’isotope 131 iodenaturel utilisé dans le traitement est administré par voie perorale sous forme de capsules et s’accumule en 24 heures presque exclusivement dans les cellules thyroïdiennes et les cellules cancéreuses bien différenciées de la thyroïde et est métabolisé dans ces cellules. La condition préalable est la stimulation des cellules par l’augmentation de la TSH, que ce soit de manière endogène par une carence en hormones thyroïdiennes ou de manière exogène par la rhTSH (Thyrogen). La méthode choisie dépend de la stratification initiale des risques. Les cellules qui absorbent l’iode 131sont détruites et dégradées par l’organisme. Il est ainsi possible de traiter avec succès aussi bien les résultats résiduels dans la loge thyroïdienne, les métastases ganglionnaires que les métastases à distance. Le patient est considéré comme exempt de tumeur si, six mois après une opération ou une ablation d’iode radioactif, il n’y a pas de résultats iodés et si le marqueur tumoral n’est pas mesurable sous stimulation (en général par rhTSH).
Tous les patients sont substitués par des hormones thyroïdiennes (lévothyroxine) en postopératoire. Chez les patients “very low” (ETA uniquement), “low”, “intermediate risk” (ATA uniquement), on vise une TSH de 0,5-2,0 mU/l, chez les patients “high risk” entre 0,1-0,5 mU/l.
Traitement des résultats résiduels (maladie persistante), des métastases et des récidives : si l’ablation à l’iode radioactif révèle des métastases iodovides à distance sur la scintigraphie du corps entier (le plus souvent des métastases pulmonaires ou osseuses), une deuxième radiothérapie à l’iode est effectuée en général 4 à 6 mois après l’ablation à l’iode radioactif, après avoir exclu les métastases non iodovides au moyen d’une TEP/TDM au FDG ou d’une TEP/IRM au FDG. L’effet du traitement peut être mesuré par la scintigraphie du corps entier qui suit et dans le sang par le dosage de la thyroglobuline. En cas de bonne réponse, les métastases iodées régressent complètement et la thyroglobuline diminue jusqu’à ce qu’elle ne soit plus mesurable après 3 à 6 mois (fig. 3-5).
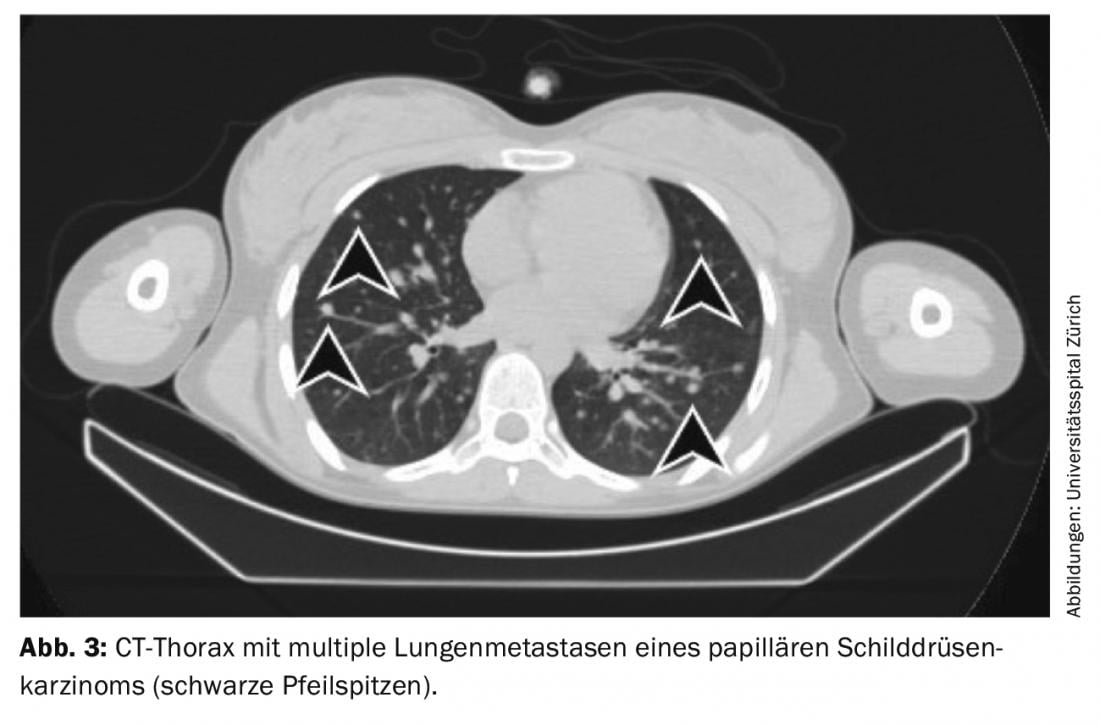
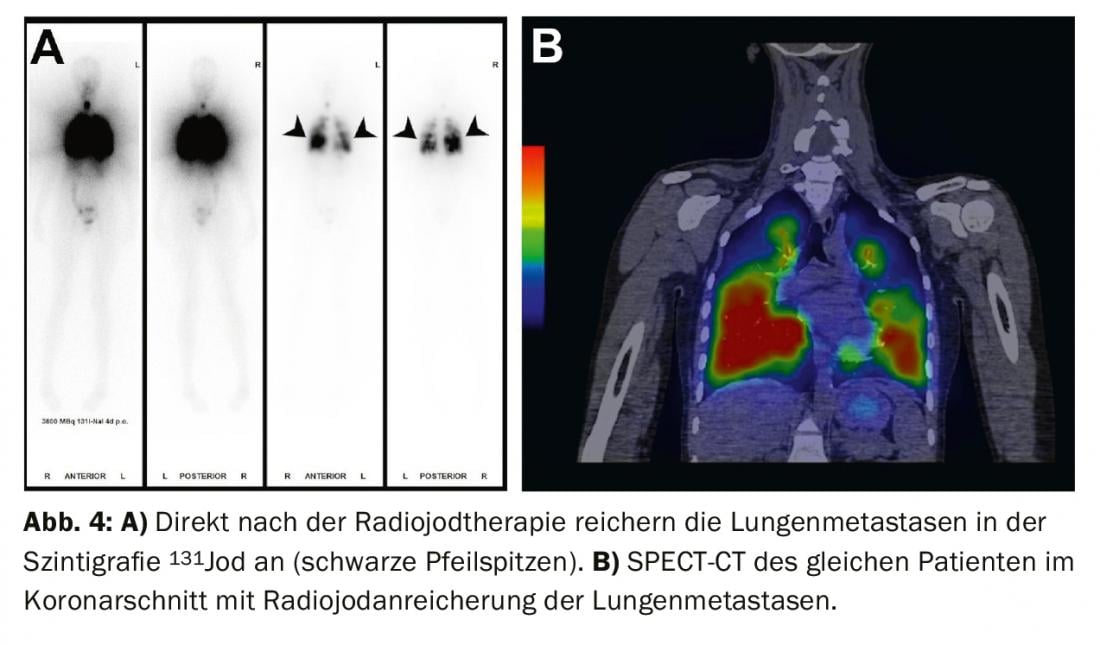
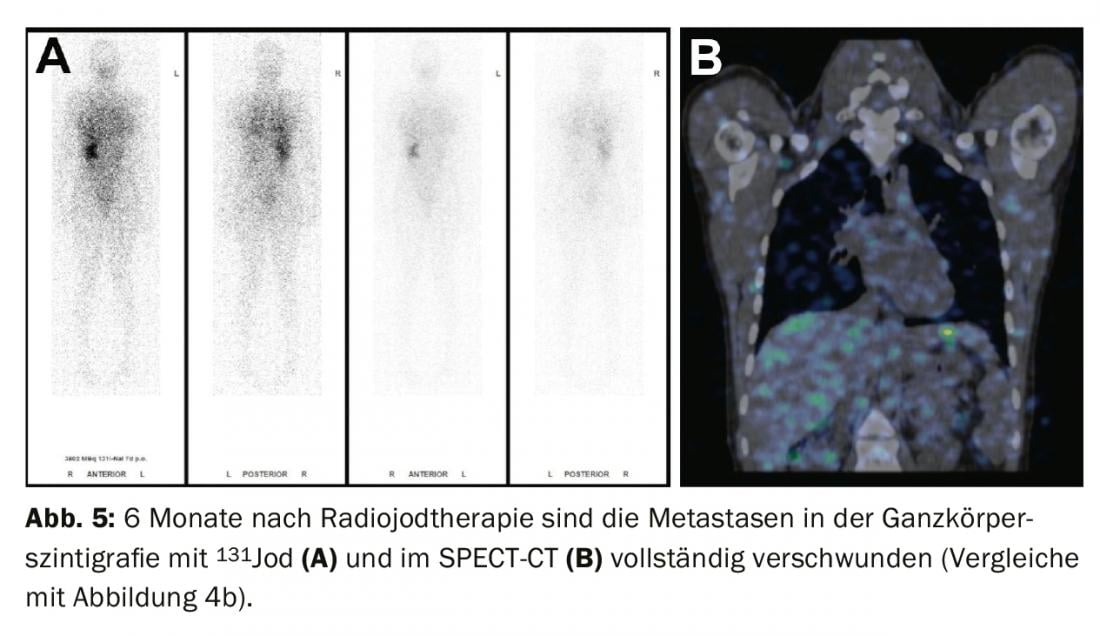
Si, au cours du suivi de la tumeur, la thyroglobuline augmente ou si des ganglions suspects apparaissent à l’échographie du cou, le diagnostic doit être confirmé en premier lieu par cytologie. Une thérapie à l’iode radioactif est ensuite recommandée, dans le but de traiter les métastases et de compléter ou d’adapter le staging.
La thérapie à l’iode radioactif peut être répétée tant que les métastases stockent de l’iode et qu’une baisse de la thyroglobuline peut être documentée. Cependant, chaque traitement à l’iode radioactif augmente le risque de formation de cellules tumorales réfractaires à l’iode radioactif. De plus, à partir d’environ 22 GBq de dose cumulée au foyer (ce qui correspond à environ 4-5 thérapies), le risque de développer une deuxième tumeur augmente. Les plus fréquentes sont les leucémies. La période de latence est d’environ 10 ans. La radiothérapie à l’iode est contre-indiquée si les métastases se dédifférencient, c’est-à-dire si elles ne stockent plus d’iode ou si la thyroglobuline ne baisse plus.
Carcinomes thyroïdiens radioréfractaires : Les carcinomes thyroïdiens radioréfractaires à l’iode sont rares. L’incidence est estimée à environ 4 à 5 cas pour une population d’un million. Il concerne principalement les patients âgés présentant des métastases étendues, des carcinomes mal différenciés et des manifestations tumorales fortement avides de FDG. Le taux de survie à 10 ans n’est que de 10% pour les cancers de la thyroïde réfractaires à l’iode radioactif [6].
Possibilités de traitement et prise en charge des carcinomes réfractaires à l’iode : En cas de carcinome thyroïdien réfractaire à l’iode radioactif, la suppression de la TSH sérique revêt une grande importance. Dans de telles situations, une substitution par lévothyroxine avec une TSH cible de <0,1 mU/l est recommandée. Les options thérapeutiques sont un traitement systémique avec des inhibiteurs de tyrosine kinase ou une radiothérapie percutanée.
Radiothérapie : la radiothérapie percutanée peut être utilisée pour les métastases osseuses singulières, localement au niveau cervical lorsqu’il existe une métastase disséminée sans corrélat morphologique à l’imagerie, ou lorsque le patient n’est plus opérable.
Chimiothérapie classique : la chimiothérapie classique est moins bien établie dans le traitement des cancers de la thyroïde. Ainsi, les traitements par doxorubicine présentent une réponse de 0 à 20% avec une toxicité élevée. Les thérapies combinées à base de doxorubicine et de cisplatine ne sont pas non plus prometteuses.
Thérapie moléculaire ciblée – inhibiteurs de tyrosine kinase [6] : Le traitement systémique par inhibiteurs de tyrosine kinase est le plus établi pour les cancers de la thyroïde réfractaires à l’iode. L’indication d’une thérapie systémique dépend de plusieurs facteurs. Le taux de progression d’une tumeur peut être évalué par le temps de doublement de la thyroglobuline. Mais il faut aussi toujours utiliser l’imagerie pour confirmer la progression anatomique de la tumeur à l’aide de RECIST (Response Evaluation Criteria in Solid Tumors). Une progression est définie comme une augmentation de la taille des lésions cibles de plus de 20% ou de plus de 5 mm, une nette augmentation de la taille des lésions non cibles ou l’apparition de nouvelles lésions.
Chez les patients présentant de multiples métastases >1-2 cm et une progression RECIST dans les 12 mois, un traitement systémique est recommandé. En revanche, en cas de métastases peu nombreuses et de petite taille <1 cm sans progression RECIST dans les 12 mois , aucun traitement systémique n’est recommandé. Au lieu de cela, il est possible d’adopter une attitude attentiste avec des contrôles réguliers de l’évolution par imagerie et en laboratoire (“surveillance active”).
Les inhibiteurs de tyrosine kinase sont principalement des inhibiteurs anti-angiogéniques, et entraînent une inhibition de la croissance des cellules tumorales. La survie sans progression par rapport au placebo est de 18,3 contre 3,6 mois pour le lenvatinib, de 10,8 contre 5,8 mois pour le sorafénib et de 11,1 contre 5,9 mois pour le vandétanib mois [6].
Une réponse tumorale est surtout observée pour les métastases des ganglions lymphatiques, du foie et des poumons. Les métastases osseuses montrent une moins bonne réponse tumorale. Il est fréquent de constater une progression des métastases osseuses pendant le traitement par inhibiteurs de tyrosine kinase, malgré la réponse des autres métastases d’organes ou de ganglions lymphatiques. Dans ces cas, l’administration supplémentaire de bisphosphonates ou de dénosumab peut être discutée. Dans deux tiers des cas, les complications dues aux métastases osseuses se développent dans l’année qui suit.
La durée optimale du traitement n’est pas connue. Souvent, le traitement est maintenu jusqu’à ce que les effets secondaires (diarrhée, fatigue, toxicité cutanée, hypertension, besoins accrus en thyroxine, toxicité hépatique, saignements, thromboses, fistule gastro-intestinale, insuffisance cardiaque) prennent le dessus ou que l’on observe une progression de la tumeur. On ne sait pas si le traitement doit être poursuivi en cas de progression tumorale légère seulement ou en cas de réponse tumorale et de progression simultanées. Les patients présentant des interruptions prolongées entre les cycles de traitement présentent un risque accru de progression tumorale accélérée.
Messages Take-Home
- Les patients atteints de cancers de la thyroïde bien différenciés ont généralement un très bon pronostic.
- Un bon bilan préopératoire permet d’optimiser la planification de l’opération.
- La stratification du risque postopératoire doit être effectuée dans un centre disposant d’un conseil thyroïdien dédié.
- Le traitement et le suivi postopératoires doivent être effectués dans un centre thyroïdien pour les patients à partir d’une situation de “risque intermédiaire”.
Littérature :
- ACS. Société américaine du cancer [Internet]. 2019 [cited 2019 Sep 23];Disponible à partir de : www.cancer.org/cancer/thyroid-cancer/about/key-statistics.html
- Haugen BR, Alexander EK, Bible KC, et al. : 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer : The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroïde. 2016; doi:10.1089/thy.2015.0020
- NICER. Institut national d’épidémiologie et d’enregistrement du cancer [Internet]. 2019 [cited 2019 Sep 23]; Disponible à partir de : www.nicer.org
- Pacini F, Schlumberger M, Dralle H, et al : Consensus européen pour la prise en charge des patients atteints de carcinome thyroïdien différencié de l’épithélium folliculaire. Eur. J. Endocrinol. 2006 ; doi:10.1530/eje.1.02158
- Russ G, Bonnema SJ, Erdogan MF, et al : European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults : The EU-TIRADS. Eur. Thyroid J. 2017 ; doi:10.1159/000478927
- Schlumberger M, Pacini F, Tuttel RM : Tumeurs thyroïdiennes. 4e éd. tcgraphite ; 2015.
- Tessler FN, Middleton WD, Grant EG, et al. : ACR Thyroid Imaging, Reporting and Data System (TI-RADS) : White Paper of the ACR TI-RADS Committee. J. Am. Coll. Radiol. 2017 ; doi:10.1016/j.jacr.2017.01.046
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(5) : 6-10