Le syndrome de l’intestin court (SCC) est une forme de défaillance intestinale qui survient en postopératoire après une résection intestinale étendue ou en raison d’une autre restriction fonctionnelle de certaines parties de l’intestin. Selon l’ampleur de la restriction, d’autres formes de supplémentation nutritionnelle sont indiquées. Une thérapie nutritionnelle spécifique peut permettre à certains patients de retrouver leur autonomie alimentaire par voie orale.
Le syndrome de l’intestin court est une maladie rare, potentiellement mortelle, dont la prévalence en Allemagne est estimée à 34 pour un million d’habitants [1]. Le guide S3 actuel de la Société allemande de médecine nutritionnelle (DGEM) définit l’insuffisance intestinale comme l’incapacité à maintenir l’équilibre protéique, énergétique, hydrique et en micronutriments en raison d’une capacité d’absorption intestinale réduite (obstruction, dysmotilité, maladie congénitale, diminution de l’absorption associée à une maladie) [2]. Le syndrome de l’intestin court désigne une forme de défaillance intestinale qui survient en postopératoire après une résection intestinale étendue ou en raison d’une autre restriction fonctionnelle de certaines parties de l’intestin. Les causes les plus fréquentes sont les carcinomes, les infarctus mésentériques, la maladie de Crohn et les brides postopératoires [3].
Le KDS est cliniquement indiqué dès que la longueur de l’intestin restant est inférieure à 200 cm [4]. L’ampleur de la malnutrition et les symptômes individuels dépendent de la partie de l’intestin concernée et de son degré d’atteinte, d’autant plus que les substances absorbées sont différentes selon la partie concernée. Les processus adaptatifs, la maladie sous-jacente et la comorbidité ont également une influence [5].
Typage et supplémentation nutritionnelle
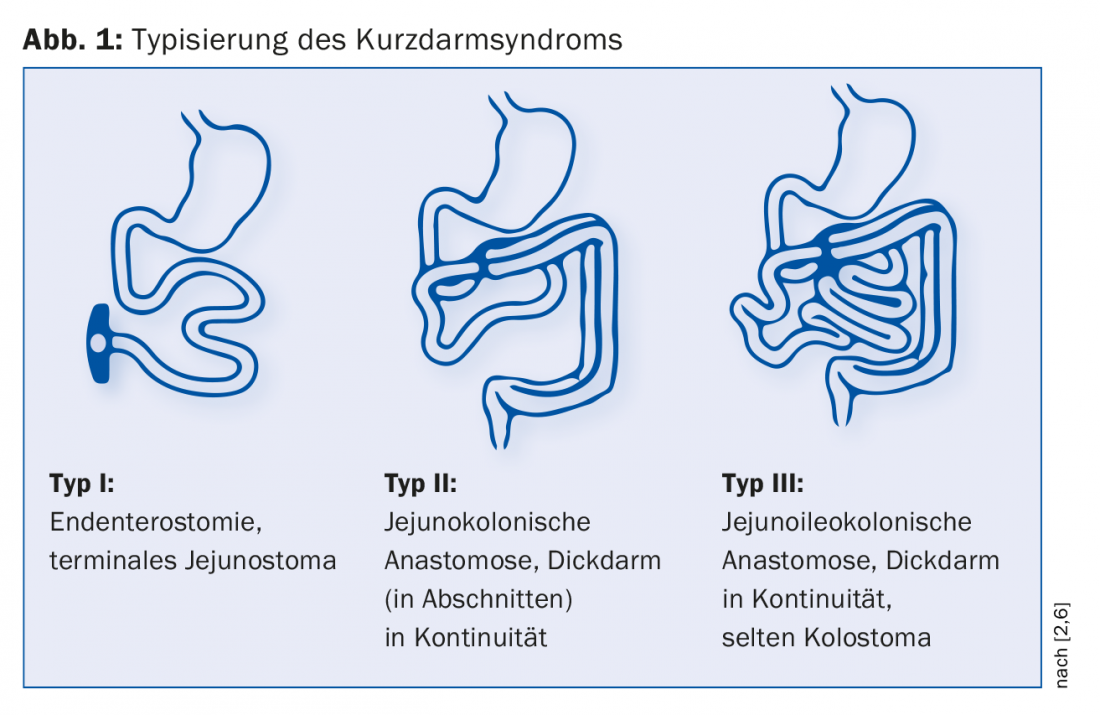
On distingue trois types de SDRC postopératoires selon le laiton (Fig. 1) [6]. L’endentérostomie est le cas le plus difficile en raison de l’absence à la fois de l’iléon et du côlon. “Ici, il y a de gros problèmes comme la déshydratation avec une sortie élevée de la stomie”, explique le Dr Krieger-Grübel. Le type d’intestin grêle a une influence significative sur l’évolution de la maladie : “S’il reste moins d’un mètre d’intestin grêle avec une stomie terminale de l’intestin grêle, les patients dépendent de la nutrition parentérale et des solutions salines. En revanche, s’ils disposent de plus d’un mètre d’intestin grêle et que le côlon est présent de manière continue, ils n’auront probablement pas besoin de traitement nutritionnel de soutien à long terme”. L’influence de la longueur du côlon résiduel sur la mortalité a été démontrée dans une étude : Après cinq ans, la probabilité de survie des patients ayant un côlon en continuité était supérieure de 30% à celle des patients ayant une endentérostomie [6].
Thérapie nutritionnelle spécifique à chaque phase
L’objectif premier est d’assurer l’équilibre hydrique et nutritionnel et la prophylaxie des complications. En fonction de l’état du tractus gastro-intestinal, un traitement approprié devrait également permettre aux patients de retrouver une alimentation orale autonome [7].
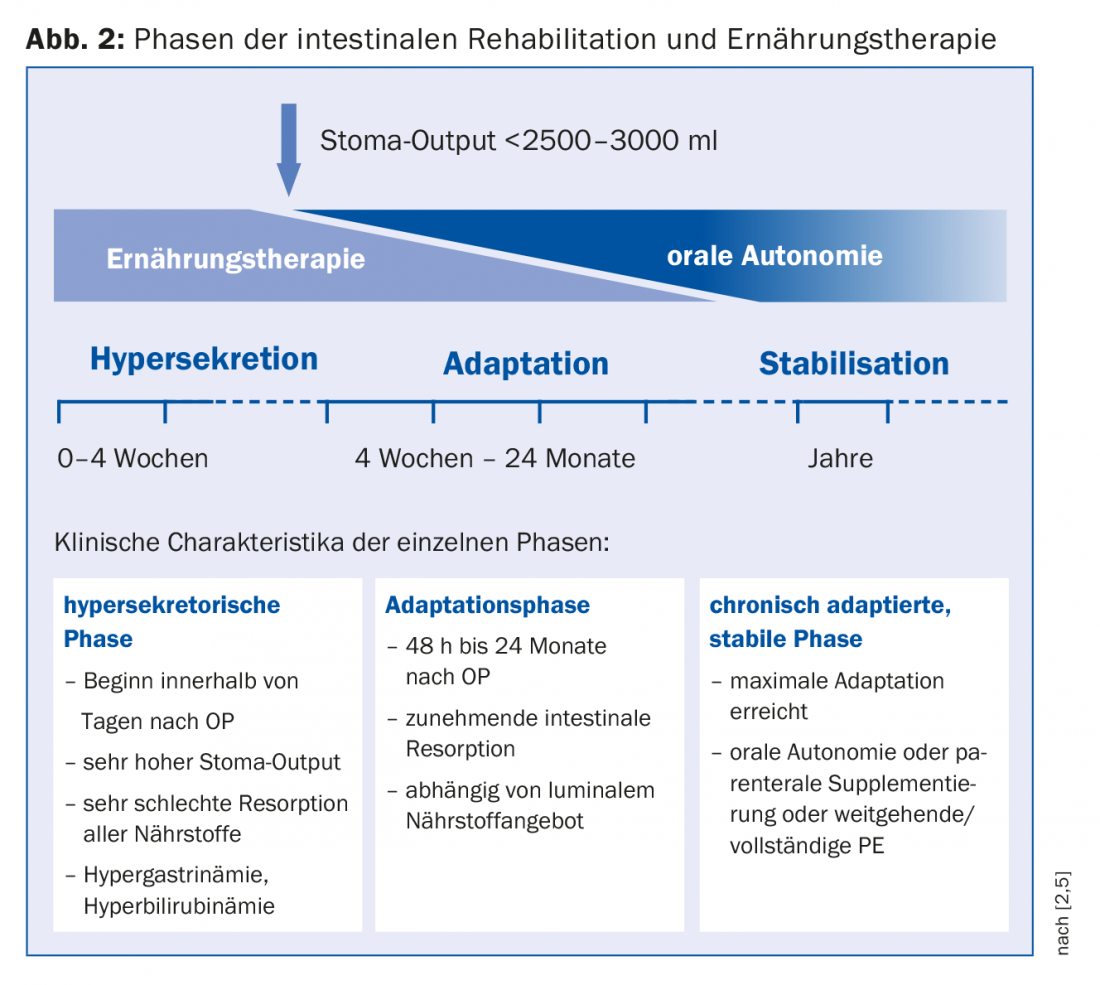
Pour planifier le traitement, il est utile de diviser la phase d’hypersécrétion, la phase d’adaptation et la phase de stabilisation, ces phases s’enchaînant les unes aux autres (Fig. 2) [1]. Chaque phase nécessite une stratégie nutritionnelle spécifique. Immédiatement après l’opération, on observe initialement une hypersécrétion sous la forme d’une stomie à débit élevé et de diarrhées. Dans ce cas, la nutrition parentérale (NP) est indispensable en raison de la malabsorption de tous les nutriments. La surveillance de l’homéostasie des fluides est essentielle. Pour vérifier l’état d’hydratation (15 ml de liquide/kg de poids corporel sont nécessaires à l’élimination des substances urinaires), le sodium est un paramètre sensible, une quantité de >20 mmol/l étant considérée comme suffisante. Lorsque l’évacuation de la stomie a pu être réduite (<2500-3000 ml), l’alimentation orale peut être commencée. “La nutrition entérale est le véritable déclencheur de la prolifération cellulaire”, souligne le Dr Krieger-Grübel. Elle entraîne une croissance cellulaire ainsi qu’une augmentation de la villosité et, grâce à une circulation intestinale plus importante, une amélioration de la capacité d’absorption. Toutefois, comme il faut en principe s’attendre à une augmentation de la demande d’énergie, l’EP ne doit pas être arrêté prématurément [8]. Les recommandations pour la thérapie nutritionnelle orale pendant la phase d’adaptation sont résumées dans le tableau 1. “Pour la réhydratation, une combinaison de sodium et de glucose est éminemment importante, car l’absorption du glucose dans la cellule est couplée au sodium”. Les liquides doivent donc être salés. Pour un jus de pomme dilué au 1:3, on obtiendrait alors près de 5 g de sel (1 cuillère à café), ce qui correspond à environ 100 mmol. En cas de malabsorption des graisses, l’administration d’acides gras à chaîne moyenne est indiquée si le côlon est préservé. D’autres complications en cas de colon préservé, telles que les calculs rénaux, peuvent être prévenues par un apport accru de calcium, qui est responsable de la fixation de l’oxalate, ainsi que par une réduction de principe des aliments contenant de l’oxalate.

Médication
L’objectif des mesures pharmaceutiques est de réduire la sécrétion et de ralentir la motilité. Les médicaments antisécrétoires sont, par exemple, les suivants Inhibiteurs de la pompe à protons, qui inhibent la H+/K+-ATPase dans la cellule de Beleg, ou analogues de la somatostatine. L’octréotide, par exemple, freine divers peptides, hormones et la sécrétion pancréatique, mais entraîne également une réduction du flux sanguin et de l’absorption des aliments.
Pour lutter contre l’augmentation de la motilité, on utilise d’abord le lopéramide. Si l’effet est trop faible, on peut ensuite administrer de la teinture d’opium. Le lopéramide et la teinture d’opium agissent en stimulant les récepteurs opioïdes gastro-intestinaux. La motilité propulsive est bloquée, ce qui entraîne une augmentation de la réabsorption des liquides, une diminution des sécrétions et une augmentation du tonus du sphincter anal [9]. D’autres possibilités médicamenteuses offrent la cholestyramine (diarrhée cholérique en cas de côlon en continuité), les enzymes pancréatiques en cas de stéatorrhée et les fibres solubles pour lier davantage le liquide intestinal. Une nouvelle étude montre un effet du teduglutide chez les patients sans côlon et avec stomie : dans ce groupe de patients, l’apport en liquide parentéral a pu être réduit de 40%, alors que le groupe placebo n’a obtenu qu’une réduction de 19% ; en revanche, aucun effet n’a été constaté chez les patients avec côlon en continuité [11].
Source : Congrès de printemps de la SSAI, 30 mai – 1er juin 2018, Bâle
Littérature :
- Websky MW, et al. : Le syndrome de l’intestin court en Allemagne. Prévalence estimée et situation des soins. Chirurgien 2014 ; 85(5) : 433-439.
- Lamprecht G, et al. : S3-Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin e.V. in Zusammenarbeit mit der AKE, der GESKES und der DGVS. Nutrition clinique en gastroentérologie (partie 3) – Insuffisance intestinale chronique. Aktuelle Ernährungsmedizin 2014 ; 39(2) : e57-e71.
- Krafft T, et al : Résultat à long terme en cas d’insuffisance intestinale chronique : caractéristiques, pronostic et complications. Z Gastroenterol 2013 ; 51 : K285.
- Pironi L, et al : ESPEN guidelines on chronic intestinal failure in adults. Clinical Nutrition 2016 ; 35(2) : 247-307.
- Karber M, et al. : Insuffisance intestinale chronique et syndrome de l’intestin court. Compendium de la nutrition parentérale à domicile (NPD). Lignes directrices KDS Charité Berlin. 2015.
- Messing B, et al : Long-term survival and parenteral nutrition dependence in adult patients with the short bowel syndrome. Gastroenterol 1999 ; 117(5) : 1043-1050.
- O’Keefe SJ, et al : Syndrome de l’intestin court et défaillance intestinale : définitions consensuelles et vue d’ensemble. Clin Gastroenterol Hepatol 2006 ; 4 : 6-10.
- Leuenberger M, et al. : Le syndrome de l’intestin court : un défi interdisciplinaire. Médecine nutritionnelle actuelle 2006 ; 31 : 235-242.
- Dorfschmid M, Sinik-Agan C : Défaillance intestinale – Thérapie nutritionnelle du syndrome de l’intestin court. Schw Z Ernährungsmed 2017 ; 1 : 10-18.
- Jeppesen PB, et al : Factors Associated With Response to Teduglutide in Patients With Short-Bowel Syndrome and Intestinal Failure. Gastroenterol 2018 ; 154(4) : 874-885.
- Matarese LE : Nutrition and fluid optimization for patients with short bowel syndrome. JPEN 2013 ; 37(2) : 161-170.
HAUSARZT PRAXIS 2018 ; 13(7) – publié le 8.6.18 (ahead of print)











