Le cancer de l’ovaire est devenu une maladie chronique. Les séquences thérapeutiques comprenant la chirurgie, les thérapies systémiques additives et palliatives, ainsi que les thérapies d’entretien dans différentes lignes sont complexes. La discussion des données actuelles aide à les mettre en pratique dans la pratique clinique quotidienne.
Le cancer de l’ovaire est devenu une maladie chronique, les séquences thérapeutiques comprenant la chirurgie, les thérapies systémiques additives et palliatives, ainsi que les thérapies d’entretien dans différentes lignes sont complexes. Comment utiliser les nombreuses nouvelles données dans notre vie quotidienne ? Les directives récemment publiées par l’ESMO/ESGO [1] constituent une orientation utile à cet égard. Cet article récapitulatif présente les nouveautés et les points importants de 2019.
Le cancer de l’ovaire, à 90% d’origine épithéliale, est de loin la tumeur gynécologique ayant la plus forte mortalité dans les pays industrialisés. En Europe, environ 65 000 femmes en sont atteintes chaque année et environ 42 000 en meurent. Malheureusement, dans environ deux tiers des cas, le diagnostic continue d’être posé à des stades avancés (FIGO III, IV), lorsque la maladie a déjà pu se propager en dehors du pelvis. Dans ce cas, la survie à 5 ans n’est que d’environ 20-30% [2]. Malheureusement, nous ne disposons pas d’examens de dépistage qui permettraient d’améliorer le pronostic (par ex. échographie transvaginale, dosage des marqueurs tumoraux [CA-125]) [3]. Des approches thérapeutiques optimisées sont mises en œuvre pour améliorer le pronostic des femmes atteintes d’un cancer de l’ovaire. Il reste beaucoup à faire dans ce domaine.
Traitement primaire
Chirurgie ou chimiothérapie : que faire en premier ? La chirurgie cytoréductrice maximale visant à obtenir une absence macroscopique de tumeur à la fin de l’opération est essentielle pour le pronostic [4].
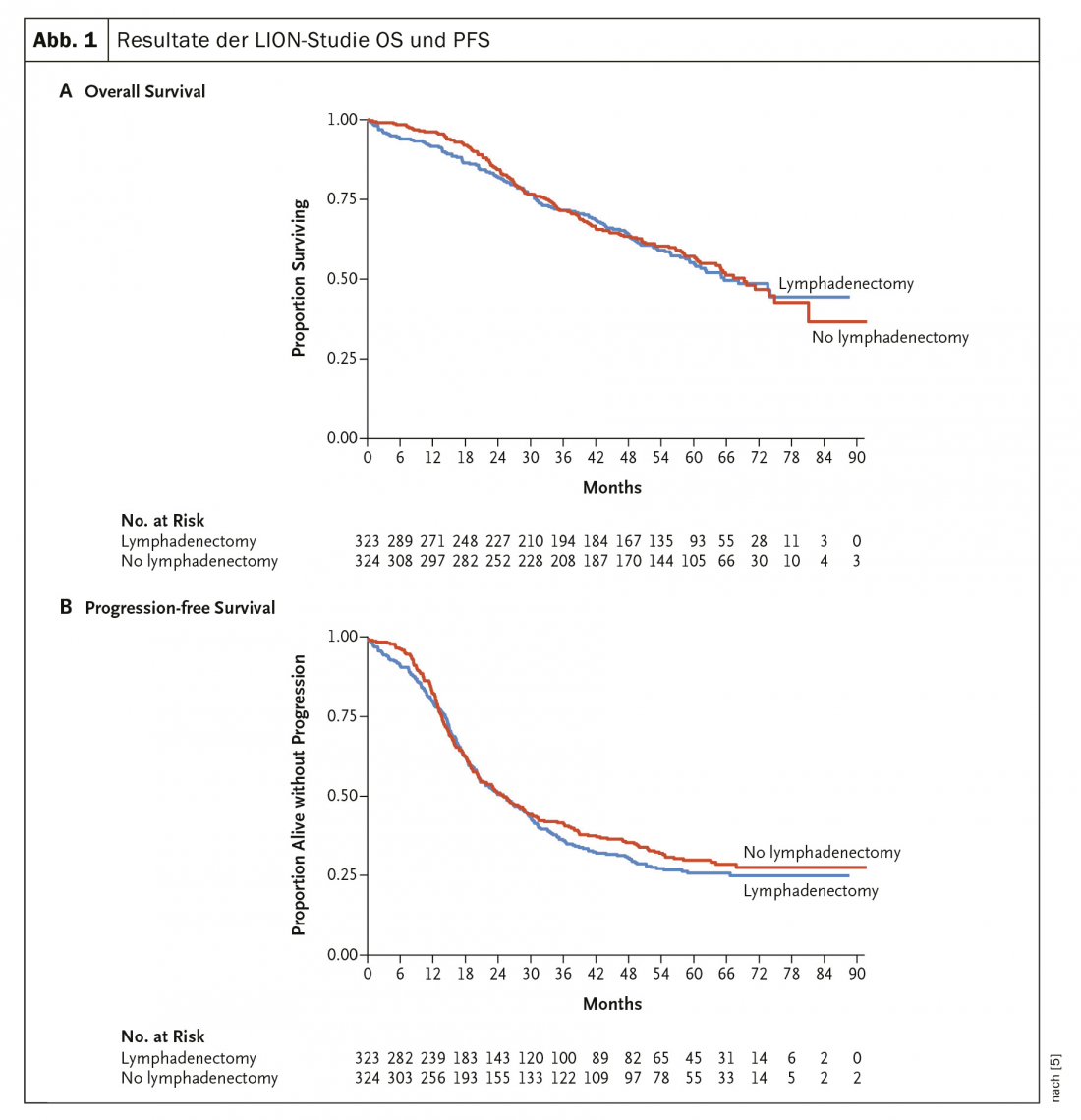
En 2019, les résultats (attendus depuis longtemps) de l’étude LION [5] ont été publiés. Cette étude a examiné la valeur de la lymphadénectomie de routine dans le cancer de l’ovaire avancé (fig. 1). Cette étude randomisée n’a montré aucune différence en termes de PFS ou d’OS. La lymphadénectomie paraaortique et pelvienne systématique en cas de ganglions lymphatiques normaux en pré- et peropératoire en cas de résection complète n’est donc plus recommandée. Dans les stades avancés, la norme est une chimiothérapie additive avec du carboplatine et du taxol.
Faut-il opérer d’abord, puis utiliser la chimiothérapie, ou existe-t-il des preuves que les patientes bénéficient d’une thérapie systémique primaire, suivie de la chirurgie ? Une étude EORTC et l’étude CHORUS [6,7] ont montré des résultats comparables pour les deux options en termes de PFS et d’OS chez les patientes en stade IIIC ou IV.
En conséquence, la recommandation ESMO/ESGO est désormais qu’une approche chirurgicale primaire (UDS, upfront debulking surgery) doit être choisie si une absence macroscopique de tumeur peut être obtenue (sur la base d’un staging préopératoire) et si une morbidité acceptable est supposée [1]. Si ce n’est pas le cas, une thérapie systémique primaire doit être mise en place.
C’est pourquoi une étude internationale multicentrique (Trial on Radical Upfront Surgical Therapy TRUST) est actuellement en cours, dans laquelle les chirurgiens participants doivent se qualifier selon des critères choisis. Résultats attendus vers 2024.
Quelles sont nos possibilités d’améliorer le pronostic avec les thérapies systémiques disponibles ? L’étude japonaise JGOG3016 a montré qu’un traitement à dose réduite avec du paclitaxel 80 mg/m2 en association avec du carboplatine permettait d’obtenir une nette amélioration de la survie sans progression médiane et de la survie globale par rapport au traitement standard [8]. Néanmoins, ce régime thérapeutique n’est guère applicable en Europe en raison d’une toxicité importante, de sorte que les directives ESMO/ESGO récemment révisées ne le recommandent pas aux patientes des pays occidentaux [1].
Le bevacizumab en traitement de première ligne
Le bevacizumab, un anticorps monoclonal anti-VEGF, est autorisé en association avec la chimiothérapie dans les situations dites à haut risque, dans le type de cancer de l’ovaire le plus fréquent, le cancer séreux de haut grade (HGSC). Sont considérées à haut risque les formations tumorales résiduelles postopératoires ≥1 cm ou un stade FIGO IV. Le bevacizumab a permis de montrer une amélioration de la PFS dans plusieurs études randomisées. Un avantage en termes de survie n’a été décrit que dans l’étude ICON7 [9,10]. On ne connaît pas de biomarqueur prédictif pour le traitement par bevacizumab.
Traitement d’entretien en première ligne
Le bevacizumab est d’abord administré en association avec la chimiothérapie additive dans les situations à haut risque, puis en entretien à la dose de 15 mg/kg ou 7,5 mg/kg toutes les 3 semaines pendant une durée maximale de 3 ans. 15 mois recommandé [1,9,10].
Inhibiteurs de la poly(ADP-ribose) polymérase (PARP) : environ 50% des cancers épithéliaux de l’ovaire (EOC) présentent des mécanismes de réparation de l’ADN déficients via recombinaison homologue. Cette circonstance explique également la forte efficacité de la platine dans l’EOC. Les inhibiteurs de la PARP entraînent une létalité dite synthétique dans les cellules déficientes en HR. Cependant, ils montrent également une efficacité chez les patientes sans défauts avérés dans les gènes HR. Plusieurs inhibiteurs de la PARP ont été testés (olaparib, niraparib, rucaparib et autres).
Les résultats de l’étude SOLO1, qui ont montré une amélioration de 70% de la PFS par rapport au placebo chez les patientes porteuses d’un gène BRCA muté sous traitement d’entretien par l’olaparib en première ligne, ont fait grand bruit [11,12]. Le conseil et le dépistage génétiques (en temps réel) en vue de l’obtention de l’olaparib dans cette situation sont désormais fortement recommandés [1].
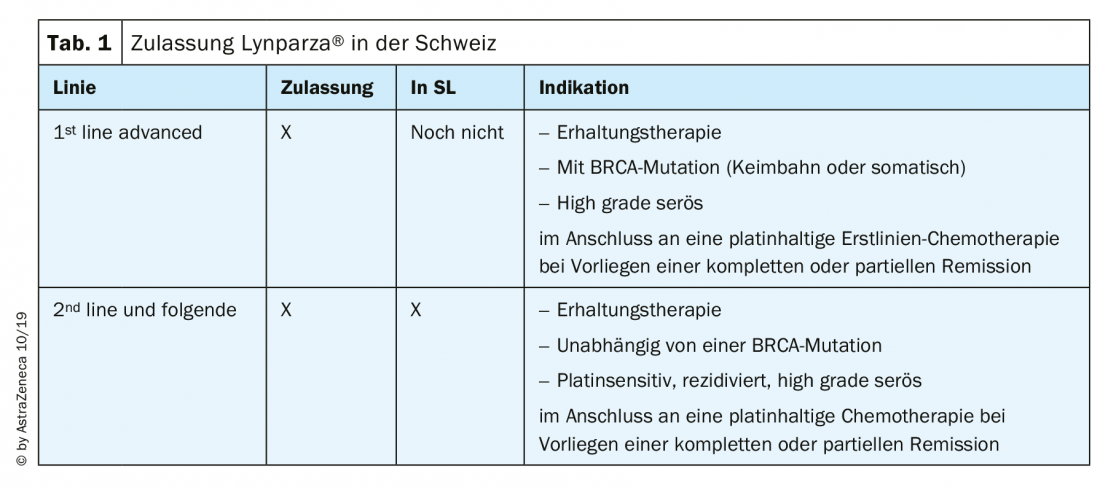
Les deux substances les plus fréquemment utilisées en Suisse, l’olaparib (Lynparza®) et le niraparib (Zejula®), sont autorisées et disponibles chez nous pour le cancer de l’ovaire de la manière suivante (tab. 1) : Niraparib est admis par les caisses-maladie depuis août 2019 pour le traitement d’entretien du cancer de l’ovaire sensible au platine en récidive, indépendamment du statut mutationnel BRCA [13]. De nombreuses données sur les inhibiteurs de PARP ont été présentées à l’ESMO 2019 et font désormais l’objet de discussions intensives.
Procédure pratique pour le traitement de première ligne
Dans notre clinique, nous proposons désormais à toutes les patientes atteintes d’un cancer de l’ovaire non mucineux de bénéficier d’un conseil génétique et de passer un test de dépistage des mutations BRCA1/2 (le plus souvent germinales, rarement somatiques). Cela se produit généralement pendant la chimiothérapie additive. Dans le cas d’une mutation BRCA1,2, l’olaparib est utilisé comme traitement d’entretien ; dans le cas des types BRCA sauvages, un traitement d’entretien par bevacizumab est éventuellement administré si le bevacizumab a déjà été utilisé pendant la chimiothérapie.
En cas de récidive sensible au platine, un traitement d’entretien par niraparib peut être suivi, indépendamment du statut mutationnel BRCA1,2. En cas de récidive éventuelle, nous utilisons alors le bevacizumab, en combinaison avec des platines si elles sont encore sensibles.
Le test génétique est clairement recommandé dans les directives ESMO/ESGO, d’une part parce qu’il est prédictif d’une réponse, d’autre part parce qu’il permet aux membres de la famille en bonne santé d’être conseillés et testés à un stade précoce [1].
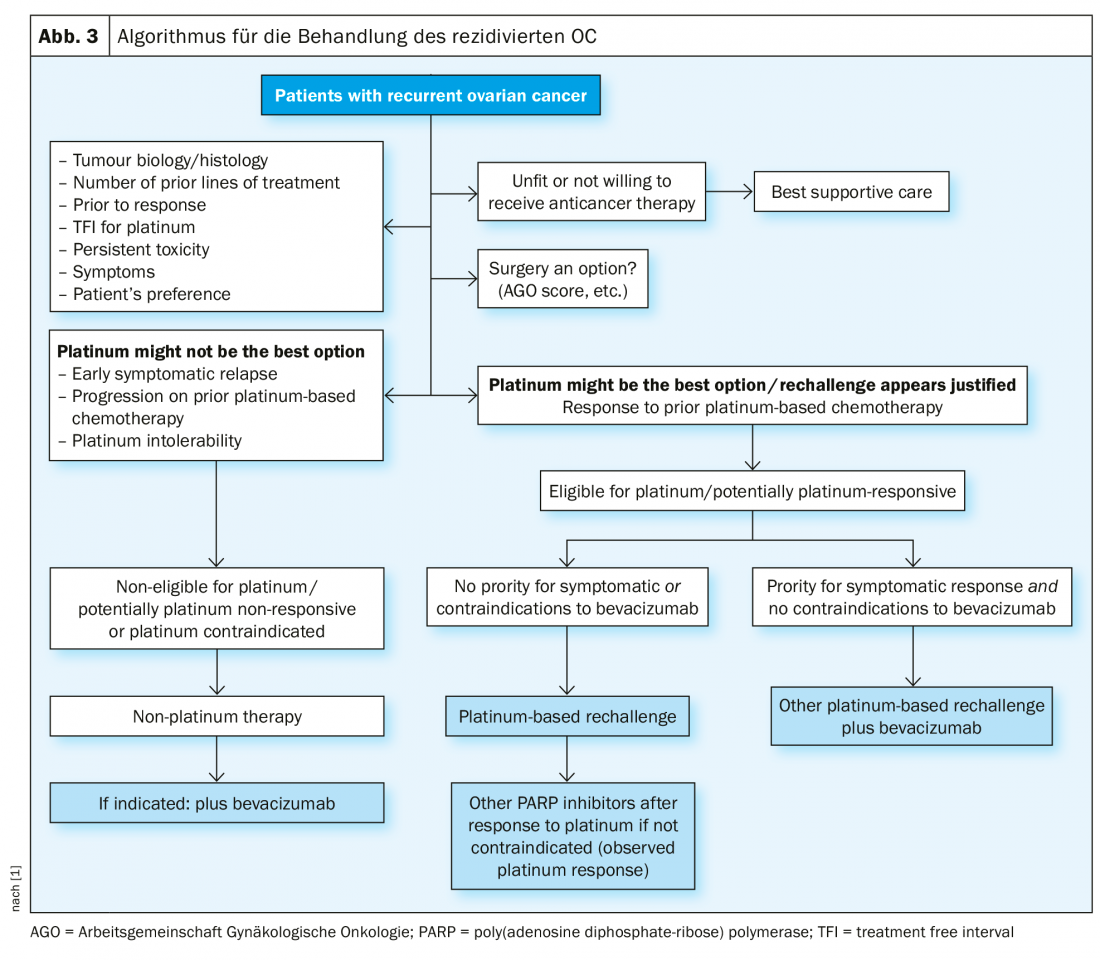
Traitement des récidives
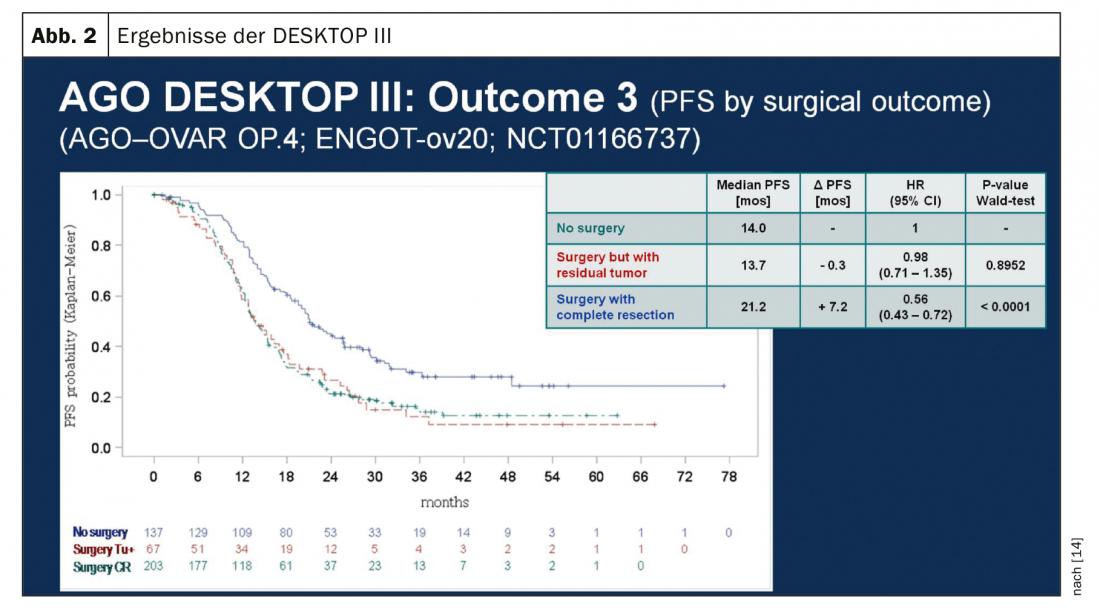
En cas de récidive sensible au platine, une nouvelle opération cytoréductrice est une option thérapeutique si elle permet d’obtenir une absence macroscopique de tumeur. Les résultats de l’étude de l’AGO (Arbeitsgemeinschaft Gynäkologische Onkologie) DESKTOP III ont démontré une amélioration de la PFS avec la chirurgie uniquement lorsqu’une ablation chirurgicale complète a pu être réalisée [14]. Les données sur l’OS n’ont pas encore été publiées (fig. 2). En cas de sensibilité au platine, de nombreuses thérapies combinées ont été testées (tab. 2).
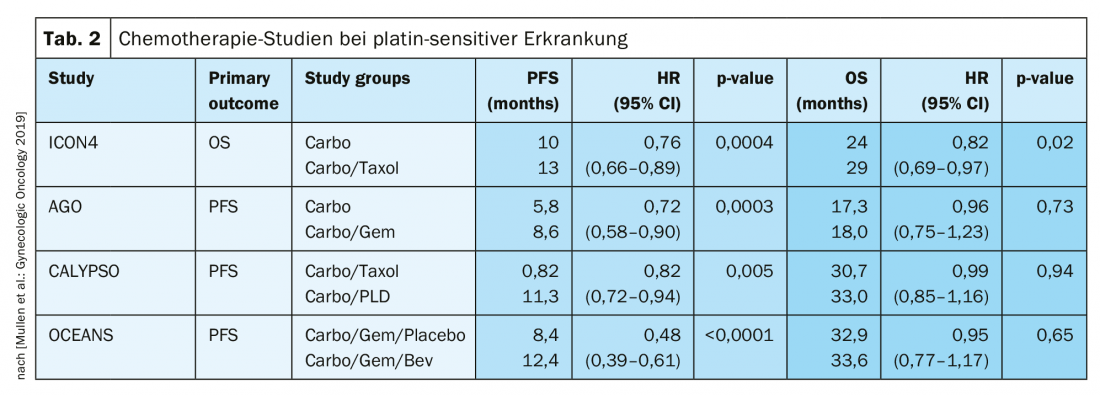
La sensibilité au platine est redéfinie
Par le passé, un intervalle de 6 mois après la dernière thérapie au platine était considéré comme une indication forte d’une nouvelle sensibilité au platine. Toutefois, cela ne reflète pas le fait que cette période doit être considérée comme un continuum. Le terme de “platinum-eligibility” a été choisi à cet effet. La définition de la résistance au platine est désormais la suivante :
-
Résistance confirmée au platine : progression sous chimiothérapie à base de platine
- Résistance présumée au platine : récidive symptomatique précoce avec faible probabilité de réponse ultérieure au platine [1].
Dans cette situation difficile sur le plan thérapeutique, les régimes de traitement sans platine s’imposent, éventuellement en combinaison avec le bévacizumab [15]. Il a d’ailleurs été présenté à l’ASCO 2018 que la réadministration de bevacizumab améliore la PFS, même si elle a déjà été utilisée auparavant [16].
Inhibiteurs de la PARP
En situation de récidive, la réponse au platine est le meilleur marqueur prédictif de l’efficacité des inhibiteurs de PARP en traitement d’entretien. Un traitement d’entretien par l’olaparib après une chimiothérapie à base de platine a montré une amélioration de la PFS chez les patientes porteuses de mutations BRCA1/2 dans l’étude dite Study 19 [17] et dans l’étude SOLO2 [18]. D’autres inhibiteurs de la PARP ont suivi, par exemple le niraparib (NOVA trial [19], le rucaparib (ARIEL3 [20]).
L’étude NOVA a clairement montré que la PFS était améliorée avec le niraparib par rapport au placebo chez les patientes présentant des mutations BRCA ainsi que chez les types sauvages, même si le bénéfice était le plus important chez les patientes présentant des mutations BRCA. Les études sur les traitements d’entretien avec l’olaparib et le niraparib ont également montré que le délai avant la prochaine chimiothérapie pouvait être prolongé de manière significative. C’est un critère d’évaluation absolument significatif sur le plan clinique. La tolérance des inhibiteurs de PARP est généralement bonne, des réductions de dose sont parfois nécessaires (Fig. 3).
Résumé
Le traitement de première ligne du carcinome épithélial de l’ovaire (généralement séreux de haut grade) consiste généralement en une chirurgie et une chimiothérapie à base de platine. Un conseil génétique et un test (somatique ou germinal) devraient être proposés aux patientes à un stade précoce, d’autant plus que chez les patientes mutées BRCA1,2, un traitement d’entretien par olaparib améliore nettement la survie sans progression. Le bevacizumab est poursuivi en entretien s’il a déjà été utilisé en association avec la chimiothérapie additive.
En cas de récidive sensible au platine (nouvelle définition, dite platinum-eligible), une nouvelle approche chirurgicale peut être envisagée dans certaines conditions, suivie d’une chimiothérapie à base de platine, éventuellement complétée par du bevacizumab (qui peut alors être poursuivi en entretien). Après une réponse au platine en situation de récidive, l’inhibiteur de PARP Niraparib est autorisé en Suisse pour les patientes mutées BRCA et de type sauvage. Lorsque les platines ne sont plus indiquées, des régimes de traitement sans platine sont également disponibles. L’immunothérapie du cancer de l’ovaire connaît actuellement un développement rapide, mais aucune substance n’a encore été approuvée comme traitement standard [21].
Messages Take-Home
- Le cancer de l’ovaire est la tumeur gynécologique dont la mortalité est la plus élevée dans le monde occidental.
- Des séquences complexes associant chirurgie et thérapies systémiques améliorent le pronostic et la qualité de vie.
- Des traitements d’entretien à base de bevacizumab et d’inhibiteurs de PARP sont disponibles.
- Les guidelines ESMO/ESGO récemment publiées informent sur les recommandations thérapeutiques actuelles.
- D’autres indications pour les inhibiteurs de PARP sont attendues à l’avenir (1ère ligne, BRCA non muté).
- L’immunothérapie fait l’objet de nombreux essais de phase III dans le monde entier – elle n’est pas encore un standard dans le traitement du cancer de l’ovaire.
Littérature :
- ESMO-ESGO consensus conference recommendations on ovarian cancer : pathology and molecular biology, early and advanced stages, borderline tumours and recurrent disease N. Colombo, C. Sessa, et al. Annals of Oncology 30 : 672-705, 2019.
- THE-WORLD-OVARIAN-CANCER-COALITION-ATLAS-2018.pdf, sur www.worldovariancancercoalition.org
- Screening for Ovarian Cancer, US Preventive Services Task Force JAMA. 2018
- du Bois A, et al : Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer Cancer 2009.
- Harter P, et al : A Randomized Trial of Lymphadenectomy in Patients with Advanced Ovarian Neoplasms LION NEJM 380 ; 9 February 28, 2019.
- Vergote I, Tropé CG, Amant F, et al : Chimiothérapie néoadjuvante ou chirurgie primaire dans le cancer de l’ovaire de stade IIIC ou IV. N Engl J Med 2010.
- Kehoe S, Hook J, Nankivell M, et al. : Chimiothérapie primaire versus chirurgie primaire pour un cancer ovarien avancé nouvellement diagnostiqué (CHORUS) : un essai ouvert, randomisé, contrôlé, non-infériorité. Lancet 2015.
- Katsumata N, et al : Résultats à long terme du paclitaxel à dose fixe et du carboplatine contre le paclitaxel et le carboplatine conventionnels pour le traitement du cancer épithélial avancé de l’ovaire, du tube fallopien ou du cancer péritonéal primaire (JGOG 3016) : un essai randomisé, contrôlé et en ouvert. Lancet Oncol 2013.
- Burger RA, et al : Incorporation du bevacizumab dans le traitement primaire du cancer de l’ovaire. N Engl J Med 2011
- Perren TJ, et al : A phase 3 trial of bevacizumab in ovarian cancer. N Engl J Med 2011.
- Murai SY, Huang B, Das A, et al. : Trapping of PARP1 and PARP2 by clinical PARP inhibitors, Cancer Res. 2012.
- Moore K, et al : Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. NEJM Oct 2018.
- www.spezialitaetenliste.ch
- Du Bois A, et al : Étude randomisée contrôlée de phase III évaluant l’impact de la chirurgie cytoreductrice secondaire dans le cancer de l’ovaire récurrent : AGO DESKTOP III/ENGOT ov20. J Clin Oncol 2017 ; 35(15_Suppl) : 5501
- Pujade E, et al. : Bevacizumab combiné à la chimiothérapie pour le cancer de l’ovaire récurrent résistant au platine : l’essai AURELIA de phase III randomisé en ouvert, JCO May 2014
- Pignata S, et al. : Chimiothérapie plus ou moins bevacizumab pour les patients atteints d’un cancer de l’ovaire sensible au platine récidivant après un traitement de première ligne contenant du bevacizumab : l’essai randomisé de phase 3 MITO16B-MaNGO OV2B-ENGOT OV17. J Clin Oncol 2018;36(15_Suppl).
- Ledermann JA, et al : Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer : a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol 2014.
- Pujade-Lauraine E, et al. : Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21) : a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2017
- Mirza MR, et al : Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer. N Engl J Med 2016.
- Coleman RL, et al. : Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3) : a randomised, double-blind, placebo-controlled,phase 3 trial, Lancet 2017.
- Marth C, et al : Immunotherapy in ovarian cancer : fake news or the real deal ? Int J Gynecol Cancer 2019.
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(6) : 6-10