L’incidence annuelle du mélanome malin n’a cessé d’augmenter au cours des 40 dernières années. Alors que le pronostic est bon au stade précoce, il se détériore à mesure que la tumeur progresse. Le traitement adjuvant par checkpoint ou inhibiteur BRAF/MEK a profondément marqué la prise en charge des cas avancés et continue d’évoluer.
L’incidence annuelle du mélanome malin a augmenté régulièrement au cours des 40 dernières années et varie en Europe de 3-5/100 000 dans les pays méditerranéens à 12-35/100 000 dans les pays nordiques. Dans ce contexte, 80% des mélanomes malins sont diagnostiqués à un stade localisé. Pour les mélanomes à un stade précoce, la résection chirurgicale est le traitement standard et s’accompagne d’un bon pronostic à long terme. Le taux de survie globale (SG) à cinq ans est de 65 à 100 % pour les maladies de stade I-II et diminue chez les patients présentant des métastases locales (stade III) à 41-71% et chez les patients présentant des métastases à distance (stade IV) à 9-28% [1].
Classification du mélanome et altérations génétiques moléculaires
Depuis janvier 2018, la classification du mélanome est basée sur la 8e édition du manuel de stadification de l’AJCC (tableaux 1 et 2). L’épaisseur verticale de la tumeur selon Breslow est le facteur pronostique le plus important et est prise en compte pour déterminer le traitement ultérieur, y compris les distances de sécurité nécessaires et la nécessité d’une biopsie du ganglion lymphatique sentinelle. La présence d’une ulcération est un autre marqueur histopathologique pertinent, qui est associé à un pronostic moins bon et qui est enregistré au stade T de la classification TNM.
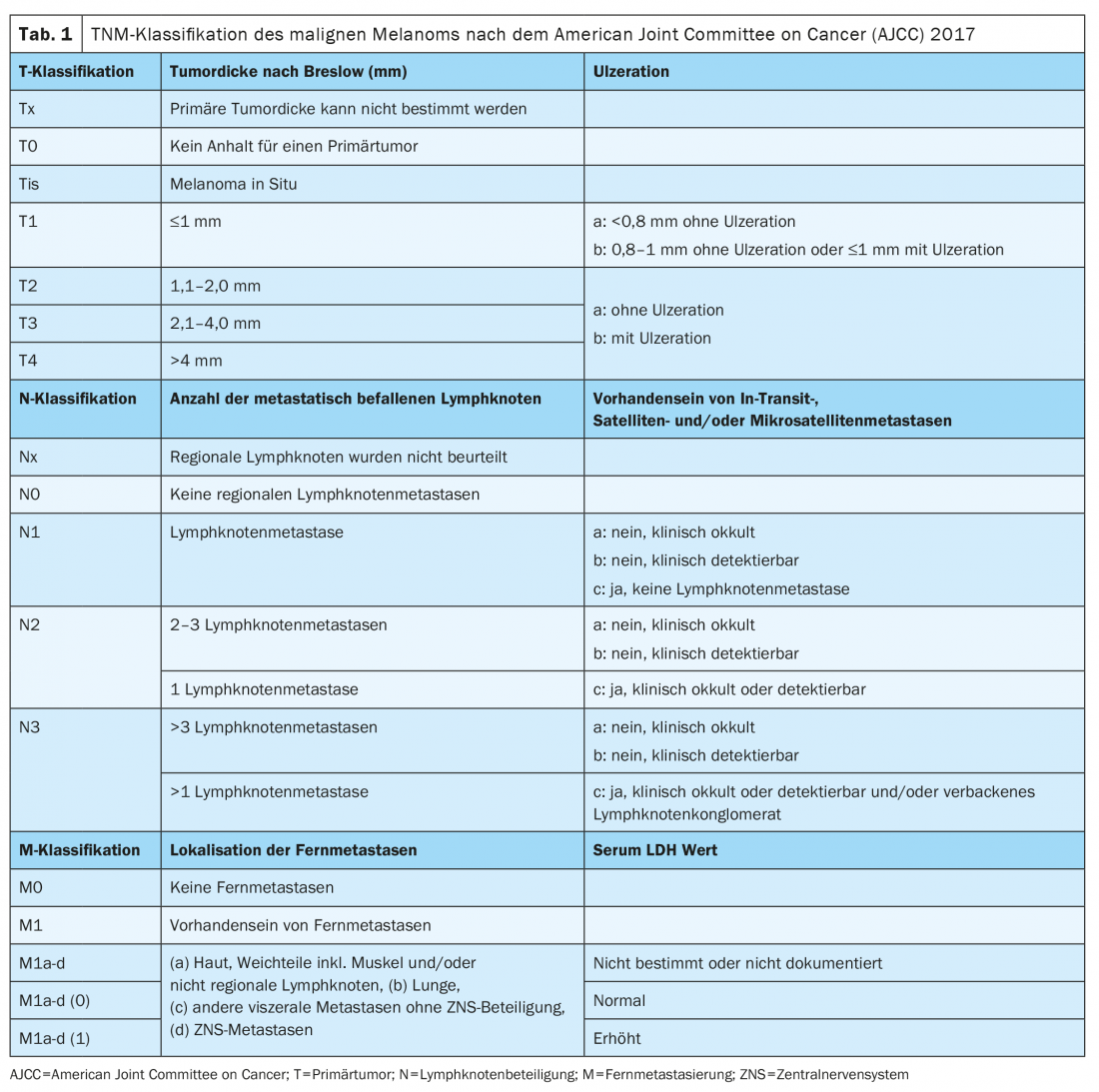
Un diagnostic de pathologie moléculaire par séquençage de nouvelle génération (NGS) pour déterminer le statut BRAF doit être réalisé en cas de mélanome localement avancé ou métastatique de stade III et IV. L’examen immunohistochimique permet uniquement de détecter une mutation V600E, alors que V600K et d’autres mutations atypiques ne peuvent pas être détectées. La Classification génomique des mélanomes cutanés prévoit une subdivision en quatre sous-types : Mélanomes avec mutation BRAF (50%) ; mutation N-Ras, K-Ras ou H-Ras (25%) ; mutation NF1 (15%) et mélanomes triples de type sauvage (10%) [2].
Malgré des progrès considérables dans la compréhension des bases génétiques du mélanome, l’utilisation des modifications génétiques à des fins diagnostiques, pronostiques ou thérapeutiques reste limitée. Le statut mutationnel de BRAFV600E/K est prédictif d’un traitement par des inhibiteurs de BRAF. Bien qu’il n’existe actuellement aucune thérapie ciblée établie pour les autres altérations génétiques, celles-ci fournissent des informations importantes pour les inclusions dans les études et les futures approches thérapeutiques potentielles.
Traitement chirurgical de la tumeur primaire et des ganglions lymphatiques régionaux
En cas de suspicion clinique de mélanome malin, une excision in toto doit être réalisée. Après confirmation histopathologique d’un mélanome malin, le traitement primaire consiste en une excision locale avec une marge de sécurité suffisante, en fonction de l’épaisseur de la tumeur selon la méthode de Breslow (0,5 cm pour les mélanomes in situ, 1 cm pour les mélanomes dont l’épaisseur de la tumeur est inférieure ou égale à 2 mm, 2 cm à partir d’une épaisseur de la tumeur de 2 mm). Une marge de sécurité suffisante est associée à une réduction du taux de récidive locale, sans pour autant améliorer la survie globale [3]. Pour les localisations au niveau du visage ou des organes génitaux, la marge de sécurité recommandée peut être adaptée si une morbidité importante doit être supposée malgré la chirurgie reconstructive. Il est important de souligner que les distances de sécurité ne doivent pas être réduites pour des raisons esthétiques.
Une biopsie du ganglion lymphatique sentinelle (SLNB) est recommandée dans les directives ESMO pour un stade pT1b (c’est-à-dire une épaisseur de tumeur selon Breslow de >0,8 mm ou <0,8 mm avec ulcération) selon la 8e édition de l’AJCC. L’étude prospective MSLT-I a validé la valeur pronostique et la contribution du ganglion lymphatique sentinelle (SLK) à la classification des stades, sans montrer d’avantage de survie pour cette procédure [4]. Jusqu’en 2017, la dissection complète du ganglion lymphatique en cas de ganglion sentinelle positif était considérée comme le traitement standard. L’étude allemande DeCOG-SLT et l’étude internationale MSLT-2 ont toutes deux comparé le suivi échographique régulier du territoire de drainage lymphatique à la dissection complète des ganglions lymphatiques (LND) en cas de SLK positif [5,6]. Dans les deux études, on a constaté une augmentation de la morbidité (lymphœdème), mais pas d’amélioration significative de la survie spécifique au mélanome. Depuis 2019, le LND n’est donc plus recommandé dans les lignes directrices de l’ESMO en cas de ganglion sentinelle positif [7]. Toutefois, le LND reste recommandé en cas d’atteinte macroscopique des ganglions lymphatiques. Il convient de noter que les deux études ont été menées avant l’introduction des thérapies systémiques adjuvantes, d’une part, et qu’une dissection des ganglions lymphatiques a été effectuée dans les populations étudiées pour les thérapies adjuvantes, d’autre part [8–10].
Traitement systémique adjuvant
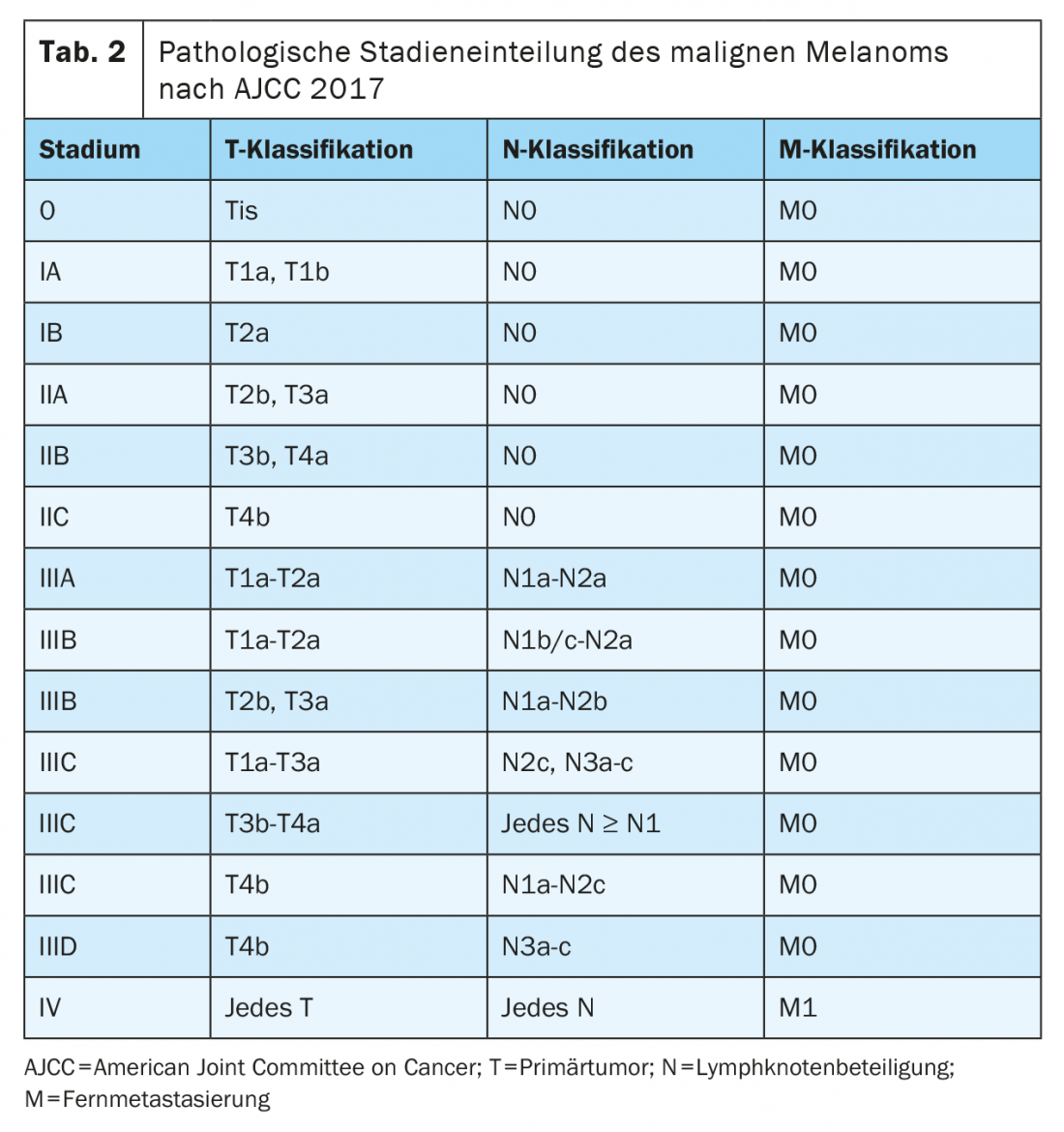
Après une résection complète avec une marge de sécurité suffisante et une absence de tumeur, les patients atteints d’un mélanome de stade IIB, IIC, III et IV présentent un risque important de récidive. A ces stades de la tumeur, un traitement systémique adjuvant doit être envisagé afin de réduire le risque de récidive locale et de métastases à distance et d’améliorer la survie globale. Les inhibiteurs de points de contrôle immunitaires et les thérapies ciblées sont actuellement autorisés aux États-Unis et en Europe pour le traitement adjuvant des mélanomes de stades III et IV entièrement réséqués et réduisent le risque de récidive d’environ 50%. Les indications et les autorisations varient en fonction des critères d’inclusion dans les études. Il convient de noter que la classification en stades de ces populations d’étude est basée sur la 7e édition 2009 de l’AJCC.
Thérapie ciblée adjuvante avec des inhibiteurs de BRAF et de MEK
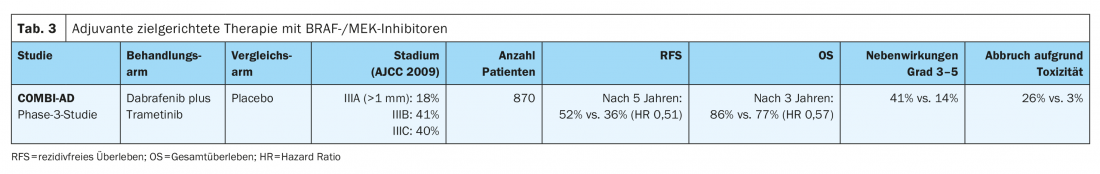
Dans l’étude de phase III COMBI-AD (tableau 3) , des patients atteints de mélanomes entièrement réséqués avec une mutation BRAFV600E/K aux stades IIIA (métastase SLK >1 mm), IIIB et IIIC ont été traités pendant 12 mois par une thérapie ciblée per os comprenant les inhibiteurs de BRAF et de MEK dabrafenib et trametinib ou un placebo. Avec un suivi moyen de cinq ans, ce traitement adjuvant a montré une amélioration significative de la survie sans récidive (RFS) (hazard ratio HR 0,51) et de la survie sans métastase (HR 0,55) par rapport au placebo. L’association a également amélioré la survie globale (OS) à trois ans (HR 0,57). Le bénéfice a été documenté dans tous les sous-groupes [8,11]. Par la suite, la thérapie ciblée comprenant le dabrafenib et le trametinib a reçu en août 2018 une autorisation de mise sur le marché (AMM) à l’échelle de l’UE pour le traitement adjuvant du mélanome malin métastatique lymphogénique avec mutation BRAFV600E/K. Cette autorisation a été délivrée par l’Agence européenne des médicaments (EMA).
L’étude BRIM8 a comparé une monothérapie adjuvante par le vémurafénib, un inhibiteur de BRAF, à un placebo dans les mélanomes réséqués de stade IIC-III. Le critère d’évaluation primaire d’une prolongation de la survie sans maladie n’a pas été atteint dans l’étude, de sorte qu’une monothérapie par un inhibiteur de BRAF dans le cadre d’un traitement adjuvant ne constitue pas une option thérapeutique.
Immunothérapie adjuvante
Dans l’étude CheckMate-238 (tableau 4) le traitement adjuvant par voie intraveineuse avec l’anticorps monoclonal anti-PD-1 nivolumab (3 mg/kg) a montré une amélioration significative de la survie sans récidive (HR 0,71) et de la survie sans métastase (HR 0,79) à quatre ans pour les mélanomes de stades IIIB/C et IV complètement réséqués, par rapport à l’anticorps anti-CTLA4 à haute dose ipilimumab (10 mg/kg). La survie globale à quatre ans était comparable dans les deux bras de traitement (HR 0,87). En outre, le nivolumab a entraîné nettement moins d’effets secondaires graves (grade 3-5) avec arrêt consécutif du traitement (9,7% contre 42,6%) que l’ipilimumab à haute dose. Les résultats en termes de toxicité tardive ont été similaires dans les deux bras de traitement (1% vs 2%) [10,12]. Le nivolumab a été approuvé dans toute l’UE en 2018 pour le traitement adjuvant du mélanome malin de stades III et IV après métastasectomie complète.
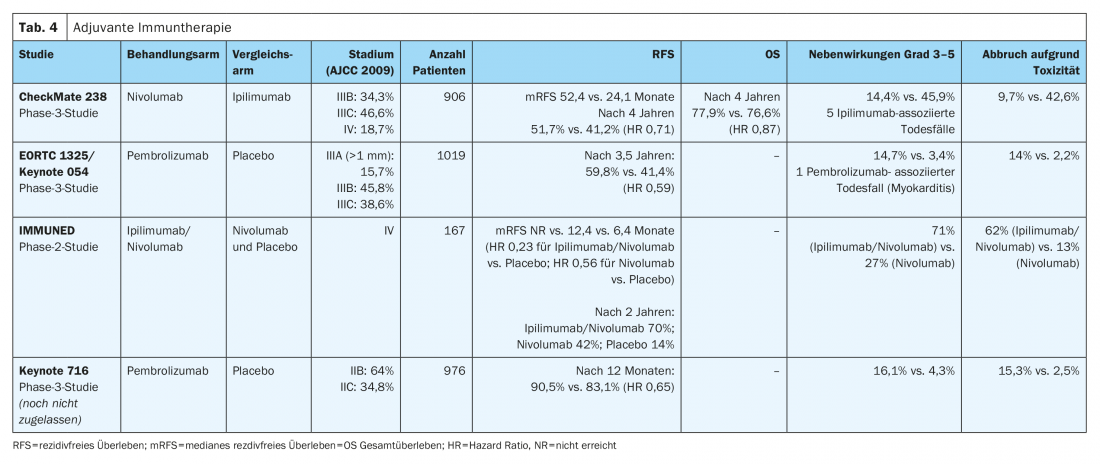
L’efficacité de l’anticorps anti-PD-1 pembrolizumab a été évaluée dans l’étude de phase III EORTC1325/Keynote-54 chez des patients atteints d’un mélanome de stade IIIA complètement réséqué (métastase du ganglion lymphatique sentinelle >1 mm), IIIB ou IIIC (sans métastases en transit) (tableau 4). Avec un suivi médian de trois ans, le pembrolizumab a été associé à une survie sans récidive significativement plus longue par rapport au placebo dans l’ensemble de la population (HR 0,56). Des effets indésirables graves (grade 3-5) ont été observés plus fréquemment sous pembrolizumab que sous placebo (14% vs 3%) [9]. Le pembrolizumab a reçu une autorisation de mise sur le marché dans toute l’UE pour cette indication en janvier 2019.
L’effet positif en termes d’amélioration de la survie sans récidive a été observé dans tous les sous-groupes prédéfinis, tant dans l’étude EORTC1325/Keynote-054 que dans l’étude CheckMate-238. Dans chacune des deux études, l’inhibiteur de point de contrôle immunitaire a été administré sur une durée totale de traitement d’un an.
Les résultats préliminaires de l’étude randomisée de phase III CheckMate-915 (tableau 4) ne montrent pas d’amélioration de la survie sans récidive des patients atteints de mélanome avancé réséqué de stade IIIB-D ou IV sous traitement adjuvant par nivolumab (240 mg toutes les 2 semaines) associé à l’ipilimumab (1 mg/kg toutes les 6 semaines) pour une durée totale de traitement de 12 mois par rapport au nivolumab en monothérapie (480 mg toutes les 4 semaines). Ces résultats sont très différents de ceux de l’étude adjuvante de phase II IMMUNED (tableau 4). Cette étude a montré une nette supériorité du traitement adjuvant combiné par nivolumab (1 mg/kg) et ipilumumab (3 mg/kg) pendant 4 cycles toutes les 3 semaines par rapport à une monothérapie par nivolumab (3 mg/kg) toutes les 2 semaines ou un placebo chez des patients atteints d’un mélanome malin de stade IV sans preuve de maladie après une opération réussie. Le ratio de risque de récidive était de 0,23 dans le groupe nivolumab/ipilimumab par rapport au groupe placebo et de 0,56 dans le groupe nivolumab par rapport au groupe placebo. Les effets secondaires associés au traitement, quel que soit leur degré, ont entraîné l’arrêt du traitement chez 62% des patients du groupe nivolumab/ipilimumab et chez 13% des participants à l’étude traités par nivolumab [13].
Sur la base de ces résultats, les patients atteints d’un mélanome malin de stade IV sans preuve de maladie devraient recevoir une immunothérapie combinée adjuvante après une chirurgie ou une radiothérapie, quel que soit leur statut mutationnel BRAFV600. Dans cette situation, les patients présentant des contre-indications à une immunothérapie combinée par nivolumab et ipilumumab devraient recevoir un traitement adjuvant d’un an par nivolumab en monothérapie, comme dans l’étude CheckMate 238. Ce traitement présente un profil de toxicité plus facile à contrôler et est approuvé pour le traitement des patients dont la maladie a été entièrement réséquée au stade IV [10].
Immunothérapie adjuvante dans les stades IIB et IIC
Les patients ayant un mélanome réséqué et une épaisseur de la tumeur selon Breslow de >4 mm ou >2 mm en présence d’une ulcération sans atteinte des ganglions lymphatiques (stade IIB ou IIC selon la 8e édition de l’AJCC) présentent un risque accru de récidive. Le risque de récidive et de mortalité est comparable à celui des patients atteints d’un mélanome de stade IIIA ou IIIB. Les données de l’étude randomisée de phase III Keynote-716 ont été présentées lors du congrès ESMO 2021. Celles-ci montrent, chez les patients atteints d’un mélanome de stade IIB ou IIC ayant subi une résection complète, une amélioration significative de la survie sans récidive grâce à un traitement adjuvant de 12 mois par l’anticorps anti-PD1 pembrolizumab par rapport au placebo (HR 0,65). Le pembrolizumab n’a pas encore été approuvé pour cette indication.
Place de la thérapie systémique adjuvante au stade IIIA
Le pronostic au stade tumoral IIIA (selon l’AJCC 8e édition) est très bon, avec un taux de survie de 88% à 10 ans. Ce fait a suscité un débat sur la question de savoir si un traitement systémique adjuvant constituait un surtraitement pour ce groupe de patients. L’équilibre entre le risque de toxicité grave et éventuellement irréversible et le bénéfice potentiel est particulièrement important chez les patients atteints de mélanome de stade IIIA.
Dans l’étude CheckMate-238, les patients atteints d’un mélanome de stade IIIA de l’AJCC (7e édition) n’ont pas été inclus [12]. En revanche, l’étude EORTC1325/Keynote-54 a inclus des patients atteints d’un mélanome de stade IIIA de l’AJCC (7e édition) avec une métastase ganglionnaire de plus de 1 mm. Dans le sous-groupe de patients présentant une maladie de stade IIIA de l’AJCC (7e édition), la survie sans récidive à un an était de 89,8% sous traitement par pembrolizumab, contre 76,8% sous placebo (HR 0,32, intervalle de confiance à 99% 0,09 -1,23 ; p=0,0217). Après reclassification des patients sur la base de la 8e édition de l’AJCC sur le mélanome, 8% des patients présentaient un mélanome de stade tumoral IIIA. Un effet positif comparable sur la survie sans récidive a été observé dans tous les sous-groupes. Il convient de noter que la période de suivi était très limitée et que l’intervalle de confiance pour les patients au stade IIIA de la tumeur selon la 8e édition de l’AJCC était très large [14]. L’étude COMBI-AD a également inclus des patients au stade tumoral IIIA (AJCC 8e édition) avec des métastases du ganglion lymphatique sentinelle >1 mm. Cette étude a également documenté un effet positif en termes de survie sans récidive dans tous les sous-groupes, mais également avec un résultat moins clair pour ce stade [8].
Profil d’effets secondaires
Pour le traitement adjuvant du mélanome de stade III muté par BRAFV600, il existe aussi bien les inhibiteurs de points de contrôle immunitaires nivolumab et pembrolizumab que le traitement ciblé par les inhibiteurs BRAF/MEK dabrafenib et trametinib. Les profils d’effets secondaires des thérapies ciblées et des inhibiteurs de points de contrôle immunitaire sont très différents. Alors que les effets secondaires réversibles sont plus fréquents avec les thérapies ciblées, de rares effets secondaires à médiation immunitaire peuvent être durables et irréversibles avec les inhibiteurs de points de contrôle immunitaires [15]. Ces effets secondaires à médiation immunitaire peuvent affecter n’importe quel organe. Les endocrinopathies font ainsi partie des effets secondaires à médiation immunitaire les plus fréquents et sont généralement irréversibles, contrairement aux autres toxicités. Ils nécessitent par conséquent un traitement de substitution à vie. Les complications endocriniennes les plus fréquentes sont les dysthyroïdies (30%), les hypophysites (5,6-11%), le diabète sucré de type 1 (0,2-2%) et les insuffisances surrénales (0,7%), de rares cas d’hypoparathyroïdie ayant été décrits. En outre, les quelques données disponibles indiquent qu’un hypogonadisme primaire à médiation immunitaire dû à une orchite, ou un hypogonadisme secondaire dans le cadre d’une hypophysite, constituent des risques potentiels d’infertilité ultérieure [16]. La moitié des patients atteints de mélanome issus d’une cohorte nationale danoise et soumis à un traitement adjuvant par nivolumab ont interrompu prématurément le traitement prévu d’un an en raison de la toxicité ou d’une rechute. En outre, une détérioration temporaire de la qualité de vie a été documentée [17].
Des toxicités de grade 3-4 associées au traitement sont survenues chez 41% des patients du bras traité (dabrafenib en association avec le trametinib) dans l’étude COMBI-AD, contre 14% des patients du groupe placebo. Les pyrexies constituent la raison la plus fréquente de modification de la dose et d’interruption du traitement ciblé.
En outre, les patients présentent souvent des symptômes généraux non spécifiques tels que la fatigue ou des effets secondaires gastro-intestinaux de type nausées. Les effets secondaires cardiaques (dysfonctionnement ventriculaire gauche, allongement de l’intervalle QT) sont rares, mais un suivi cardiologique régulier est indiqué. De manière générale, lorsque des effets indésirables médicamenteux apparaissent, il suffit souvent de réduire la dose d’un ou des deux médicaments. Les effets secondaires sont généralement complètement réversibles après l’arrêt du traitement combiné.
Choix du traitement systémique adjuvant au quotidien
Il existe très peu de données issues de la pratique quotidienne sur la toxicité et les taux d’interruption du traitement. Une étude néerlandaise a montré qu’au total, 93% des patients qui se qualifiaient pour un traitement adjuvant recevaient un traitement adjuvant anti-PD-1. Ces données ont montré un taux de toxicité plus élevé sous traitement avec, par conséquent, des arrêts de traitement prématurés plus fréquents. La survie sans récidive a été comparable à celle observée dans les études pivots [18].
Pour les patients atteints de mélanome BRAF de type sauvage, le blocage du PD-1 est le traitement adjuvant de choix. Pour les patients atteints de mélanome muté BRAFV600E/K, le risque d’effets secondaires persistants à médiation immunitaire sous immunothérapie doit être pris en compte dans le choix du traitement adjuvant, car le rapport de risque de survie sans récidive est comparable dans les trois études sur le traitement adjuvant. Le choix du traitement doit donc être discuté avec les patients et fait en commun.
Messages Take-Home
- L’épaisseur verticale de la tumeur selon la méthode de Breslow ainsi que la présence d’une ulcération sont les principaux facteurs pronostiques.
- Un diagnostic de pathologie moléculaire par séquençage de nouvelle génération (NGS) pour déterminer le statut BRAF doit être effectué à partir du stade III.
- Une biopsie du ganglion lymphatique sentinelle (SLNB) est recommandée pour un stade pT1b (c’est-à-dire une épaisseur de tumeur selon Breslow de >0,8 mm ou <0,8 mm avec ulcération) selon la 8e édition de l’AJCC. La dissection du ganglion lymphatique est indiquée en cas d’atteinte macroscopique du ganglion lymphatique, mais n’est pas recommandée en cas de ganglion sentinelle positif.
- Un traitement systémique adjuvant avec un anticorps monoclonal anti-PD-1 ou des inhibiteurs de BRAF/MEK est recommandé à partir du stade IIIA avec une métastase du ganglion lymphatique sentinelle >1 mm.
- Le choix du traitement systémique adjuvant dépend de l’indication ainsi que de l’autorisation de mise sur le marché, en tenant compte du statut mutationnel de BRAF et du profil d’effets secondaires.
Littérature :
- Siegel RL, Miller KD, Jemal A : Cancer statistics, 2018. A Cancer Journal for Clinicians 2018 ; 68(1) : 7-30.
- Akbani R, et al : Classification génomique du mélanome cutané. Cell 2015 ; 161(7) : 1681-1696.
- Hayes AJ, et al : Marges d’excision larges ou étroites pour les mélanomes cutanés primaires à haut risque : suivi à long terme de la survie dans un essai randomisé. The Lancet Oncology 2016 ; 17(2) : 184-192.
- Morton DL, et al : Rapport d’essai final de la biopsie du ganglion sentinelle versus l’observation du ganglion dans le mélanome. New England Journal of Medicine 2014 ; 370(7) : 599-609.
- Leiter U, et al : Analyse finale de l’essai DeCOG-SLT : Aucun bénéfice en termes de survie pour la dissection complète des ganglions lymphatiques chez les patients atteints de mélanome avec un ganglion sentinelle positif. J Clin Oncol 2019 ; 37(32) : 3000-3008.
- Faries MB, et al : Dissection complète ou observation pour les métastases du ganglion sentinelle dans le mélanome. N Engl J Med 2017 ; 376(23) : 2211-2222.
- Michielin O, et al : Cutaneous melanoma : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-updagger. Ann Oncol 2019 ; 30(12) : 1884-1901.
- Dummer R, et al : Analyse à cinq ans de l’adjuvant dabrafenib plus trametinib dans le mélanome de stade III. N Engl J Med 2020 ; 383(12) : 1139-1148.
- Eggermont AMM, et al : Adjuvant pembrolizumab versus placebo dans le mélanome de stade III réséqué (EORTC 1325-MG/KEYNOTE-054) : résultats de survie sans métastases à distance issus d’une étude en double aveugle, randomisée, contrôlée, phase 3. The Lancet Oncology 2021 ; 22(5) : 643-654.
- Ascierto PA, et al. : Adjuvant nivolumab versus ipilimumab dans le mélanome de stade IIIB-C et de stade IV réséqué (CheckMate 238) : 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. The Lancet Oncology. 2020. 21(11) : 1465-1477.
- Long GV, et al : Adjuvant dabrafenib plus trametinib dans le mélanome de stade IIIBRAF-muté. New England Journal of Medicine 2017 ; 377(19) : 1813-1823.
- Weber J, et al : Adjuvant nivolumab versus ipilimumab dans le mélanome de stade III ou IV réséqué. New England Journal of Medicine 2017 ; 377(19) : 1824-1835.
- Zimmer L, et al. : Adjuvant nivolumab plus ipilimumab ou nivolumab en monothérapie versus placebo chez les patients atteints de mélanome de stade IV réséqué sans preuve de maladie (IMMUNED) : un essai randomisé, en double aveugle, contrôlé par placebo, de phase 2. The Lancet 2020 ; 395(10236) : 1558-1568.
- Eggermont AMM, et al : Valeur pronostique et prédictive du staging AJCC-8 dans l’essai de phase III EORTC1325/KEYNOTE-054 de pembrolizumab vs placebo dans le mélanome de stade III à haut risque réséqué. European Journal of Cancer 2019 ; 116 : 148-157.
- Ghisoni E, et al. : Événements indésirables immunologiques tardifs et à long terme dus aux inhibiteurs de points de contrôle immunitaires : un aspect négligé de l’immunothérapie. Eur J Cancer. 2021. 149 : 153-164.
- Ozdemir BC : Hypogonadisme lié aux inhibiteurs de points de contrôle immunitaires et infertilité : une question négligée en immuno-oncologie. J Immunother Cancer 2021 ; 9(2).
- Ellebaek EEA : A nationwide, real-life study of outcome and quality of life after the introduction of adjuvant immunotherapy for Danish melanoma patients. ESMO Abstract 1071P, 2021.
- De Meza MEA : Adjuvant treatment for melanoma in clinical practice : Trial versus reality. ESMO Abstract 1070P, 2021.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(6) : 10-15