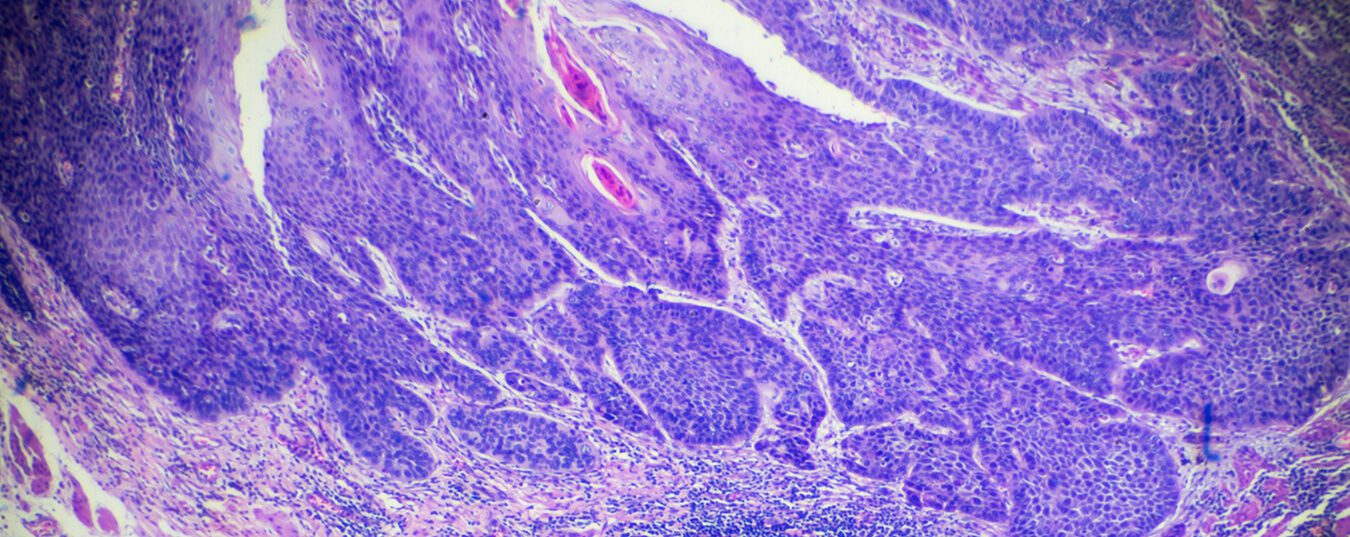
Les cancers de l’œsophage sont des tumeurs relativement rares et représentent environ 1% de toutes les tumeurs malignes dans le monde. En fonction de leur localisation, on distingue les tumeurs cervicales et intrathoraciques. Histologiquement, ils se manifestent sous forme de carcinomes épidermoïdes et d’adénocarcinomes. Les normes de traitement varient en fonction de la tumeur.
Les cancers de l’œsophage sont des tumeurs relativement rares et représentent environ 1% de toutes les tumeurs malignes dans le monde. En fonction de leur localisation, on distingue les tumeurs cervicales et intrathoraciques. Histologiquement, ils se manifestent sous forme de carcinomes épidermoïdes et d’adénocarcinomes [1]. Les carcinomes épidermoïdes de l’œsophage sont les carcinomes les plus fréquents de l’œsophage dans le monde et sont plus fréquents dans la “ceinture cancéreuse de l’œsophage asiatique” [2]. Dans les pays occidentaux industrialisés, l’incidence des adénocarcinomes est en constante augmentation depuis quelques décennies. Les adénocarcinomes représentent aujourd’hui 40 à 50% des tumeurs de l’œsophage. Le risque de développer un cancer de l’œsophage est trois à quatre fois plus élevé chez les hommes. En Allemagne, on dénombre environ 5500 nouveaux cas par an chez les hommes et 1500 chez les femmes. L’âge moyen des personnes atteintes est de 67 ans pour les hommes et de 72 ans pour les femmes [3].
Facteurs de risque et symptômes
Les adénocarcinomes se développent généralement sur la base d’un reflux chronique et de la transformation de la muqueuse en œsophage de Barrett qui en résulte [4]. En outre, la consommation chronique de tabac, l’obésité et l’achalasie ont été identifiées comme facteurs de risque [5]. Pour les carcinomes épidermoïdes, ce sont surtout la consommation chronique de nicotine et la consommation excessive d’alcool qui ont été identifiées. Mais des lésions mécaniques dues à l’achalasie, à des blessures causées par des acides ou des bases, ainsi qu’une radiothérapie antérieure peuvent également prédisposer au développement d’un carcinome épidermoïde [6].
Les cancers précoces sont généralement asymptomatiques. La dysphagie ou l’odynophagie, les vomissements récurrents, les nausées, la sensation de satiété précoce, la perte de poids, les douleurs thoraciques et les saignements gastro-intestinaux ou l’anémie n’apparaissent généralement qu’en cas de carcinome localement avancé [4].

Staging
La mesure la plus importante pour établir le diagnostic primaire d’un cancer de l’œsophage est la vidéo-endoscopie haute résolution [4]. Outre la détermination de la localisation et de l’extension de la tumeur et la détection des modifications métaplasiques dans le bas œsophage, une biopsie peut être réalisée simultanément pour confirmer le diagnostic. Une échographie endoscopique doit être ajoutée afin de mieux appréhender la propagation locale (tableaux 1-3) [7]. En cas de cancer de l’œsophage nouvellement diagnostiqué, la norme est de réaliser une tomodensitométrie multidétecteur avec contraste du thorax cervical et de l’abdomen [8]. Le PET-CT peut être réalisé en particulier pour les tumeurs localement avancées (cT2-4 cN+) afin d’exclure les métastases à distance lorsqu’il existe une intention de traitement potentiellement curatif ou lorsque le résultat aurait des conséquences cliniques [9,10]. Si une tumeur localement avancée est en contact avec le système trachéobronchique, le staging doit être complété par une bronchoscopie flexible [11]. La réalisation d’une laparoscopie diagnostique doit être effectuée pour les tumeurs localement avancées (cT3, cT4) du bas œsophage afin d’exclure la présence de métastases péritonéales [12].

Thérapie
En cas de carcinome de l’œsophage, la décision thérapeutique doit toujours être discutée et prise de manière interdisciplinaire, de préférence dans le cadre d’une conférence tumorale interdisciplinaire. Dans le cadre de la prise de décision, les facteurs spécifiques à la tumeur et au patient jouent un rôle décisif. Il existe souvent des comorbidités spécifiques à l’entité (cardiovasculaires, pulmonaires, hépatiques) qui peuvent compliquer le traitement de manière décisive. Même des tumeurs potentiellement résécables peuvent ainsi être fonctionnellement inopérables [13]. Outre un état général réduit, les patients* présentent souvent un état nutritionnel réduit [14]. La prise en charge nutritionnelle des patients* devrait faire partie intégrante des soins interdisciplinaires (fig. 1, 2).

T1a N0 M0 (carcinome précoce)
La mucosectomie par résection endoscopique est considérée comme le traitement standard de l’adénocarcinome pT1 m1-m3 et du carcinome épidermoïde pT1 m1-m2. Pour une évaluation précise et complète des marges latérales et basales lors de l’examen histologique, il convient de procéder à une résection en bloc et de viser une résection R0 [15]. En cas de facteurs de risque tels qu’une résection R1 ou une lésion de Barrett multifocale ou non ablable, il convient de procéder à une résection chirurgicale. Si un carcinome épidermoïde T1m3 ou une tumeur T1b confirmée par l’histologie est confirmée après l’intervention, une résection chirurgicale avec lymphadénectomie est recommandée. En cas de cancer G3 confirmé ou en présence d’une invasion de vaisseaux lymphatiques ou de veines ou d’une infiltration sous-muqueuse profonde (>500 µm) après résection endoscopique, une résection chirurgicale doit être discutée [4].

T1b-T2 N0 M0
Le traitement de choix à ce stade pour les carcinomes thoraciques est la résection chirurgicale avec lymphadénectomie. Si une résection chirurgicale est refusée après l’ablation endoscopique d’un carcinome épidermoïde T1b sm1-2, une radiochimiothérapie adjuvante peut être réalisée en alternative [16]. Si les patients ne sont pas éligibles pour une résection chirurgicale, une radiochimiothérapie à visée curative (RCT) peut être réalisée. Pour les cancers T2 N0, une RCT néoadjuvante peut être effectuée avant la chirurgie [17].
T3-4 N0/N+ M0
Les cancers de l’œsophage (épidermoïdes et adénocarcinomes) doivent être traités dans le cadre d’approches multimodales à partir d’un stade cT3 et/ou N+. En plus de la chirurgie à visée curative, une RCT néoadjuvante est ici disponible en complément [4]. L’étude randomisée CROSS (n=368 patients*) a montré un avantage de survie globale pour la RCT préopératoire, tant pour les carcinomes épidermoïdes que pour les adénocarcinomes. La médiane de survie globale était de 49,4 mois dans le groupe de patients* traités en préopératoire contre 24,0 mois dans le groupe de patients* réséqués uniquement (HR 0,66, IC 95% (0,49-0,87), p=0,003) [18]. Les patients* ont reçu une radiochimiothérapie préopératoire jusqu’à 41,4 Gy avec une chimiothérapie hebdomadaire concomitante composée de carboplatine (AUC 2) et de paclitaxel (50 mg/m² KOF) suivie d’une chirurgie ou d’une chirurgie seule. L’avantage de survie globale était plus net dans le groupe des carcinomes épidermoïdes que dans le groupe des adénocarcinomes (PECA : 82 vs. 21 mois, HR 0,48, p=0,007 ; adéno : 43 vs. 27 mois, HR 0,73, p=0,061). Aucune différence n’a été observée dans le nombre de complications postopératoires. Des méta-analyses ont confirmé l’avantage d’une radiochimiothérapie néoadjuvante pour les carcinomes épidermoïdes et les adénocarcinomes, à partir d’un stade ≥cT3, de sorte que la RCT préopératoire combinée suivie d’une chirurgie est le traitement de premier choix pour ces tumeurs [19,20].
Jusqu’à présent, il n’y avait pas d’indication de traitement adjuvant après une RCT néoadjuvante et une opération. Après la publication de l’étude multicentrique randomisée de phase III CheckMate 577, cette situation a changé [21]. L’étude a examiné si l’ajout d’un traitement adjuvant par nivolumab après une résection R0 réussie en l’absence de rémission complète pathologique après une RCT préopératoire pouvait améliorer la survie. Au total, 794 patients* ont été inclus et randomisés pour recevoir le nivolumab ou un placebo pendant un an après la chirurgie. Le critère d’évaluation principal était la survie sans maladie. En médiane, le nivolumab a prolongé cette période de 11 à 22,4 mois (HR 0,69 ; IC à 95% 0,56-0,86, p=0,0003). Les deux sous-types histologiques ont bénéficié de manière égale, l’effet étant plus prononcé pour les carcinomes épidermoïdes que pour les adénocarcinomes (HR 0,61 vs HR 0,75). Les résultats n’étaient pas différents entre les tumeurs PD-L1 positives et les tumeurs PD-L1 négatives. L’étude a également pu montrer que l’immunothérapie est bien réalisable et que la qualité de vie des patients* ne s’est pas détériorée par rapport au placebo. Toutefois, à l’heure actuelle, les données relatives à la survie globale font encore défaut. Une autorisation de mise sur le marché pour le nivolumab en traitement adjuvant a été accordée par la Commission européenne des médicaments en septembre 2021. Une recommandation thérapeutique forte a également été émise par l’ASCO pour un traitement adjuvant par nivolumab après un cancer de l’œsophage traité par radiochimiothérapie néoadjuvante et complètement réséqué sans rémission pathologique complète [22].
Après une résection R1 et en l’absence de radiochimiothérapie néoadjuvante, une radiochimiothérapie postopératoire peut être effectuée pour améliorer le contrôle local [23].
Les patients* qui ne sont pas opérables sur le plan fonctionnel ou dont les tumeurs ne sont pas opérables sur le plan technique ou en cas de refus de la chirurgie doivent être traités par une radiochimiothérapie définitive, qu’il s’agisse d’un adénocarcinome ou d’un carcinome épidermoïde. En ce qui concerne la chimiothérapie concomitante à la radiothérapie, la littérature montre de bonnes données pour l’association de carboplatine et de paclitaxel, mais une combinaison de platine et de fluoropyrimidine peut également être utilisée comme alternative [18,24]. Un travail français a récemment montré une efficacité comparable du schéma FOLFOX (oxaliplatine + 5-FU) en concomitance avec une radiothérapie définitive par rapport à une chimiothérapie concomitante par 5-FU et cisplatine [25]. La radiothérapie utilisée de manière standard en situation préopératoire, accompagnée d’une chimiothérapie à base de carboplatine/paclitaxel, semble également bien réalisable en situation définitive [26].
Dans le cadre d’une RCT définitive, il convient de viser une dose d’irradiation de 50,4 Gy. Selon les données actuelles de l’étude néerlandaise ARTDECO, une dose plus élevée n’améliore ni le contrôle local de la tumeur ni la survie globale, indépendamment du sous-type histologique (épidermoïde ou adénocarcinome) [27].
Pour une couverture plus conforme du volume cible et une meilleure protection des organes à risque (cœur, poumons), la radiothérapie doit être modulée en intensité (IMRT) [28].
Tumeurs de l’œsophage cervical
Le traitement standard du cancer de l’œsophage cervical est la radiochimiothérapie définitive avec les doses spécifiques et les agents thérapeutiques systémiques mentionnés ci-dessus. En raison de l’augmentation des taux de complications et des troubles postopératoires, aucune opération ne devrait avoir lieu [29,30].
Chaque T, chaque N, M1
Le premier choix en situation métastatique est le traitement systémique, qui peut prolonger la survie des patients. Toutefois, aucune étude de phase III n’a été menée sur le carcinome épidermoïde. Néanmoins, la thérapie systémique est recommandée dans les lignes directrices internationales [31]. Le traitement systémique doit être planifié en tenant compte de l’état général, des comorbidités, des préférences du patient et de la toxicité du traitement. Le pronostic n’a pas été amélioré par la résection de la tumeur primaire. Avant d’initier un traitement palliatif systémique, le CPS PD-L1 doit être évalué comme facteur prédictif d’un traitement par un inhibiteur de point de contrôle immunitaire [4]. En première ligne de traitement, la chimiothérapie doit être associée à l’immunothérapie [32–34]. Pour les carcinomes épidermoïdes, une chimiothérapie à base de platine/fluoropyrimidine est associée au pembrolizumab en cas de CPS ≥10 [4]. Si le CPS est <10, une chimiothérapie systémique palliative doit être administrée avec un dérivé du platine en combinaison avec du 5-FU ou du taxane [4]. Pour les adénocarcinomes, le statut HER2 doit être déterminé en plus du PD-L1 CPS [4]. En cas de CPS <5 et de statut HER2 négatif, le traitement systémique comprend une thérapie contenant du platine/fluoropyrimidine en double/triple combinaison. Si le CPS PD-L1 est ≥5 pour le nivolumab ou ≥10 pour le pembrolizumab, l’association se fait avec un dérivé du platine et de la fluoropyrimidine [4]. En cas de surexpression de Her2 (IHC3+, IHC2+, FISH+), le trastuzumab est ajouté au traitement de première ligne [35]. Une radiothérapie percutanée ou une curiethérapie pour un traitement systémique peuvent être envisagées en cas de symptômes locaux (saignement, sténose, compression) [36]. Pour soulager rapidement une dysphagie, il est possible d’implanter un stent métallique endoscopique, mais il faut éviter une radiothérapie percutanée simultanée après l’implantation d’un stent métallique, car elle est associée à un taux de complications plus élevé [31,37].
Messages Take-Home
- Standard thérapeutique pour l’adénocarcinome T1 m1-m3 et le carcinome épidermoïde T1 m1-m2 : mucosectomie par résection endoscopique. En cas de facteurs de risque (notamment R1, lésions de Barrett non éliminables) ◊ résection chirurgicale.
- Amélioration du pronostic par le traitement des cancers de l’œsophage localement avancés dans le cadre d’approches thérapeutiques multimodales (RCTx néoadjuvante + chirurgie).
- Pour les carcinomes épidermoïdes et adénocarcinomes de l’œsophage après radiochimiothérapie néoadjuvante et résection complète (R0) sans rémission complète pathologique → immunothérapie de consolidation indépendamment du statut PD-L1.
- Pour les carcinomes épidermoïdes métastasés à distance : chimiothérapie à base de platine, en première ligne également en combinaison avec des inhibiteurs de points de contrôle (PD-L1 CPS ≥10).
- Pour les adénocarcinomes métastasés à distance : combinaison de chimiothérapie et d’immunothérapie (PD-L1 CPS ≥5) ou en cas de positivité HER-2 [Trastuzumab]
- En cas de radiothérapie en intention néoadjuvante, définitive ou palliative : renoncer à l’implantation de stents métalliques.
Littérature :
- Société allemande d’hématologie et d’oncologie médicale e.V. Onkopedia. Cancer de l’œsophage. Situation en 2022. www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@@guideline/html/index.html ; consulté le 23.11.2022.
- Pakzad R, Mohammadian-Hafshejani A, Khosravi B, et al : The incidence and mortality of esophageal cancer and their relationship to development in Asia. Ann Transl Med 2016 Jan;4(2):29. doi : 10.3978/j.issn.2305-5839.2016.01.11
- Robert-Koch-Institut et la Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. Le cancer en Allemagne pour 2017/2018. Berlin, 2021
- Programme de lignes directrices en oncologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF) : Diagnostic et traitement des carcinomes épidermoïdes et des adénocarcinomes de l’œsophage ; version longue 3.1, 2022, numéro de registre AWMF : 021/023OL, www.leitlinienprogramm-onkologie.de/leitlinien/oesophaguskarzinom/ Accès le [23 .11.2022].
- Domper Arnal MJ, Ferrández Arenas Á, Lanas Arbeloa Á : Esophageal cancer : Risk factors, screening and endoscopic treatment in Western and Eastern countries. World J Gastroenterol. 2015 Jul 14;21(26) : 7933-7943.
- Wheeler JB, Reed CE : Épidémiologie du cancer de l’œsophage. Surg Clin North Am. 2012 Oct;92(5) : 1077-1087. doi : 10.1016/j.suc.2012.07.008.
- Russell IT, Edwards RT, Gliddon AE, et al : Cancer de l’œsophage ou du tractus gastrique – Nouvelle évaluation de la technologie de l’endosonographie (COGNATE) : rapport de l’essai randomisé pragmatique. Health Technol Assess 2013 Sep ; 17(39) : 1-170. doi : 10.3310/hta17390.
- Makarawo TP, Negussie E, Malde S, et al : L’eau en tant que milieu de contraste : une réévaluation en utilisant la tomographie multidétecteur. Am Surg. 2013 Jul ; 79(7) : 728-733.
- de Gouw DJJM, Klarenbeek BR, Driessen M, et al. : Detecting Pathological Complete Response in Esophageal Cancer after Neoadjuvant Therapy Based on Imaging Techniques : A Diagnostic Systematic Review and Meta-Analysis. J Thorac Oncol 2019 Jul ; 14(7) : 1156-1171. doi : 10.1016/j.jtho.2019.04.004.
- Jiang C, Chen Y, Zhu Y, Xu Y : Systematic review and meta-analysis of the accuracy of 18F-FDG PET/CT for detection of regional lymph node metastasis in esophageal squamous cell carcinoma. J Thorac Dis 2018 Nov;10(11) : 6066-6076. doi : 10.21037/jtd.2018.10.57.
- Osugi H, Nishimura Y, Takemura M, et al : Bronchoscopic ultrasonography for staging supracarinal esophageal squamous cell carcinoma : impact on outcome. World J Surg 2003 May ; 27(5) : 590-594. doi : 10.1007/s00268-003-6784-3
- Findlay JM, Bradley KM, Maile EJ, et.al : Pragmatic staging of oesophageal cancer using decision theory involving selective endoscopic ultrasonography, PET and laparoscopy. Br J Surg, 2015 102(12) : 1488-1499.
- Lagergren J, Smyth E, Cunningham D, Lagergren P : Cancer de l’œsophage. Lancet 2017 Nov 25 ; 390(10110) : 2383-2396. doi : 10.1016/S0140-6736(17)31462-9.
- van Stijn MF, Korkic-Halilovic I, Bakker MS, et al : Preoperative nutrition status and postoperative outcome in elderly general surgery patients : a systematic review. JPEN J Parenter Enteral Nutr 2013 Jan ; 37(1) : 37-43. doi : 10.1177/0148607112445900.
- Pech O, Bollschweiler E, Manner H, et al : Comparaison entre la résection endoscopique et la résection chirurgicale de l’adénocarcinome de l’œsophage muqueux dans l’œsophage de Barrett dans deux centres à haut volume. Ann Surg 2011 Jul;254(1) : 67-72. doi : 10.1097/SLA.0b013e31821d4bf6
- Minashi K, Nihei K, Mizusawa J, et al : Efficacité de la résection endoscopique et de la chimioradiothérapie sélective pour le carcinome épidermoïde de l’œsophage de stade I. Gastroenterology 2019 Aug ; 157(2) : 382-390.e3. doi : 10.1053/j.gastro.2019.04.017.
- Thuss-Patience P, Vecchione L, Keilholz U : Should cT2 esophageal cancer get neoadjuvant treatment before surgery ? J Thorac Dis 2017 Sep ; 9(9) : 2819-2823. doi : 10.21037/jtd.2017.08.143.
- van Hagen P, Hulshof MC, van Lanschot JJ, et al. : CROSS Group. Chimioradiothérapie préopératoire pour le cancer de l’œsophage ou de la jonction. N Engl J Med 2012 May 31 ; 366(22) : 2074-2084. doi : 10.1056/NEJMoa1112088.
- Sjoquist KM, Burmeister BH, Smithers BM, et al. : Australasian Gastro-Intestinal Trials Group. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma : an updated meta-analysis. Lancet Oncol 2011 Jul;12(7) : 681-692. doi : 10.1016/S1470-2045(11)70142-5.
- Ronellenfitsch U, Schwarzbach M, Hofheinz R, et al. : GE Adenocarcinoma Meta-analysis Group. Chimiothérapie (radio) périopératoire versus chirurgie primaire pour les adénocarcinomes résécables de l’estomac, de la jonction gastro-œsophagienne et de l’œsophage inférieur. Cochrane Database Syst Rev 2013 May 31 ;(5) : CD008107. doi : 10.1002/14651858.CD008107.pub2
- Kelly RJ, Ajani JA, Kuzdzal J, et al : CheckMate 577 Investigators. Adjuvant nivolumab dans les cancers de la jonction œsophagienne ou gastro-œsophagienne réséqués. N Engl J Med 2021 avr 1 ; 384(13) : 1191-1203. doi : 10.1056/NEJMoa2032125
- Shah MA, Hofstetter WL, Kennedy EB ; Locally Advanced Esophageal Carcinoma Guideline Expert Panel : Immunotherapy in Patients With Locally Advanced Esophageal Carcinoma : ASCO Treatment of Locally Advanced Esophageal Carcinoma Guideline Rapid Recommendation Update. J Clin Oncol 2021 Oct 1;39(28) : 3182-3184. doi : 10.1200/JCO.21.01831
- Fok M, Sham JS, Choy D, et al : Radiothérapie postopératoire pour le carcinome de l’œsophage : une étude prospective randomisée et contrôlée. Surgery 1993 Feb;113(2) : 138-147.
- Walsh TN, Noonan N, Hollywood D, et al : A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 1996 Aug 15 ; 335(7) : 462-467. doi : 10.1056/NEJM199608153350702.
- Conroy T, Galais MP, Raoul JL, et al. : Fédération Francophone de Cancérologie Digestive et Groupe UNICANCER-GI. Chimioradiothérapie définitive avec FOLFOX versus fluorouracil et cisplatine chez les patients atteints de cancer de l’œsophage (PRODIGE5/ACCORD17) : résultats finaux d’un essai randomisé de phase 2/3. Lancet Oncol 2014 Mar ; 15(3) : 305-314. doi : 10.1016/S1470-2045(14)70028-2.
- Honing J, Smit JK, Muijs CT, et al : A comparison of carboplatin and paclitaxel with cisplatinum and 5-fluorouracil in definitive chemoradiation in esophageal cancer patients. Ann Oncol 2014 Mar ; 25(3) : 638-643. doi : 10.1093/annonc/mdt589.
- Hulshof MCCM, Geijsen ED, Rozema T, et al : Randomized Study on Dose Escalation in Definitive Chemoradiation for Patients With Locally Advanced Esophageal Cancer (ARTDECO Study). J Clin Oncol 2021 Sep 1 ; 39(25) : 2816-2824. doi : 10.1200/JCO.20.03697.
- Zhu WG, Xua DF, Pu J, et al : A randomized, controlled, multicenter study comparing intensity-modulated radiotherapy plus concurrent chemotherapy with chemotherapy alone in gastric cancer patients with D2 resection. Radiother Oncol 2012 Sep ; 104(3) : 361-366. doi : 10.1016/j.radonc.2012.08.024.
- Gkika E, Gauler T, Eberhardt W, et al : Résultats à long terme de la radiochimiothérapie définitive dans les cancers localement avancés de l’œsophage cervical. Dis Esophagus. 2014 Sep-Oct ; 27(7) : 678-684. doi : 10.1111/dote.12146.
- Grass GD, Cooper SL, Armeson K, et al : Cancer cervical de l’œsophage : une étude basée sur la population. Head Neck 2015 Jun ; 37(6) : 808-814. doi : 10.1002/hed.23678.
- NCCN Clinical Practice Guidelines in Oncology (Lignes directrices du NCCN) Cancers de l’œsophage et de la jonction œsophagienne version 4.2022 – septembre 7, 2022, consulté le [24 .11.2022]
- Kato K, Shah MA, Enzinger P, et al : KEYNOTE-590 : Étude de phase III de chimiothérapie de première ligne avec ou sans pembrolizumab pour le cancer de l’œsophage en phase avancée. Future Oncol 2019 Apr ; 15(10) : 1057-1066. doi : 10.2217/fon-2018-0609.
- Doki Y, Ajani JA, Kato K, et al : CheckMate 648 Trial Investigators. Nivolumab Combination Therapy in Advanced Esophageal Squamous-Cell Carcinoma. N Engl J Med 2022 Feb 3 ; 386(5) : 449-462. doi : 10.1056/NEJMoa2111380.
- Janjigian YY, Shitara K, Moehler M, et al : nivolumab de première ligne plus chimiothérapie versus chimiothérapie seule pour l’adénocarcinome gastrique, de la jonction gastro-œsophagienne et de l’œsophage en progression (CheckMate 649) : un essai de phase 3 randomisé, en ouvert. Lancet 2021 Jul 3 ; 398(10294) : 27-40. doi : 10.1016/S0140-6736(21)00797-2.
- Bang YJ, Van Cutsem E, Feyereislova A, et al : Investigateurs de l’essai ToGA. Trastuzumab en association avec la chimiothérapie versus chimiothérapie seule pour le traitement du cancer avancé de la jonction gastrique ou gastro-oesophagienne HER2-positif (ToGA) : un essai contrôlé randomisé de phase 3, en ouvert. Lancet 2010 Aug 28 ; 376(9742) : 687-697. doi : 10.1016/S0140-6736(10)61121-X.
- Amdal CD, Jacobsen AB, Guren MG, Bjordal K : Patient-reported outcomes evaluating palliative radiotherapy and chemotherapy in patients with oesophageal cancer : a systematic review. Acta Oncol 2013 mai ; 52(4) : 679-690. doi : 10.3109/0284186X.2012.731521.
- Grünberger B, Raderer M, Schmidinger M, Hejna M : Chimiothérapie palliative pour les cancers de l’œsophage récurrents et métastatiques. Anticancer Res 2007 juil-août ; 27(4C) : 2705-2714.
InFo ONKOLOGIE & HÉMATOLOGIE 2022 ; 10(6) : 6-11
PD Dr. med. Martin Leu