En ce qui concerne le traitement du traumatisme crânien grave, il existe une littérature abondante et peu de preuves. Le suivi strict d’un protocole de traitement permet d’obtenir de meilleurs résultats, et le traitement doit être effectué dans des centres spécialisés. Les causes et les déclencheurs des dommages secondaires doivent être recherchés et traités de manière agressive. Normocapnie, normoxémie, normotonie, normoglycémie, normothermie et PIC normale, resp. Les CPP sont la cible. L’ensemble de l’organisme est traité conformément aux “bonnes pratiques cliniques en médecine intensive”. Un pronostic sérieux et fiable ne peut être établi qu’à long terme. Il est déconseillé de prendre des décisions hâtives sur la base de données d’imagerie morphologique.
Le traitement en soins intensifs après un grave traumatisme crânien (TCC) représente un défi pour toute l’équipe soignante. Sont impliqués les médecins de soins intensifs, les infirmiers de soins intensifs, les neurochirurgiens, les neurologues et d’autres professionnels de l’orthophonie, de l’ergothérapie et de la physiothérapie. Le traitement interdisciplinaire, en particulier, nécessite une coordination et une direction étroites entre les professionnels. En Suisse, le traitement du SHT grave chez l’adulte ne peut donc être effectué que dans des centres dotés d’infrastructures et de personnel spécialisé. Dans la plupart des unités de soins intensifs, les patients sont traités selon un protocole de traitement strict [1–5]. Bien que les preuves de la supériorité de l’un ou l’autre protocole de traitement manquent [6], les études montrent que le suivi et l’observance d’un protocole apportent généralement un avantage au patient [7].
En Suisse, environ 715 personnes sont victimes d’un TCC grave chaque année [8]. La gravité de la blessure est généralement déterminée à l’aide du Glasgow Coma Scale (GCS) ou de l’Abbreviated Injury Score (AIS). Le TCC grave est défini comme GCS <9 ou comme AIS “head” quatre ou cinq et a une grande importance socio-économique.
Les soins intensifs sont une partie importante, mais pas la seule décisive, de la chaîne de traitement dans la prise en charge du SHT grave. Les principes des soins intensifs sont également appliqués en amont, depuis l’urgence préhospitalière jusqu’à l’admission en unité de soins intensifs, en passant par les soins cliniques d’urgence et la phase chirurgicale.
Le dommage primaire, qui résulte d’une force directe ou indirecte de très courte durée (<0,2 msec) sur la tête et le cerveau, est appelé dommage primaire. Selon les circonstances de l’accident (accident à grande vitesse), l’intensité et la direction de la force appliquée (forces d’accélération ou de rotation), celle-ci se traduit par des plaies de déchirure et d’écrasement, des fractures de la calotte crânienne (figure 1), des hémorragies extra-axiales (figure 2) et intracérébrales, des contusions des tissus cérébraux, un œdème cérébral périfocal ou généralisé et des lésions de cisaillement des neurones (“shearing injuries”). Ces dommages structurels peuvent être détectés par cCT ou cMRI et ne peuvent être inversés par aucun traitement. Après l’angio-CCT initial d’urgence en salle de déchocage (selon la cause et les circonstances de l’accident, un polytrauma-CCT peut même être réalisé), une décision interdisciplinaire doit être prise pour déterminer si une intervention chirurgicale ou une approche conservatrice est nécessaire ou non. est utile.

Éviter les dommages secondaires
Le principe de base du traitement du SHT est d’éviter les lésions dites secondaires, c’est-à-dire les lésions qui surviennent après l’accident initial. L’accent est mis sur une oxygénation suffisante du cerveau. C’est pourquoi, d’une part, tout est mis en œuvre pour permettre une offre suffisante d’oxygène au cerveau et, d’autre part, la consommation d’oxygène par le cerveau est minimisée. Cela implique un traitement volumétrique et par catécholamines agressif, une ventilation contrôlée avec des objectifs serrés en termes de paO2 et de paCO2, ainsi que l’analgosédation profonde (benzodiazépines, propofol et opioïdes) du patient.
En l’absence de techniques cliniquement viables, la pression de perfusion cérébrale (PPC) est toujours utilisée comme marqueur d’une oxygénation suffisante. Il s’agit de la différence de pression entre la pression artérielle moyenne (MAP) et la pression intracérébrale (PIC) (CPP = MAP-ICP). Pour cela, la mesure invasive de la PIC est nécessaire [9]. Le plus souvent, une sonde de pression intracrânienne est insérée dans le parenchyme cérébral ou dans le système ventriculaire. La pression intracrânienne peut ainsi être mesurée en continu. Une CPP >60 mmHg est actuellement considérée comme suffisante dans la plupart des directives. D’autres techniques d’examen peuvent être utilisées au cours du traitement, en fonction des questions posées, comme l’électrophysiologie (EEG, SSEP), les examens Doppler transcrâniens et les mesures de perfusion.
Le monitoring cérébral multimodal avec mesure locale du métabolisme du tissu cérébral, comme la microdialyse cérébrale (lactate, pyruvate, glutamate et glycérol), les mesures de l’O2 tissulaire (ptO2) et la température cérébrale, n’a pas encore réussi à s’imposer comme norme. Il n’existe actuellement pas d’études cliniques ayant démontré un bénéfice pour le patient lors de l’utilisation du monitorage multimodal, car ce sont généralement des marqueurs de substitution qui sont analysés.
Le cerveau étant entouré par le crâne osseux et la dure-mère, toute augmentation de volume intracérébral (œdème cérébral, hémorragie, accumulation de LCR, dilatation des vaisseaux veineux ou artériels) entraîne, après épuisement des mécanismes de compensation, une augmentation de la PIC et compromet ainsi la circulation sanguine intracérébrale (doctrine de Monro-Kellie). C’est pourquoi le contrôle de la PIC est, en plus de la PPC, un autre objectif thérapeutique essentiel.
Les augmentations de la PIC peuvent être d’origine intracérébrale (augmentation du volume intracérébral) ou extracérébrale [10]. Les causes extracérébrales d’une augmentation de la PIC sont l’hypoventilation/l’hypercarbie (dilatation des vaisseaux cérébraux en cas d’augmentation de la paCO2), l’hyponatrémie (aggravation de l’œdème cérébral), les chutes de tension, les hypoxémies, la fièvre due à des infections extracérébrales et les troubles de la coagulation. L’hyperglycémie ou l’hypoglycémie provoque un déficit énergétique.
Tout trouble de la coagulation doit généralement faire l’objet d’un traitement agressif, car les troubles de la coagulation entraînent des hémorragies secondaires dans les tissus cérébraux traumatisés. L’immobilité des patients souffrant d’un TCC grave augmente le risque thromboembolique, qui n’est pas traité par des médicaments au cours des premiers jours, mais uniquement par des mesures physiques telles que des bas anti-thromboemboliques (ATS) et des bas à gonflement séquentiel (“sequentiell stocking devices”, SCD).
Les lésions du SNC entraînent une neuroinflammation avec formation d’un œdème cérébral vasogénique ou cytotoxique accompagné d’une augmentation de la PIC, de nécroses et/ou d’une apoptose des neurones. L’administration de stéroïdes à haute dose ne peut pas supprimer cette neuroinflammation et entraîne même un moins bon résultat neurologique [11,12]. L’absence d’administration de stéroïdes est l’une des très rares recommandations dans le traitement du TCC sévère avec un niveau de preuve de grade I. Les patients sont souvent traités avec des médicaments à base de stéroïdes.
Si le traitement conservateur initial ou le traitement post-neurochirurgical ne permet pas de stabiliser la PIC, une imagerie doit être réalisée en urgence pour exclure une hémorragie secondaire, un œdème cérébral ou une accumulation de liquide céphalorachidien (figure 3). Une option chirurgicale est discutée avec les neurochirurgiens, comme l’évacuation de l’hématome, l’hémicraniectomie [13] et/ou le drainage du LCR. Si aucune option chirurgicale n’est possible, l’escalade se poursuit selon un schéma progressif (analgosédation profonde, myorelaxation, osmothérapie avec du mannitol ou du sérum hypertonique, hypothermie thérapeutique et coma barbiturique) [14].
Après stabilisation, qui n’intervient souvent qu’après plusieurs jours, un essai de réveil peut être réalisé sous le contrôle strict de l’ICP. Cette phase de réveil se caractérise par une réaction de stress massive de l’organisme, qui doit être supprimée en conséquence par des médicaments.
Traiter l’organisme dans son ensemble
Un autre principe de base est d’établir l’homéostasie et de traiter l’organisme dans son ensemble, pas seulement le SHT. En particulier chez les blessés multiples, les principes de traitement spécifiques aux organes peuvent entrer en concurrence les uns avec les autres, comme par exemple dans le cas d’une atteinte pulmonaire grave avec une stratégie de ventilation protectrice combinée à un TCC grave (pas d’hypoventilation en raison de la vasodilatation et de l’augmentation de la PIC).
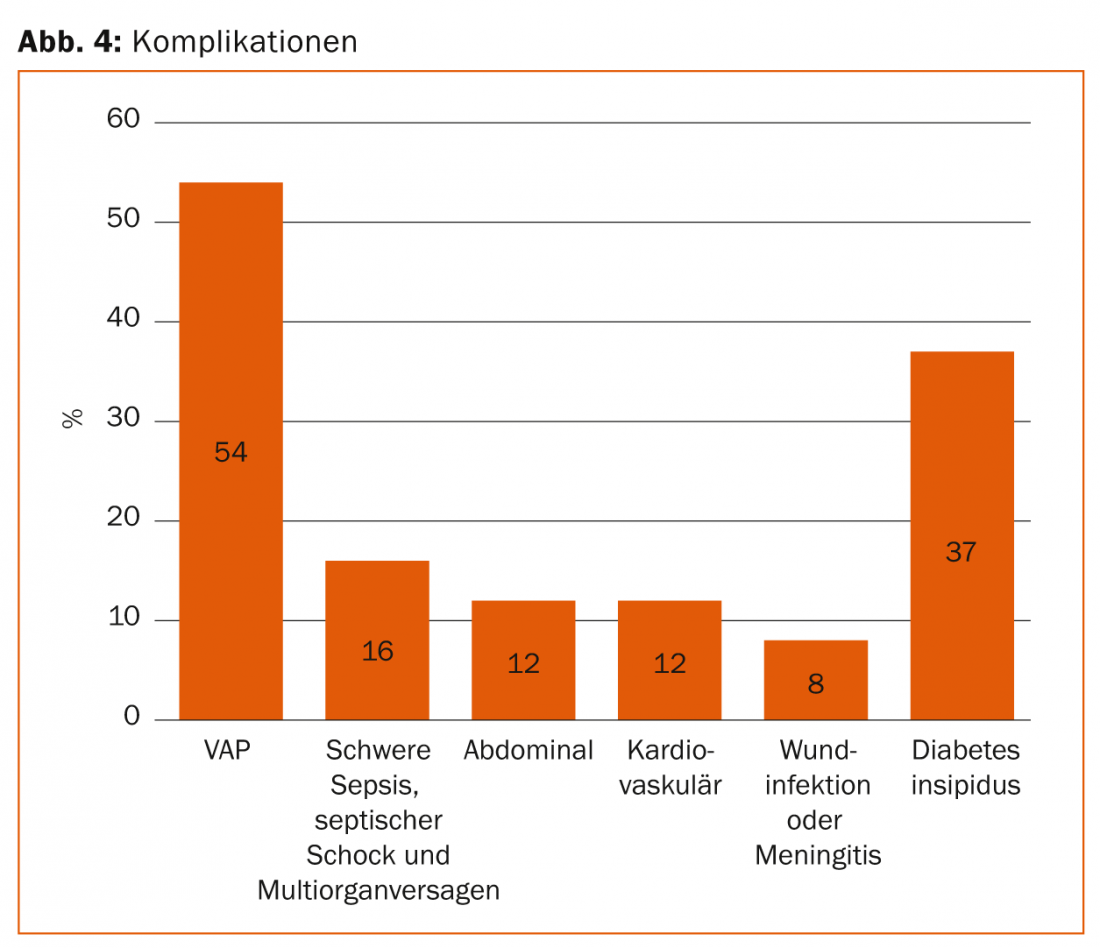
Les soins intensifs réguliers à long terme entraînent des complications telles que la pneumonie associée à la ventilation (PAVM), la paralysie intestinale avec un développement nutritionnel problématique, la translocation de bactéries intestinales suivie d’une septicémie, une catabolisme sévère (dégradation musculaire) et une défaillance multiorganique (figure 4).
Neuroréhabilitation et pronostic
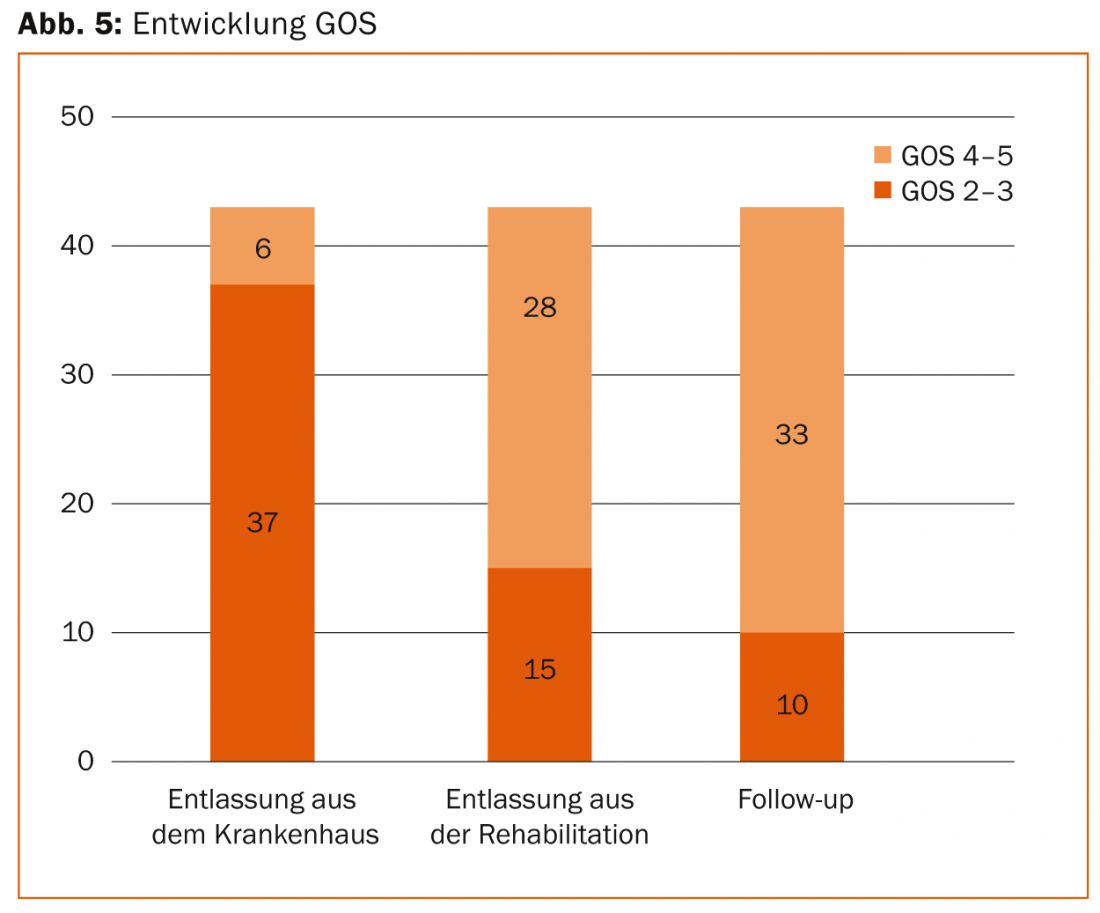
Après la phase de soins intensifs, chaque patient souffrant d’un TCC grave a besoin d’une neuroréhabilitation de plusieurs semaines à plusieurs mois. La neuroréhabilitation précoce, qui est initiée dès la phase de réveil en soins intensifs et se poursuit ensuite dans des cliniques spécialisées, peut dans de nombreux cas apporter une nette amélioration de la neurologie. Ainsi, nos propres données rétrospectives ont montré que les trois quarts des patients ayant subi un TCC grave quittaient l’unité de soins intensifs avec des déficits neurologiques graves (GOS 2-3) pour la neuroréhabilitation, pour pouvoir, des mois plus tard, revenir de la neuroréhabilitation dans la vie quotidienne de manière autonome dans trois quarts des cas avec un bon état neurologique (GOS 4-5). (Fig. 5).
Un pronostic neurologique fiable ne peut donc être établi qu’après plusieurs semaines, mois ou même un an si la phase critique initiale d’instabilité a survécu. En effet, la plupart des patients souffrant d’un TCC grave meurent dans les premiers jours en raison d’une PIC incontrôlable, qui entraîne la suspension de la perfusion cérébrale et donc la mort cérébrale. Dans de telles situations, la question du don d’organes se pose et doit être abordée avec les proches – conformément à la volonté présumée du patient – car il est rare que les jeunes patients disposent de directives anticipées ou d’une carte de donneur d’organes. L’équipe de soins intensifs est donc très sollicitée dans le choix de l’intensité du traitement. Ce sont les personnes âgées et les personnes très âgées qui sont le plus souvent victimes d’un TCC grave et, en raison des réserves d’organes limitées par l’âge et du manque de potentiel de réadaptation, la question de l’intensité du traitement se pose de manière très explicite. Pour ce type de blessure en particulier, la maxime “survivre à tout prix” n’est pas la bonne conseillère. Les séquelles neurologiques sont souvent si graves que l’objectif thérapeutique des soins intensifs doit être modifié en accord avec la volonté présumée du patient, ce qui conduit à un traitement palliatif.
Dans la plupart des cas, les patients souffrant d’un TCC grave présentent des handicaps cognitifs, moteurs, sensoriels, psychologiques et donc sociaux à des degrés divers, qui doivent être pris en considération et pris en compte par les personnes chargées du suivi. Chaque patient doit donc faire l’objet d’un suivi individuel et centré sur le patient.
Liens utiles :
www.braintrauma.org
www.snacc.org
www.dgnc.de
www.pebita.ch
www.swissneurosurgery.ch
www.swissneuro.ch
www.awmf-online.de
Littérature :
- The Brain Trauma Foundation : The American Association of neurological Surgeons ; Congress of Neurological Surgeons : Guidelines for the management of severe traumatic brain injury. J Neurotrauma 2007 ; 24(Suppl 1) : S1-S106.
- Maas AI, et al : EBIC-guidelines for management of severe head injury in adults. Consortium européen des traumatismes crâniens. Acta Neurochir (Vienne) 1997 ; 139(4) : 286-294.
- Grände PO : Le “concept de Lund” pour le traitement des traumatismes crâniens graves – principes physiologiques et application clinique. Soins intensifs Med 2006 ; 32(10) : 1475-1484.
- Welling KL, Eskesen V, Romner B, The Danish Neurotrauma Committee : Neurointensive care of severe traumatic brain injury. Ugeskr Laeger 2010 ; 172 : 2091-2094.
- Menon DK : Protection cérébrale dans les traumatismes crâniens graves : les déterminants physiologiques de l’issue et leur optimisation. Br Med Bull 1999 ; 55(1) : 226-258.
- Sundstrøm T, et al. : Gestion des lésions cérébrales traumatiques graves. Evidence, astuces, et pitfalls. Springer 2012. ISBN 978-3-642-28125-9.
- Gerber LM, et al : Réduction marquée de la mortalité chez les patients souffrant de lésions cérébrales traumatiques graves. J Neurosurg 2013 ; 119 : 1583-1590.
- Walder B, et al : Traumatisme cérébral grave dans un pays à revenu élevé : une étude épidémiologique. Journal of Neurotrauma 2013 ; 30 : 1934-1942.
- Chesnut RM, et al : A trial of intracranial-pressure monitoring in traumatic brain injury. New England Journal of Medicine 2012 ; 367(26) : 2471-2481.
- Maas AI, Stocchetti N, Bullock R : Traumatisme cérébral modéré et sévère chez l’adulte. Lancet Neurol 2008 ; 7(8) : 728-741.
- CRASH trial collaborators : Effects of intravenous corticosteroids on death within 14 days in 1008 adults with clinically significant head injury (MRC CRASH trial) : randomised placebo-controlled trial. Lancet 2004 ; 364 : 1321-1328.
- CRASH trial collaborators : Final results of MRC CRASH : a randomised placebo-controlled trial of intravenous corticosteroid in adults with head injury-outcomes at 6 months. Lancet 2005 ; 365 : 1957-1959.
- Cooper DJ, et al. pour les investigateurs de l’essai DECRA et le groupe d’essais cliniques australien et de la Nouvelle-Zélande de la société de soins intensifs : Decompressive craniectomy in diffuse traumatic brain injury. New England Journal of Medicine 2011 ; 364(16) : 1493-1502.
- Stubbe H, Wölfler J : Traumatisme crânien chez l’adulte. Médecine intensive up2date 2012 ; 8 : 253-269.
InFo NEUROLOGIE & PSYCHIATRIE 2015 ; 13(2) : 10-14











