Le pyoderma gangraenosum est une plaie d’origine immunologique dont la pathogenèse exacte n’a pas encore été élucidée. Le score de Paracelse est un outil validé important pour le diagnostic de ces ulcérations extrêmement douloureuses, qui se produisent de préférence sur les faces d’extension des membres inférieurs. La thérapie repose sur plusieurs piliers, le traitement systémique occupant une place centrale.
Cliniquement, le pyoderma gangraenosum (PG) se présente sous la forme d’ulcérations douloureuses dont les bords sont souvent sous-minés par des érythèmes livide. “Joachim Dissemond, Clinique et polyclinique de dermatologie, vénérologie et allergologie, Hôpital universitaire d’Essen [1]. Le PG est classé comme une dermatose neutrophilique rare, primaire et stérile. La qualité de vie des personnes concernées peut être considérablement affectée et il ne faut pas oublier qu’un PG met potentiellement leur vie en danger [2].
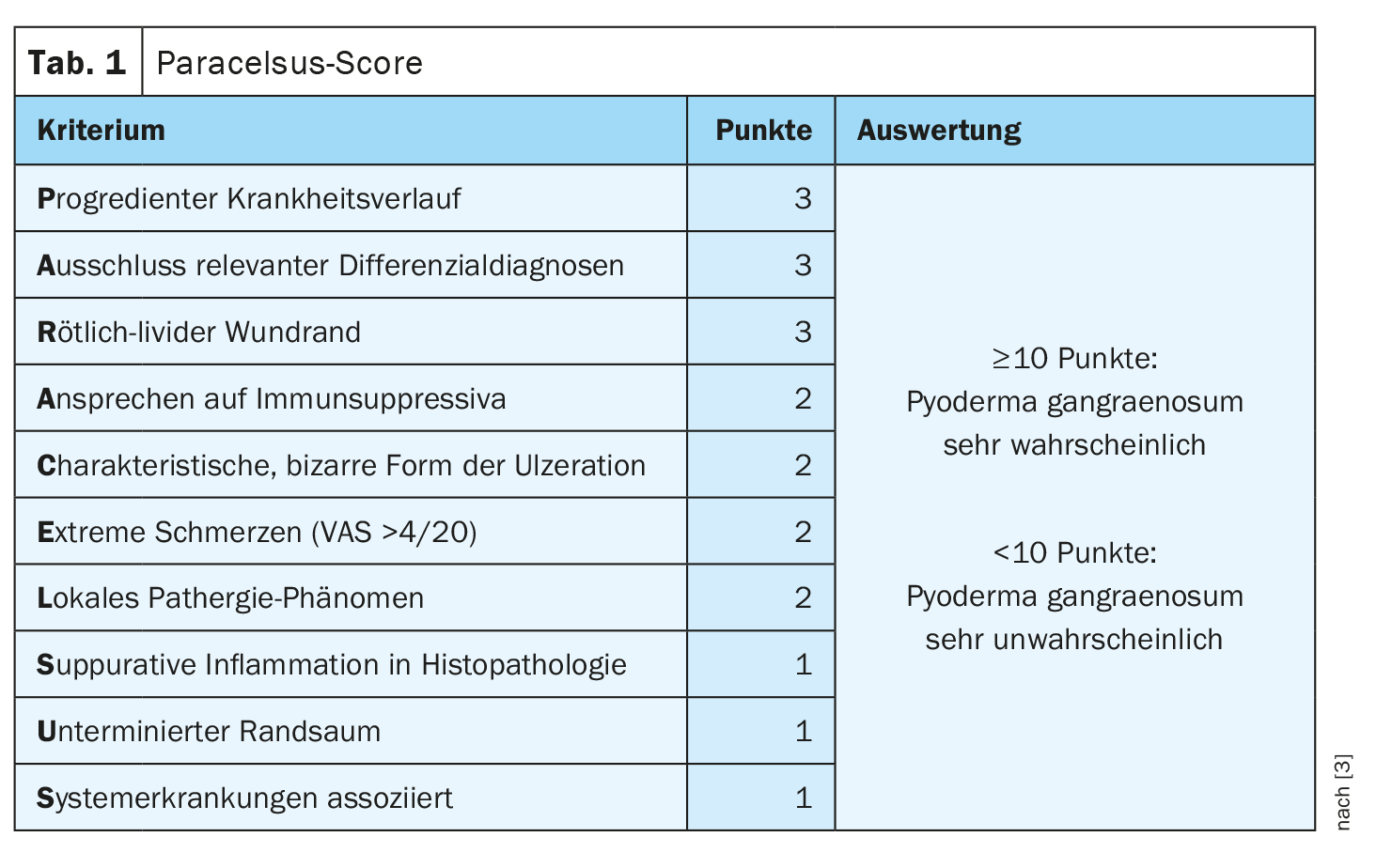
En cas de suspicion, le score de Paracelsus est utile
L’inflammation est une composante essentielle du PG, et l’aspect inflammatoire est souvent confondu avec l’infection, ce qui peut conduire à l’utilisation d’antibiotiques à tort. “Nous essayons d’exclure les diagnostics différentiels”, ajoute le professeur Dissemond. Un PG peut en principe se développer n’importe où, mais il existe un site de prédilection clair : dans 70% des cas, les faces d’extension des membres inférieurs sont touchées. Chez les femmes, la deuxième localisation la plus fréquente est la région mammaire. “Souvent, le pyoderme apparaît là où il y a eu un traumatisme”, même s’il peut s’agir de petites blessures, comme l’explique le conférencier. Les diagnostics différentiels importants ayant un aspect similaire au PG mais un traitement différent comprennent la vascularite, la livedovasculopathie, la calciphylaxie, l’ulcus hypertonicum Martorell et les plaies artificielles.
Le score de Paracelsus est actuellement considéré comme le meilleur score de diagnostic validé [3]. Trois points sont attribués pour un critère principal, deux points pour un critère secondaire et un point pour chaque critère supplémentaire. Un score additif de ≥10 rend la présence d’un PG très probable (tableau 1). Une évolution progressive de la maladie et l’exclusion de diagnostics pertinents sont les deux premiers critères principaux mentionnés. La bordure rougeâtre-violacée est une caractéristique très importante, mais non spécifique, de l’inflammation. “Comme il s’agit d’une maladie auto-inflammatoire, elle devrait répondre à l’immunosuppression”, explique le professeur Dissemond. Morphologiquement, on remarque une forme bizarre caractéristique de l’ulcération. Le caractère extrêmement douloureux est également un critère de Paracelse. “Un pyoderma gangraenosum fait mal”, souligne le conférencier. En ce qui concerne le phénomène de pathergie locale – une réaction cutanée spécifique à une maladie et à un stimulus non spécifique – il convient de noter qu’il peut également être négatif. Pour effectuer le test de pathergie, injecter 1 ml de NaCl 0,9%. Si une pustule, une rougeur ou une inflammation riche en neutrophiles se développe dans les 48 heures, cela peut être considéré comme un phénomène positif de pathergie [2]. Un examen histopathologique ne doit pas non plus être omis. Les biopsies sont généralement effectuées dans la zone périphérique de l’ulcération, une petite biopsie étroite du fuseau étant la plus appropriée, a déclaré le conférencier. Une inflammation suppurative à l’histopathologie est en faveur d’un PG. Il faut toutefois savoir que le résultat peut rester incertain. Une bordure livide sous-minée est une caractéristique importante du diagnostic différentiel avec la livedovasculopathie et un autre critère de Paracelsus [4]. En outre, on sait que l’association avec d’autres maladies systémiques est fréquente chez le PG.
Le pyoderma gangraenosum est souvent associé à des comorbidités
De 9 à 36% des patients souffrent d’une maladie inflammatoire chronique de l’intestin (colite ulcéreuse, maladie de Crohn) et de 8 à 33% d’une polyarthrite rhumatoïde. Le professeur Dissemond sait que ces comorbidités ne sont pas le fruit du hasard. “Nous parlons ici d’une maladie inflammatoire systémique qui présente de nombreuses similitudes avec d’autres symptômes auto-inflammatoires”. Ce que l’on oublie souvent, c’est qu’il s’agit d’une maladie potentiellement paranéoplasique. 4 à 21% des patients présentent une néoplasie associée d’origine étiologique (syndrome myélodysplasique, carcinome des cellules rénales). Il vaut donc la peine de faire un hémogramme différentiel. En plus de ces associations connues depuis de nombreuses années, il semble qu’il y ait également une augmentation de l’incidence de différentes maladies du syndrome métabolique (par exemple, l’hypertension artérielle, le diabète sucré, les troubles du métabolisme des lipides) [2]. En outre, il existe des manifestations d’un PG dans le cadre de maladies auto-inflammatoires (par exemple, le syndrome PAPA, le syndrome PASH, le syndrome PA-PASH).

La thérapie systémique est essentielle
En raison de la rareté de la maladie et du manque de preuves sous forme d’essais cliniques randomisés (ECR), il n’existe pas de norme thérapeutique unique pour le pyoderma gangraenosum, mais la ligne directrice fournit des recommandations basées sur des rapports de cas et l’expertise clinique (Figure 1) [2]. Un traitement systémique immunosuppresseur est indiqué chez la plupart des patients atteints de PG, en particulier en cas de forte activité de la maladie et de lésions multiples ou après l’échec d’un traitement topique [2]. Parmi les traitements systémiques, les glucocorticoïdes (prednisone, 0,5-1 mg/kg PC) sont les plus utilisés, suivis de la ciclosporine (2-5 mg/kg PC), en monothérapie ou en association [5]. Parmi les traitements systémiques de second rang, également fréquemment utilisés, on trouve les inhibiteurs du TNFα, l’azathioprine (100-150 mg/j) ou le mycophénolate mofétil [5]. En complément, resp. en cas d’évolution initiale et légère de la maladie, des options thérapeutiques topiques et intralésionnelles locales sont utilisées. En phase aiguë, on peut utiliser un corticostéroïde topique de classe de puissance III ou IV ou un inhibiteur topique de la calcineurine. La thérapie systémique est toutefois clairement le pilier le plus important du traitement. Cependant, les lignes directrices déconseillent une monothérapie prolongée par glucocorticoïdes systémiques en raison des effets secondaires indésirables [2]. Par conséquent, ou en cas d’efficacité insuffisante d’une monothérapie par glucocorticoïdes, une association précoce avec des immunosuppresseurs épargnant les stéroïdes tels que la ciclosporine ou l’azathioprine, ou encore des inhibiteurs du TNF-α, ou encore une monothérapie par inhibiteurs du TNF-α, est recommandée. Les anticorps monoclonaux infliximab, adalimumab, golimumab et certolizumab pegol ou étanercept constituent le traitement de choix lorsque le PG accompagne une polyarthrite rhumatoïde ou une maladie inflammatoire chronique de l’intestin. Dans le cas contraire, ces antagonistes du TNF-α constituent un usage hors AMM. Les immunoglobulines intraveineuses (0,5-2 g/kg PC) sont également recommandées comme option thérapeutique immunomodulatrice dans la ligne directrice, bien qu’il s’agisse d’un traitement relativement coûteux [1,2]. En outre, la ligne directrice mentionne quelques autres traitements systémiques à évaluer (figure 1).
Congrès : Congrès sur les plaies de Nuremberg
Littérature :
- «Update Pyoderma gangraenosum», Prof. Dr. Joachim Dissemond, Wundkongress Nürnberg, 01.12.2022.
- S1-Leitlinie “Pyoderma gangrenosum”, AWMF-Register-Nr. : 013-091, 2020, https://register.awmf.org/assets/guidelines/013-091l_S1_Pyoderma-gangre
nosum_2020-10_1.pdf, (dernière consultation 13.12.2022). - Jockenhöfer F, et al : The PARACELSUS score : a novel diagnostic tool for pyoderma gangrenosum. Br J Dermatol 2019 ; 180 : 615-620.
- Schiffmann ML, et al. S1-Leitlinie Diagnostik und Therapie der Livedovaskulopathie. J Dtsch Dermatol Ges 2021; 19(11): 1667–1678.
- Al Ghazal P, Dissemond J: Therapy of pyoderma gangrenosum in Germany: results of a survey among wound experts. J Dtsch Dermatol Ges. 2015; 13: 317–324.
HAUSARZT PRAXIS 2023; 18(1) : 30–31 (publié le 26.1.23, ahead of print)