Chez les patients atteints d’arthrite psoriasique qui ne répondent pas suffisamment aux DMARD conventionnels ou à un médicament biologique, les recommandations de l’EULAR conseillent d’utiliser un inhibiteur de JAK. Récemment, l’upadacitinib, un autre représentant de ce groupe de médicaments, a reçu une extension d’indication pour l’arthrite psoriasique. Cette autorisation est basée sur les études SELECT-PsA 1 et 2.
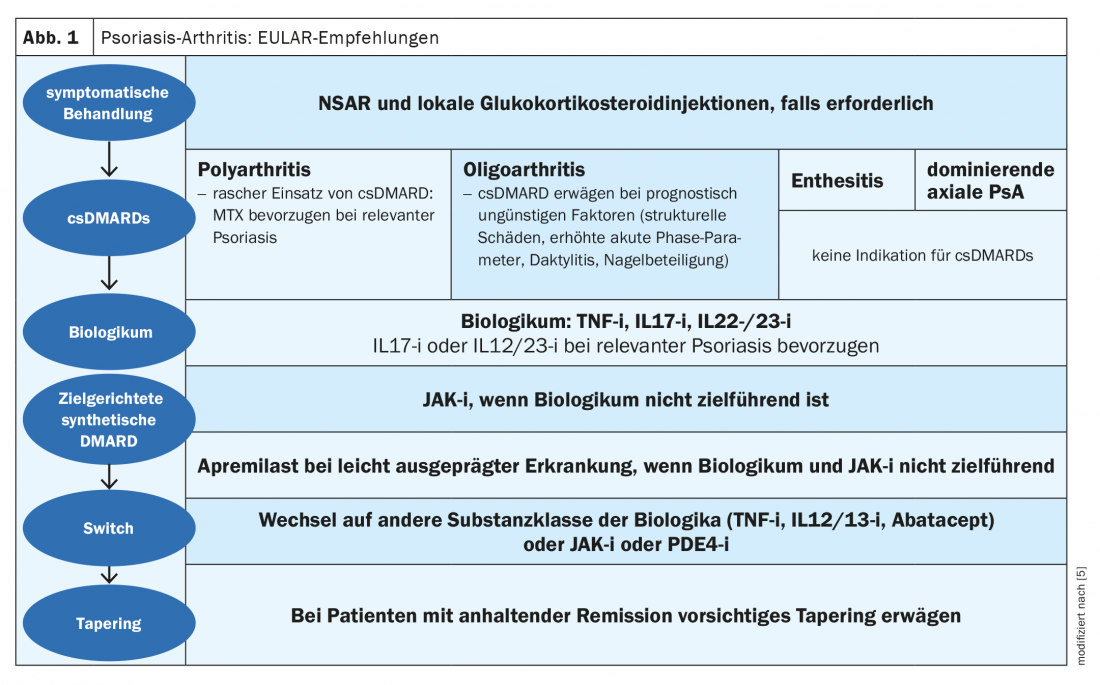
Jusqu’à 30% des patients atteints de psoriasis en plaques développent une arthrite psoriasique (PsoA) au cours de la maladie [1]. La classification CASPAR (“Classification Criteria for Psoriatic Arthritis”) sert à établir le diagnostic. Cet outil de diagnostic détecte, entre autres, la sacro-iliite, l’enthésite, la dactylite et l’atteinte unguéale. Plusieurs études cliniques ont été menées pour déterminer si l’upadacitinib (Rinvoq®), un inhibiteur de JAK autorisé en Suisse depuis janvier 2020 pour le traitement de la polyarthrite rhumatoïde, était également efficace dans d’autres maladies impliquant les articulations, comme l’arthrite psoriasique et la spondylarthrite ankylosante [2]. L’upadacitinib est un inhibiteur oral sélectif de la Janus kinase (JAK1). Dans les recommandations de l’EULAR, les inhibiteurs de JAK sont proposés comme option thérapeutique pour le traitement de l’arthrite psoriasique en cas d’échec d’un premier médicament biologique (Fig. 1) [5].
SELECT-PsA 1 et 2
Après la présentation des résultats de l’étude de phase III randomisée, en double aveugle et contrôlée par placebo SELECT-PsA 2 sur l’EULAR en ligne l’an dernier, la publication des données complètes de Mease et al. publié [3,4]. Alors que l’étude SELECT-PsA 1 comportait une comparaison directe avec l’adalimumab, l’étude SELECT-PsA 2, plus petite, a évalué l’upadacitinib chez des patients adultes atteints de psoA active (SJC ≥3 et TJC ≥3) selon les critères CASPAR et en échec ou intolérants aux bDMARD ≥1. Dans cette étude, 642 patients (54% de femmes, âge moyen de 53 ans, 10 ans depuis le diagnostic du psoA) ont été traités par upadacitinib 15 mg ou 30 mg une fois par jour pendant 24 semaines, dans un rapport 2:2:1:1. mg ou un placebo (stratifiés selon la prise de csDMARD, le nombre de bDMARD antérieurs et le degré de psoriasis), puis les patients sous placebo ont changé pour l’upadacitinib 15 mg ou 30 mg. 61% des participants n’avaient pas suffisamment répondu à un bDMARD, 18% à deux et 13% à ≥3, les moyennes SJC66 (“Swollen Joint Count” avec 66 articulations) et TJC68 (“Tender Joint Count” avec 68 articulations) à la ligne de base étaient respectivement de 12 et 25.
Soulagement des symptômes articulaires et cutanés
Le critère d’évaluation principal était la réponse ACR20 à la semaine 12, les critères d’évaluation secondaires étant, entre autres, la réponse ACR50/70, la réponse PASI 75/90/100, l’obtention d’une activité minimale de la maladie (MDA) et la disparition de l’enthésite et de la dactylite. Les meilleurs résultats thérapeutiques ont été systématiquement obtenus avec la dose de 30 mg, qui s’est également révélée supérieure à l’adalimumab dans SELECT-PsA 1 (ACR20, HAQ-DI et douleur) [3,4]. A la semaine 12, un nombre significativement plus élevé de patients sous upadacitinib 15 mg et 30 mg ont obtenu une réponse ACR20 (56,9% et 63,8% vs 24,1% ; p<0,0001 chacun). Un résultat similaire a été obtenu pour la réponse ACR50/70 (31,8% et 37,6% vs 4,7% et 8,5% et 16,5% vs 0,9%, respectivement ; p<0,05). Les deux bras d’upadacitinib ont également obtenu des résultats significativement meilleurs sur tous les autres critères d’évaluation secondaires à la semaine 12, notamment le ΔHAQ-DI (-0,30 et -0,41 vs -0,10), le ΔSF-36 PCS (5,2 et 7,1 vs 1,6) et le ΔFACIT-F (5,0 et 6,1 vs 1,3) (chacun p<0,0001). Les réponses cutanées à la semaine 24 (PASI 75/90/100 : 53,8% et 62,6% vs 19,1% ; 36,2% et 46,6% vs 6,9% ; 22,3% et 33,6% vs 4,6%) et la réduction des symptômes d’enthésite (LEI=0 : 39% et 48% vs 20%) et de dactylite (LDI=0 : 64% et 76% vs 36%) à la semaine 12 ont également été supérieures à celles de l’upadacitinib 15 mg et 30 mg. mg est significativement supérieure à celle du placebo. Le profil de sécurité de l’upadacitinib a été conforme aux attentes, tous les événements indésirables liés au traitement étant légèrement plus fréquents avec la dose de 30 mg qu’avec l’upadacitinib 15 mg ou le placebo. Des infections graves sont survenues chez 0,5% des participants à l’étude sous placebo et Upadacitinib 15 mg et chez 2,8% des participants à l’étude sous Upadacitinib 30 mg, respectivement. 0,9%, 1,4% et 3,7% des participants ont développé un zona.

Sur la base des résultats des études SELECT-PsA 1 et 2, l’upadacitinib a récemment obtenu une extension d’indication pour l’arthrite psoriasique en Suisse (encadré). Au total, l’upadacitinib est le premier et actuellement le seul inhibiteur de JAK à pouvoir être utilisé à la fois dans la polyarthrite rhumatoïde, la spondylarthrite ankylosante et l’arthrite psoriasique [2,7]. Afin de minimiser le risque d’effets secondaires, la protection vaccinale des patients doit être mise à jour avant le début du traitement, conformément aux recommandations actuelles en matière de vaccination [6]. L’utilisation de vaccins vivants atténués est déconseillée pendant ou juste avant le début du traitement par upadacitinib [6].
Littérature :
- Huhn CK, et al : JDDG 2019 ; 17(1) : 43-66.
- Swissmedic : www.swissmedic.ch (dernière consultation 29.03.2021)
- Rheumamanagement-online.de : Arthrite psoriasique : www.rheumamanagement-online.de, 01.03.2021, (dernière consultation 29.03.2021)
- Mease PJ : Psoriatic arthritis : Upadacitinib for psoriatic arthritis refractory to biologics : SELECT-PsA 2 Rheum Dis 2020 ; doi : 10.1136/annrheumdis-2020-218870
- Lunzer R, Nothnagl T : Eular 2020 : bref aperçu – pertinent pour la pratique … ! Rhumatisme Plus. 2020 Sep 9 : 1-3.
- Brochure d’information pour les médecins, version 2.0, janvier 2021, https://www.bfarm.de, (dernière consultation 31.03.21)
- Keim J, www.medizinonline.ch/artikel/neue-therapieoption-bei-ankylosierender-spondylitis-und-psoriasis-arthritis-1, (dernière consultation 31.03.21)
- van der Heijde D, et al. : Efficacité et sécurité de l’upadacitinib chez les patients atteints de spondylarthrite ankylosante active (SELECT-AXIS 1) : un essai multicentrique, randomisé, en double aveugle, contrôlé par placebo, phase 2/3. Lancet, 2019. 394(10214) : 2108-2117.
- McInnes I, et al. : Efficacité et sécurité de l’upadacitinib versus placebo et adalimumab chez les patients atteints d’arthrite psoriasique active et ne répondant pas suffisamment aux médicaments anti-rhumatismaux modifiant la maladie non biologique (SELECT-PsA-1) : un essai contrôlé randomisé en double aveugle de phase 3 [abstract LB0001]. Ann Rheum Dis 2020. 79(Suppl 1) ; 16 : 2-17.
DERMATOLOGIE PRATIQUE 2021 ; 31(2) : 46-47