Le renforcement des défenses de l’organisme à l’aide d’extraits bactériens pris par voie orale peut contribuer à lutter contre les infections respiratoires chez l’homme. Dans une étude récente, les mécanismes d’action sous-jacents de ce bénéfice immunologique ont été analysés en utilisant le coronavirus murin (MCoV) dans un modèle de souris.
Des études antérieures ont démontré que la prise du lysat bactérien OM-85-BV (Broncho-Vaxom®) chez l’homme entraînait à la fois une réduction significative de la fréquence des infections respiratoires récurrentes et une réduction de la durée totale des infections respiratoires [1–3]. Afin d’étudier les mécanismes cellulaires et moléculaires impliqués, les effets du traitement par OM-85-BV sur le coronavirus murin (MCoV) A59 ont été analysés. Il a été démontré que le traitement par OM-85-BV entraîne une réduction de la charge virale, une accumulation de macrophages interstitiels dans les tissus pulmonaires et une réponse plus rapide de la signalisation de l’interféron de type I qui y est associée [4].
Réduction massive du virus aux jours 4 et 10
74 souris de laboratoire ont été réparties dans un groupe de traitement et un groupe de contrôle selon un rapport 1:1. Les animaux de laboratoire dans la condition verum ont reçu 7,2 mg d’OM-85-BV administré par voie orale (dissous dans 200 μL de D-mannitol à 3%) sur une période de 10 jours [4]. Les souris de la condition contrôle ont reçu 200 μL de D-mannitol à 3%. Les échantillons de tissus ont été analysés 2, 4 et 10 jours après l’infection intranasale par le MCoV par PCR quantitative (qPCR), séquençage de l’ARN, histologie et cytométrie de flux. Pour mesurer la charge virale, les deux marqueurs viraux Nsp12 et PolyU ont été déterminés dans les poumons par PCR quantitative (qPCR). Il s’est avéré que les souris dont le système immunitaire avait été entraîné par le lysat bactérien présentaient une réduction massive du virus au jour 4, qui a persisté au jour 10.
Accumulation pulmonaire spécifique de macrophages interstitiels
Les macrophages constituent la première ligne de défense jusqu’à ce que des cellules B et T spécifiques combattent l’infection. La population homéostatique des macrophages pulmonaires comprend, outre les macrophages alvéolaires d’origine embryonnaire, des macrophages interstitiels issus de monocytes circulants [5,6]. Les macrophages alvéolaires n’ont pas été modifiés par le traitement et ont été progressivement réduits pendant l’infection, comme prévu. Cependant, une augmentation des macrophages interstitiels a été observée après le traitement par OM-85-BV et avant l’infection virale [4]. Dans le groupe traité par le verum, l’accumulation de macrophages interstitiels dans le tissu pulmonaire après une infection par le MCoV a entraîné une réponse plus rapide de la signalisation de l’interféron de type I. Dans le groupe traité par le verum, la réponse de la signalisation de l’interféron de type I a été plus rapide que dans le groupe traité par le verum. Le séquençage de l’ARN a également montré que les tissus pulmonaires des animaux de laboratoire ayant reçu l’OM-85-BV étaient plus sensibles aux effets de l’OM-85-BV le jour de l’étude. 4 ressemblait à un stade intermédiaire entre le tissu pulmonaire sain et le tissu pulmonaire infecté par un virus, ce qui suggère un retour plus rapide à l’homéostasie tissulaire normale. Pour consulter Pour déterminer si la modulation du système immunitaire des poumons est spécifique à l’organe, les chercheurs ont analysé les monocytes et les macrophages de la rate avant et pendant l’infection par le MCoV. Indépendamment de la OM-85-BV, aucune différence n’a été observée en termes de quantité de monocytes dans la circulation sanguine ou de macrophages dans la rate, ni au début de l’étude ni pendant l’infection par le MCoV. Cela indique une accumulation spécifique aux poumons de macrophages interstitiels induite par le prétraitement OM-85-BV.
Amélioration de la clairance virale et réduction de la charge apoptotique des poumons
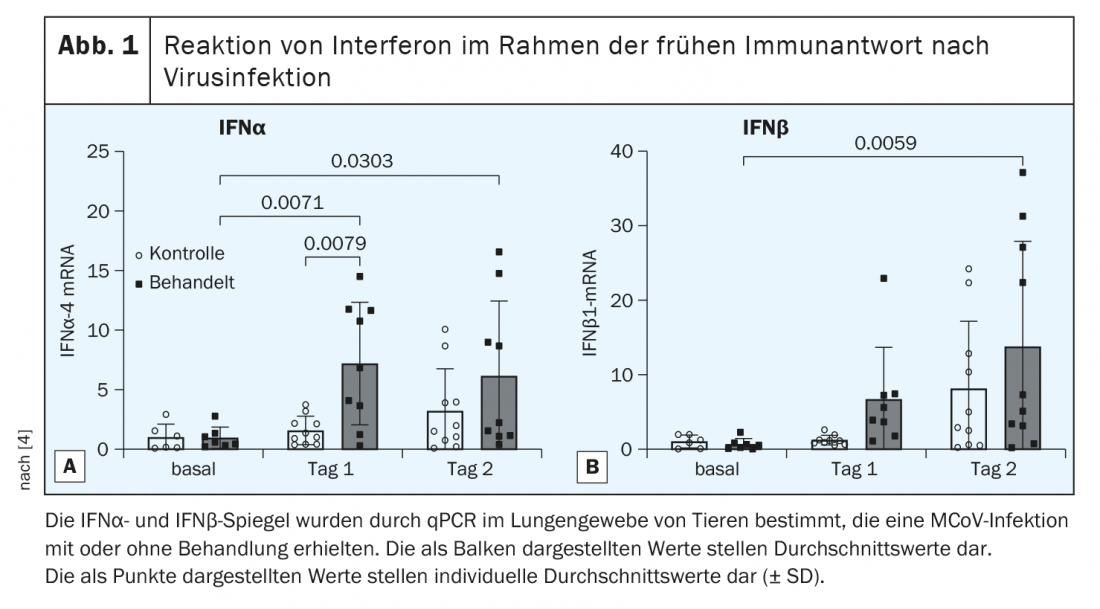
Les infections virales s’accompagnent d’une apoptose des cellules hôtes [7]. Les animaux traités ont montré une réduction de la charge apoptotique du tissu pulmonaire aux jours 4 et 10 par rapport au groupe témoin. En outre, les données indiquent que le prétraitement par OM-85-BV a amélioré la réponse initiale à l’infection virale et a entraîné une clairance plus rapide du MCoV, probablement par l’induction de l’interféron de type I (IFN). Par conséquent, les valeurs initiales et les valeurs d’activation de la voie de signalisation de l’IFN ont été mesurées les jours 1 et 2 après l’infection. Le traitement par OM-85-BV n’a pas augmenté les taux initiaux d’IFNα, mais une induction forte et significative d’IFNα a été observée le jour 1 chez les animaux traités avec OM-85-BV (Fig. 1A) [4]. L’IFNβ a été induite de manière significative chez les animaux traités le jour 2 (Fig. 1B) [4]. Dans l’ensemble, les résultats indiquent une forte régulation à la hausse de la réponse de l’IFN de type I Tag 1 après le traitement avec OM-85-BV. Au niveau cellulaire, la mesure cytométrique de flux a montré que le jour 1 chez les animaux traités par OM-85-BV, les macrophages CD45+CD64+ et les non-leucocytes CD45, en particulier, présentaient une quantité significativement plus élevée de protéine régulatrice du facteur 1 de l’interféron que les souris de laboratoire du groupe témoin.
Littérature :
- Information sur les médicaments, www.swissmedicinfo.ch (dernière consultation 24.01.2022)
- Yin J, et al : Int Immunopharmacol 2018 ; 54 : 198-209.
- Razi, CH et al : J Allergy Clin Immunol 2010 ; 126(4):763-769.
- Salzmann M, et al. : Journal of Innate Immunity 2021 ; 1-13.
- Gomez Perdiguero E, et al. : Nature 2015 ; 518 : 547-551.
- Schneberger D, Aharonson-Raz K, Singh B : Cell Tissue Res 2011 ; 343 : 97-106.
- Herold S, et al : J Exp Med 2008 ; 205 : 3065-3077.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(2) : 18